Toksykologja chemicznych środków bojowych/całość
| <<< Dane tekstu | ||
| Autor | ||
| Tytuł | Toksykologja chemicznych środków bojowych | |
| Podtytuł | z 17 rysunkami oraz atlasem | |
| Wydawca | Wojskowy Instytut Naukowo-Wydawniczy | |
| Data wyd. | 1925 | |
| Druk | Druk J. B. Kondeckiego | |
| Miejsce wyd. | Warszawa | |
| Źródło | Skany na Commons | |
| Inne | Pobierz jako: EPUB | |
| ||
| Indeks stron | ||
|
Dr WŁODZIMIERZ LINDEMAN
PROFESOR UNIWERSYTETU WARSZAWSKIEGO
TOKSYKOLOGJA CHEMICZNYCH ŚRODKÓW BOJOWYCH
Z 17 RYSUNKAMI ORAZ ATLASEM
WARSZAWA 1925
WOJSKOWY INSTYTUT NAUKOWO-WYDAWNICZY
Druk J. B. Kondeckiego, Warszawa, Marszałkowska 53a. Telefon 268-08.
|
Toksykologję jako naukę o truciznach, rozpatrywać można z różnych punktów widzenia. Dotychczas punktami temi były: 1) zadania i dążenia lekarskie, mające na celu zapobieganie powstawania trucizn, oraz usuwanie następstw już powstałych zatruć. Zainteresowanie lekarzy zwrócone było przeważnie na zatrucia o charakterze masowym, do których należą zatrucia pokarmowe, zawodowe i nałogowe. 2) Zadania medycyny sądowej — dążącej do najlepszych sposobów ustalania rodzaju zatruć na podstawie chemicznych i morfologicznych badań wydzielin zatrutych oraz trupów. 3) Potrzeba wynalezienia wśród trucizn środków leczniczych — czyli zadania farmakologji. 4) Wreszcie trucizny były badane jako ogólne czynniki powstawania chorób, a więc przedewszystkiem te, które tworzą się w samym ustroju, i następnie te, które działają zewnątrz.
Treść toksykologji ogólnej zawiera zagadnienia połączone z działaniem trucizn na organizm i jest podstawą niezbędną dla wszystkich działów toksykologji szczegółowej.
Jedną z gałęzi toksykologji szczegółowej jest toksykologja chemiczna środków bojowych — czyli badanie trucizn zdatnych do celów wojennych.
Treść zadań toksykologji ogólnej stanowią:
1. zasadnicze odczyny ustroju na zatrucie,
2. źródła trucizn i drogi przenikania ich wewnątrz ustroju,
3. losy trucizn w ustroju,
4. przystosowanie ustroju do trucizn i zrównoważenie zatruć,
5. chorobowe objawy zatruć,
6. zależność działania trucizn od dawki; dozometrja i dozologja,
7. zasada działania trucizn zależnie od ich właściwości; teorja zatrucia,
8. metody badania trucizn, w szczególności chemicznych środków bojowych.
Zatrucie w treści swej jest zawsze zjawiskiem chorobowem, wywołanem przez działanie jakiegokolwiek czynnika obcego na komórkę żywą. Zatrucie więc jest skutkiem chorobliwej zmiany składu krwi, a dlatego wyłącznie miejscowe działanie niektórych środków, powodujące zniszczenie pewnej ilości żywej tkanki, bez
żadnych zmian poza ich granicami, nie zaliczamy do zatruć we właściwem tego słowa znaczeniu.
Wszelkie choroby są nieuniknionym skutkiem powstania warunków istnienia, do których dany organizm nie jest przystosowany, a objawy chorobowe są właśnie wskazówką dosięgnięcia granicy takiego przystosowania. Zasadnicze warunki istnienia podlegać mogą wahaniom zarówno ilościowym, jak i jakościowym, zmienia się stopień działania poszczególnych czynników (np. temperatura otoczenia) lub też same czynniki przestają istnieć.
Ponieważ zatrucia są chorobami zależnemi od zmian chemicznych, rolę trucizny pełni zawsze jakiś składnik obecny w otoczeniu żywej komórki w ilościach nieodpowiadających normie, lub też całkiem obcy dla danego ustroju.
Stąd wynika możność powstawania zatruć chemicznych w zależności od: 1) zmian o charakterze ilościowym — a) zjawisk głodu, b) zjawisk przeładowania i 2) zmian jakościowych — właściwe zatrucia.
A więc trucizną nazwiemy składnik chemiczny, do którego dany ustrój jest zupełnie nieprzystosowany.
Trucizny te są bardzo liczne i mają najrozmaitsze pochodzenie. Źródłem ich bywa nietylko zewnętrzne otoczenie, ale i przetwory czynności samego ustroju.
Istota zatrucia jest zawsze jednakowa i polega na prawie swoistości odczynów ustroju. Podrażnienie żywej komórki pociąga za sobą wykonanie przez nią odpowiedniej funkcji ściśle określonej; paraliż komórki jest brakiem tej funkcji.
Liczba zasadniczych funkcyj organizmu jest ściśle ograniczona, a liczba możliwych zmian morfologicznych jest też bardzo nieznaczna, w porównaniu z liczbą przyczyn, które te zmiany wywołują. Naogół mamy następujące możliwe skutki działania trucizn:
1) objawy podrażnień, 2) porażenia, 3) uszkodzenia anatomiczne, 4) objawy nienormalnej przemiany materji.
Wyrazem podrażnienia jest podniesienie czynności odpowiednich narządów bez jakichkolwiek zmian morfologicznych. Nasilenie odczynu zależne jest zwykle od siły drażnienia, t. j. od dawki, lub stężenia trucizny. Mamy tu urzeczywistnienie prawa Webera-Fechnera, według którego stopień odczynu wzrasta proporcjonalnie do logarytmu stopnia podrażnienia (ax = blgy).
Niedowład (paresis) czyli zmniejszenie natężenia odczynów, jest początkowym okresem porażenia zupełnego, zaniku danej funkcji. Są to skutki użycia dużych dawek jadu lub objawy przewlekłych zatruć czyli wynik znużenia.
Działania niektórych silnych trucizn pochodzenia roślinnego — alkaloidów i glikozydów nie powoduje zmian anatomicznych nawet w wypadkach śmierci wskutek paraliżu serca albo ośrodków układu nerwowego, podobnie jak w zjawiskach podrażnień. Dlatego te rodzaje trucizn nazywamy truciznami funkcjonalnemi (czynnościowemi).
Trucizny o takiem czynnościowym sposobie działania są albo truciznami dla każdej żywej zarodzi, albo wywołują zmiany czynności tylko komórek specjalnie zróżniczkowanych, przedewszystkiem komórek tkanki nerwowej.
Do pierwszych należą wszystkie trucizny komórkowe, powodujące chwilowy zanik albo obniżenie pewnych czynności poszczególnych komórek, np. ruchów ameboidalnych białych ciałek krwi, ruchów rzęs migawkowych nabłonka, skurczu mięśni, wydzielniczej czynności nabłonka gruczołów i t. d. Po pewnym czasie, gdy trucizna ulegnie rozkładowi, albo zostanie usunięta przez komórkę, czynności życiowe powracają i badanie mikroskopowe nie ustala żadnych zmian w budowie zatrutych komórek.
Jako jeden z najlepszych przykładów powyższego służy działanie chininy i części narkotyków jak eter i chloroform.
Trucizny drugiego rodzaju oddziaływują nie na każdą żywą komórkę, wskutek tego są obojętne dla istot jednokomórkowych. Działanie ich przejawia się tylko w postaci zmian ściśle określonych funkcyj pewnego rodzaju komórek lub narządów, zależy to przedewszystkiem od niejednakowego składu chemicznego poszczególnych komórek w tkankach organizmu, wskutek czego i rozdzielenie trucizny w ciele nie jest równomierne. Zależnie od zdolności rozpuszczenia się w składnikach zarodzi, lub tworzenia się prawdziwych związków chemicznych z temi składnikami, trucizny nagromadzają się w dużych ilościach, lub nawet wyłącznie w odpowiednich narządach, co stanowi treść tak zwanego organotropizmu.
Najwyraźniejszy organotropizm posiada układ nerwowy, w którym zróżniczkowanie jest posunięte do poszczególnych części anatomicznych a nawet ugrupowań komórek. Istnieią naprzykład trucizny czynne w stosunku do kory mózgowej, do ośrodków rdzenia przedłużonego, do układu współczulnego i parasympatycznego, do kończyn obwodowych, i t. d. W innych tkankach mamy także objawy organotropizmu, wśród których należy podkreślić zdolność trucizn do gromadzenia się w narządach wydzielania — nerkach, skórze, płucach. Patologiczne i fizyczne własności tkanek mogą też mieć znaczny wpływ na stopień organotropizmu. Wogóle tkanki czynne lub będące w stanie zapalnym wrażliwsze są od zdrowych i nieczynnych.
Działanie innych trucizn powoduje zjawiska parezy i paraliżu wskutek uszkodzeń lub nawet zniszczenia komórek.
Jako przykład może służyć nerka, której większa część nabłonka wydzielniczego podległa zniszczeniu i stała się martwą masą skrzepłego białka; w tym stanie nerka nie może oczywiście funkcjonować normalnie: ilość i skład wydzielonego moczu będą różnić się od normy co do stężenia, wydzielania nieobecnego w normie białka i wreszcie wzrastająca oligurja, czyli zmniejszenie się ilości moczu, może przejść w anurję czyli bezmocz.
Trucizny, których typowemi cechami działania są podobne zmiany anatomiczne — w małych dawkach albo w słabem stężeniu nie wywołują żadnych zmian. Miejscem ich działania są najczęściej narządy wydzielania, lub droga dostarczenia trucizny. Tylko w pewnych, nielicznych wypadkach zmiany takie zachodzą w tkankach innych narządów albo rozpowszechniają się w całym ustroju. Trucizny takie nazwano truciznami o działaniu anatomicznem.
W treści zmian anatomicznych, powstających wskutek zatruć, mamy z początku zwykle do czynienia z częściowem uszkodzeniem zarodzi, które wszakże może znowu ustępować i nie jest koniecznie połączone z zanikiem chorej komórki. Zmiany takie nazwano zwyrodnieniem (degeneratio). Zwykłą postacią w zatruciach jest zwyrodnienie miąższowe, polegające na częściowem skrzepnięciu białka zarodzi (trübe Schwellung), powstawaniu licznych wodniczek i jednocześnie odszczepianiu się od składników zarodzi komórkowych lipoidów, (tak zw. lipofaneroza) albo zwyrodnienie tłuszczowe. Jest to jednak stan odwracalny; dopóki jądro komórki nie zostało dotknięte, może ona powrócić do normy przez przetrawienie lub pozbycie się zniszczonych części i odrostu (regeneratio) zarodzi.
Zwyrodnienie czynnych komórek łączy się zwykle ze zmianami w tkance łącznej i naczyniach krwionośnych chorego narządu. Powstaje znaczne przekrwienie, obrzęk, nagromadzenie białych komórek krwi, a następnie charakterystyczne zmiany w tkance łącznej: komórki jej rozmnażają się i odzyskują właściwości młodej tkanki zarodkowej. Taka tkanka nazywa się tkanką ziarninową, a szereg tych zmian — zapaleniem.
Z nielicznemi wyjątkami, jak odmrożenie, oparzenie, działanie promieni światła, promieni radium i Röntgena. każde prawie zapalenie jest pochodzenia toksycznego.
Dalszym stopniem rozwoju tych zmian jest uszkodzenie, następnie zupełny zanik jądra komórki. Komórka, która straciła swe jądro, staje się niezdolną do regeneracji i ginie nieodwołalnie. Proces stopniowego zaniku komórki zowie się martwicą, albo nekrozą. Zależnie od sposobu działania trucizn, mamy trojaki obraz martwicy: martwicę nagłą, martwicę skrzepową i martwicę rozpływną. W razie martwicy nagłej, śmierć komórki następuje tak prędko, że braknie czasu do powstania zmian czy to w zarodzi, czy w jądrze. Białko, jak również i inne składniki, stają się w jednej chwili nierozpuszczalnemi, zachowując mniej więcej normalny wygląd. Dlatego też trucizn tego rodzaju, (np. stężony rozczyn dwuchlorku rtęci), czyli utrwalających, używano w celu badań mikroskopowych, pogrążając w nie malutkie kawałeczki badanych narządów. W żywym ustroju powstanie martwicy nagłej wskutek zatrucia nie jest możliwe. Martwica bowiem bywa zwykle dalszym stopniem rozwoju zwyrodnień miąższowych i zależnie od tego, czy mamy do czynienia z przewagą zjawisk skrzepnienia, czy rozcieńczenia białka, powstaje martwica skrzepowa lub martwica rozpływna. Części tkanki obumarłej odrazu dają się zauważyć w preparatach, bo zabarwiają się inaczej niż tkanka normalna, znajdująca się w stanie martwicy nagłej. Komórki zatraciły jądra i budowa ich została zmieniona lub zniszczona, a granice bardzo niewyraźne.
Tkanka martwa, w przewlekłych zatruciach, podlega w następstwie szeregowi zmian typowych, stanowiąc przedewszystkiem nader odpowiednie środowisko dla drobnoustrojów gnilnych; dlatego we wszystkich wypadkach, gdzie tylko drobnoustroje takie mogą dostać się do obumarłej tkanki, mamy powstawanie tak zwanej zgorzeliny wilgotnej, tam gdzie zmartwiała masa nie może wyschnąć, (a więc w narządach wewnętrznych albo w zaniku znacznej masy tkanki, np. całych kończyn), albo zgorzeliny suchej (mumifikacji), gdzie możliwe jest szybkie wyparowanie wody (np. na skórze).
Natomiast w zaniku tkanek niedostępnych dla drobnoustrojów, to jest oddalonych od skóry, jelit i płuc, występuje szereg zmian aseptycznych, mianowicie zjawisko autolizy lub impregnacji.
Mumifikacja nie przedstawia zazwyczaj niebezpieczeństwa dla życia, jako proces wyłącznie miejscowy; naodwrót, zgorzelina wilgotna jest zawsze źródłem bardzo poważnych zasłabnięć charakteru ogólnego, często powoduje postacie chorób zakaźnych typu martwicy szpitalnej i posocznicy.
Zmiany o charakterze aseptycznym zależą od dwóch procesów zasadniczych. Pierwszym z nich jest tak zwana autoliza czyli działanie na obumarłą tkankę proteolitycznych (peptonizujących, a więc rozpuszczających białko) zaczynów, zawartych w jej własnych komórkach i w większym stopniu w białych ciałkach krwi, gromadzących się zawsze tam, gdzie jest martwe białko. Drugim procesem jest impregnacja, polegająca na tem, że sole wapnia, stałe składniki krwi, odkładają się w przetworach rozkładu i tworzą nierozpuszczalny osad. Osad ten przeważnie jest fosforanem, w mniejszym stopniu węglanem wapnia. Obok tego w ogniskach martwicy znajduje się zawsze pewna ilość nierozpuszczalnych mydeł wapniowych. U ptaków i gadów i u człowieka w warunkach pewnej anomalii przemiany materji, t. zw artretyzmu w ogniskach aseptycznej martwicy gromadzi się wolny kwas moczowy i jego kwaśne sole sodowe.
Od zmian tu wyliczonych, powstających w ustroju żywym, musimy odróżnić zmiany pośmiertne czyli ogólny proces gnicia spowodowany przez działanie drobnoustrojów. Te procesy biorą początek zawsze z jelit, najbardziej obfitujących w drobnoustroje
i szerzą się następnie na inne narządy jamy brzusznej i wkońcu na całe ciało. Zasadniczą cechą tych zmian jest pewien rodzaj autolizy tkanek i charakterystyczne zabarwienie na kolor zielonkawo-bronzowy, nawet czarny. Zależy to od działania siarkowodoru, produktu gnilnego rozkładu białka, na hemoglobinę krwi. Przy tem powstaje ciemno bronzowa sulfhemoglobina, a nawet czarny siarczek żelaza. Badanie toksykologiczne takich zgniłych organów może być dokonane tylko przy pomocy analizy chemicznej, o ile chodzi o stałe trucizny nieorganiczne. Mikroskopowe badanie nie ma tu żadnego zastosowania.
Równocześnie ze zmianami w komórkach czynnych, w tkance łącznej i naczyniach krwionośnych rozwijają się też objawy zapalenia, jako najzwyklejszy, a najważniejszy skutek dość mocnego i trwałego podrażnienia tkanki. Proces ten u kręgowców, mianowicie u ssaków, a więc i człowieka, wyraża się w objawach zwanych klasycznemi, ustalił je bowiem starożytny rzymski lekarz Cels. Są to: zaczerwienienia chorej tkanki (rubor), podniesienie jej temperatury (o ile mamy do czynienia z tkanką znajdującą się na powierzchni ciała) — calor, opuchlina — tumor, ból — dolor i obniżenie czynności chorego organu — functio laesa.
Wszystkie te zjawiska łatwe są do wytłumaczenia z punktu widzenia uszkodzenia naczyń, oraz połączonego z tem utrudnienia obiegu krwi.
W ognisku zapalnem naczynia stają się łatwiej przepuszczalnemi wskutek uszkodzenia śródbłonka, następnie zostają porażone mięśnie ścianek, naczynia rozszerzają się i wypełniają krwią, stąd powstaje przekrwienie zarówno tkanki objętej zapaleniem, jak jej otoczenia. Ponieważ obieg krwi w rozszerzonych naczyniach jest powolniejszy niż zwykle, stopień redukcji hemoglobiny wzmaga się i dlatego zabarwienie zapalonej tkanki staje się zwykle mniej lub więcej sinawe. Pomimo zwolnionego obiegu, ilość krwi przeciekającej przez naczynia zapalnego narządu przewyższa normę, a ponieważ krew serca i tętnic jest cieplejsza od krwi naczyń skóry, miejsce podlegające zapaleniu, o ile leży na powierzchni ciała, okaże się cieplejszem od otoczenia. Dzięki wzrostowi przepuszczalności, istniejące w normalnych warunkach przesiąkanie — (transudacja) zwiększa się znacznie, z czego powstaje źródło obfitego prądu limfy oraz prędko powstającej opuchliny.
Ścianki naczyń stają się bardziej przepuszczalnemi nietylko dla wody, lecz także dla białka krwi, którego zawartość w nagromadzonym w tkankach płynie jest zawsze wyższa od tejże zawartości w normalnej limfie. Płyn ten zawiera domieszkę znacznej ilości krwinek, z początku tylko białych, posiadających zdolność do ruchów czynnych, co ułatwia przenikanie ich przez ścianki naczyń do otaczających tkanek. Stan taki jest nieomylną oznaką ostrego stadjum zapalenia i nazywa się infiltracją leukocytarną[1].
W dalszym okresie uszkodzenia ścianek i naczyń przepuszczają one nawet krwinki czerwone, niezdolne do ruchów czynnych, skąd w tkance podległej zapaleniu powstają wybroczyny (haemorrhagia per diapedesin). Zasadniczą cechą jest tu brak widocznego naruszenia całości ścianek naczyniowych. W związku ze zmianami składu, płyn występujący z naczyń przy zapaleniu z transsudatu — przesięku, staje się ekssudatem — wysiękiem zapalnym.
Stosownie do stopnia uszkodzenia ścianki naczyniowej, względnie składu płynu nasiękowego, rozróżniamy następujące rodzaje wysięku.
1. Wysięk surowiczny — podobny do limfy, zawierający wszakże nieco większą ilość białka.
2. Wysięk włóknikowy, różniący się od poprzedniego obecnością włóknika powstałego w postaci błon, włókien lub sieci przenikającej w głąb tkanki uszkodzonej lub nawet zmartwiałej (zwykle śluzówki).
Ten ostatni rodzaj nosi specjalną nazwę wysięku błonicznego.
3. Wysięk ropny charakteryzuje obecność dużej ilości obumarłych krwinek białych, noszących w tym wypadku nazwę ciałek ropnych. Ropienie najczęściej powstaje wskutek zakażenia specjalnemi drobnoustrojami (najczęściej grają tu rolę paciorkowce i gronkowce), obok tego istnieją liczne trucizny zdolne wywołać t. zw. aseptyczne ropienie bez udziału drobnoustrojów (w wypadkach wyraźnego chemotropizmu).
4. Wysięk krwawy — mniej lub więcej zabarwiony na czerwono, stanowi oznakę najwyższego stopnia zapalenia.
Te cztery rodzaje wysięków mogą zresztą łączyć się ze sobą, tworząc mieszane wysięki.
Równolegle z powstaniem wysięku rozwija się szereg zmian w samych tkankach, przedewszystkiem w tkance łącznej. Pierwszemi oznakami działania czynników wywołujących zapalenie są zmiany w miąższu, o których mówiliśmy wyżej, do tych zaś przyłącza się niezwłocznie odczyn tkanki łącznej. Komórki tej tkanki nabrzmiewają i poczynają się mnożyć, pozostając w stanie niezróżniczkowanym i nie wytwarzając włókienek kollagenowych. W ten sposób powstaje tak zw. tkanka ziarninowa, do której przenikają liczne limfocyty (czyli małe komórki z okrągłem jądrem i niewielką ilością zarodzi) — nacieczenia czyli infiltracja limfocytarna.
Przytoczone zmiany anatomiczne w tej lub innej postaci dają się ustalić prawie we wszystkich narządach w odpowiednich stanach zatruć. Zależnie od zmian anatomicznych daje się stwierdzić pewne obniżenie czynności normalnych chorego narządu z jednoczesną wzmożoną wrażliwością na podrażnienia.
Rozpatrując znaczenie zmian anatomicznych musimy zwrócić uwagę na ich umiejscowienie, jest to bowiem cecha pierwszorzędnej wagi, zarówno dla diagnozy zatruć podczas sekcji zwłok, jak wytłumaczenia samych objawów otrucia. Rozróżniono zatem:
1. zmiany powstające w miejscu działania trucizny. Do tych należą: uszkodzenia skóry w oparzeniach, uszkodzenia żołądka i jelit po przełknięciu substancyj żrących, zmiany w drogach oddechowych i płucach przy zatruciu parami i gazami.
2. Powstawanie zmian w tkankach albo narządach oddalonych od miejsca przenikania trucizny, stosownie do praw organotropizmu.
3. Powikłania powstające wskutek wywołanego zatruciem naruszenia czynności narządów lub niezależnie odeń, wskutek zmian składu krwi.
Z pośród tych powikłań najciekawsze jest działanie trucizn na barwnik krwi, hemoglobinę — niezbędny czynnik oddechowy.
Działanie trucizn na krew może spowodować zmiany hemoglobiny mniej więcej te same w żywym ustroju co w probówce, mianowicie:
1. przetworzenie się hemoglobiny pod wpływem silnych
kwasów i zasad w hematynę, nieczynną jako barwnik oddechowy.
W obecności tlenu hemoglobina rozkłada się na: globinę — rodzaj białka, i hematynę, zawierający żelazo rodnik barwny. Hematyna jest produktem utlenienia haemochromogenu, haemochromogen zaś powstaje bezpośrednio przy rozkładzie haemoglobiny w nieobecności tlenu. Przez usunięcie żelaza powstaje z niej barwa czerwona haematoporfiryna, izomeryczna z barwnikiem żółci bilirubiną, zawarta w moczu przy niektórych zatruciach, jak np. sulfonalem, albo w chronicznem zatruciu ołowiem. Hematyna tworzy się we włoskowatych naczyniach płuc w zatruciu dużemi dawkami środków bojowych, rozkładających się z powstaniem wolnych kwasów, przedewszystkiem kwasu solnego, naprzykład podczas raptownej śmierci wywołanej przez otrucie chlorem, fosgenem albo palitami.
2. Powstanie methemoglobiny, bardzo trwałego, mało zdolnego do dyssocjacji związku hemoglobiny z tlenem. Methemoglobina może powstać i wewnątrz czerwonych krwinek i powstaje zawsze w razie hemolizy, czyli rozpuszczania ciałek czerwonych jakiegokolwiek pochodzenia. Powstanie methemoglobiny daje zabarwienie tkanek na kolor ciemno czekoladowy. Zmieniona w ten sposób krew jest niezdolną do podtrzymania oddechu i, jeżeli większa ilość hemoglobiny istotnie podległa tej zmianie, bywa przyczyną rychłej śmierci. Częściowe przetworzenie barwnika krwi, nawet wywołując zmianę zabarwienia moczu i wynikającą z tego żółtaczkę, może skończyć się wyzdrowieniem.
Liczba trucizn, powodujących powstanie methemoglobiny jest bardzo znaczna. Do tych należą środki utleniające jak: chloran potasu, prawie wszystkie związki zawierające rodniki NO i NO2, jak azotyn amylowy, dwunitrobenzol, chloropikryna, rozmaite aminy, jak anilina, toluilendiamina, trójfenolochinony, i t. d. Najważniejszemi, ze względu na łatwość zdobycia ich, są chloran potasu i antifebrina, czyli acetanilid, z których pierwszy jest trucizną często używaną przez samobójców.
Zwróćmy uwagę na to, że własności trujące mają tylko te środki, które tworzą methemoglobinę wewnątrz krwinek lub jednocześnie zdolne są spowodować hemolizę. Środki czynne tylko w obecności już powstałych rozczynów hemoglobiny, jak np. żelazicjanek sodowy, zachowują się przy wprowadzeniu ich do żył obojętnie.
3. Powstanie trwałych związków z hemoglobiną, bardziej stałych od oksyhemoglobiny. Pierwowzorem związków tego rodzaju jest połączenie hemoglobiny z tlenkiem węgla; znajdujący się w powietrzu w ilości 2% gaz ten łączy się z hemoglobiną w takim stopniu, że więcej niż 90% ogólnej ilości hemoglobiny krwi zostaje złączona z tym gazem. Połączenia podobne z siarkowodorem powstają w małych ilościach, w tych stężeniach H2S, kiedy śmierć następuje już wskutek działania tej trucizny na aparat nerwowy. Podobne do tego związki z NO i HCN, powstają tylko w probówce, wskutek tego nie posiadają toksykologicznego znaczenia.
4. Niemniej poważne są skutki zatrucia przez działanie trucizn hemolitycznych, których znaczna część jest zarazem ogólną trucizną protoplazmy.
Czerwone ciałka krwi są bardzo wrażliwe na pewne zmiany fizyko-chemicznych warunków istnienia, jak np. napięcia osmotycznego. To też istnieje serja związków chemicznych zdolnych do rozpuszczania i niszczenia tych komórek. Przedewszystkiem działają w tym kierunku wszystkie odczynniki rozpuszczające lipoidy, z których składa się zewnętrzna warstwa ochronna czerwonego ciałka. Do takich odczynników należą, obok eteru, chloroformu, i t. p., których działanie polega na jednoczesnej zdolności rozpuszczania się w wodzie, takie związki jak kwasy żółciowe, mydło i tak zwane solwiny (rozpuszczalne w wodzie połączenia wyższych oksy-kwasów tłuszczowych z kwasem siarczanym), i wreszcie niektóre związki nieorganiczne o własnościach hemolitycznych, z których najbardziej czynny jest arseniak.
W związku z powstaniem methemoglobiny, następuje rozpuszczenie krwinek za pośrednictwem dużej ilości trucizn o jakich tu mówiliśmy. Najpotężniejszemi są jednak trucizny pochodzenia roślinnego, tak zwane saponiny, zależnie od zdolności, jakie posiadają do rozpuszczania tłuszczu podobnie do mydła. (Saponiny zawarte są w najzwyczajniejszych roślinach jak koński kasztan, dziewanna, kąkol, mydlnica i. t. d.). Do trucizn tych dochodzą też pewne glykozydy, np. zawarta w przerośniętych ziemniakach solanina.
Inne substancje hemolityczne działają na część krwinki złożoną z białka, są to hemolizyny pochodzenia zwierzęcego (np. zawarte w truciźnie niektórych pająków i jadowitych wężów), a także liczne hemoliziny pochodzenia bakteryjnego.
Skutkiem powstania hemolizy w naczyniach in vivo występuje zabarwienie plazmy krwi na czerwono, powiększenie śledziony, wydzielanie moczu barwy ciemniejszej niż zwykle; a zależnie od stopnia hemolizy mocz może zawierać methemoglobinę albo nawet hemoglobinę w niezmienionym stanie. W wątrobie tworzą się z hemoglobiny wolnej, zawartej we krwi, barwniki żółciowe w takiej ilości, że żółć staje się gęstą i przez uszkodzone komórki narządu ulega resorbcji. Stąd powstaje żółtaczka, a żelazo pozostałe przy wyrabianiu tych barwników nagromadza się w wątrobie i innych narządach w postaci bronzowo-żółtej hemosideriny. Zniszczenie dużej ilości krwinek powoduje zwiększenie działalności narządów krwiotwórczych, przedewszystkiem szpiku kostnego i sprowadza objawy niedokrwistości. Hemoliza w wyższym stopniu rozwoju może wywołać śmiertelne zapalenie nerek, wskutek podrażnienia przez wydzielającą się hemoglobinę, lub w razie zniszczenia znaczniejszej ilości krwinek natychmiastową śmierć przez uduszenie, gdyż rozpuszczona w krwi hemoglobina nie jest w stanie utrzymywać przemiany tlenu w tkankach i płucach.
Szereg zasadniczych objawów zatrucia, spostrzeganych za życia i na sekcjach anatomicznych, jest w istocie skutkiem zaburzeń w układzie aparatu krążenia krwi. Z nich najważniejsze są: 1) zakrzepy i zatory (trombosis i embolia), stanowiące przeszkodę w krążeniu krwi, 2) porażenie serca, 3) porażenie naczyń i powstanie rozproszonych wybroczyn, 4) zjawiska obrzęku, przedewszystkiem płuc i 5) zmiany stężenia krwi.
Krążenie krwi jest dość złożonym wynikiem współdziałania: po pierwsze mięśni serca, które posiada, oprócz bardzo złożonego autonomicznego aparatu regulacyjnego, powikłane połączenia z ośrodkowym układem nerwowym, i po drugie naczyń krwionośnych, które nie są biernemi rurkami, lecz posiadają zdolność zmieniania czynnie swej średnicy, co staje się przyczyną niejednakowej zawartości krwi w narządach. Zmiany te, mając charakter zależny od czynności, dają się zauważyć tylko w ustroju żywym, a niektóre ich skutki stają się źródłem głębokich zmian anatomicznych, stwierdzonych na sekcji.
Dlatego potrzebnem jest zaznajomienie się z temi zjawiskami, z punktu widzenia tak patologji ogólnej jak i toksykologji.
Skrzepy krwi są nieuniknionym skutkiem działania miejscowego wielu czynników strącających białko w odpowiedniem stężeniu. Są to kwasy, zwłaszcza mineralne, sole ciężkich metalów i znaczna ilość różnych związków organicznych.
Ogólne krzepnięcie krwi w naczyniach całego ustroju, skutkiem którego bywa nagła śmierć, może być wywołane powstaniem we krwi większych ilości trombiny, zaczynu skrzeplinowego. Zjawisko to nie odgrywa w zatruciach poważniejszej roli.
Krzepliwość krwi jest dość zmienna. Znamy więc szereg zatruć z objawami zmniejszenia się krzepliwości krwi, w innych zaś przeciwnie, zwiększenia się. Krew staje się niezdolną do krzepnięcia po dodaniu do krwi wypuszczonej z żył, lub zastrzyku dożylnym, wszystkich środków tworzących nierozpuszczalny osad z solami wapnia (soli kwasów cytrynowego i szczawiowego, fluorek sodu), pewnych produktów trawienia białka (peptonów i albumoz), wydzieliny gruczołów ślinowych zwierząt żywiących się krwią kręgowców — jak naprzykład pijawki.
Zwiększoną zdolność krzepnięcia mamy w zatruciu kwasami mineralnemi, solami wapnia, niektóremi proteinami, jak żelatyna, i kwasami nukleinowemi. Najsilniejszem jest działanie pewnych białek jadowitych, zwanych toksalbuminami, np. zawartych w nasionach rącznika — rycyny (ricinus communis).
Skutkiem powstania zakrzepu (trombozy) wewnątrz naczynia, obieg krwi w tem miejscu zostaje powstrzymany. Zależnie od wielkości i znaczenia naczynia i od możliwości wykorzystania dla krwioobiegu obocznych dróg (t. zw. kollaterali), skutki skrzepnięcia mogą być bardzo różne. Tak naprzykład zakrzep małej tętniczki sercowej powoduje natychmiastową śmierć, a obecność nawet licznych skrzepów w sieci żył podskórnych może pozostać niezauważoną. Tem niemniej każdy skrzep jest zjawiskiem niebezpiecznem wobec możności powstania zatorów (embolia) przez unoszenie z biegiem krwi kawałeczków skrzepu do innych naczyń, w których zatrzymując się tworzą one w pewnych warunkach bardzo niebezpieczne przeszkody dla krwioobiegu. Naprzykład zatory głównej tętnicy płucnej, tętnic rdzenia przedłużonego i serca mogą stać się przyczyną nagłej śmierci.
Specjalną postać zatoru stanowi zator gazowy, który może powstać przez dostarczenie do tkanek lub naczyń pewnych związków dających przy rozkładzie gazy. Najważniejszemi są tu nadtlenki, np. nadtlenek wodoru i ciekawe z tego punktu widzenia sole diazobenzolu, które przy działaniu wody dają azot.
Paraliż serca jest skutkiem zatruć przez wiele trucizn. Śmierć wskutek zatrucia następuje wogóle albo wskutek paraliżu ośrodka oddechowego, gdy przy wstrzymaniu ruchów oddechowych serce działa jeszcze w ciągu pewnego czasu, albo też wskutek paraliżu samego serca, gdy naodwrót, przy sercu już nieczynnem, dają się obserwować przez pewien czas trwające ruchy oddechowe.
Zależnie od tego czy paraliż serca jest jedynym objawem zatrucia albo też skutkiem całego szeregu poważnych zmian anatomicznych, rozróżniamy specjalne trucizny sercowe o działaniu czynnościowem i inne o działaniu przeważnie anatomicznem, nareszcie powodujące następczy paraliż serca.
Do ostatniej grupy należą trucizny bojowe jak: fosgen, chloropikryna, organiczne związki arsenowe — do pierwszej, najsilniejsze ze znanych trucizn: akonityna, muskaryna, atropina i t. p.
Zależnie od wielkości dawki i innych warunków, paraliż serca nastąpić może bardzo szybko, niemal odrazu, albo też rozwijać się powoli podczas długotrwałej agonji.
W pierwszym wypadku mamy znów, zależnie od własności użytej trucizny oznaki skurczu mięśni serca (systoly), gdy w komorach niema ani kropli krwi, albo odwrotnie, przepełnienie serca krwią, przy miękkich, zwyrodniałych mięśniach, przyczem zwykle pojawiają się oznaki długotrwałego zatrzymania krwi w żyłach, a serce znajduje się w stanie rozkurczu (diastoly). W powolnym rozwoju porażenia serca nie brak też objawów przekrwienia biernego: zwiększenie oraz ciemniejsze zabarwienie wątroby i śledziony, a najczęściej nerek, przesiąk w jamach surowiczych i mniej lub więcej wyraźny przedzgonny obrzęk płuc.
Przyczyną paraliżu serca mogą być zarówno wyjątkowe uszkodzenia jego mięśni, albo nerwów, jak i przeciążenie pracą, przewyższającą tak zwaną siłę zapasową serca. Warunki przeciążenia powstają wskutek zwężenia łożyska naczyniowego w czasie skurczu tętnic albo zatknięcia większej części naczyń włoskowatych w narządach objętych zapaleniem, przeważnie w płucach. Porażenie serca, narządu bardzo czułego na dostarczanie krwi przez tętnice sercowe, staje się nieuniknione, gdy ilość krwi wypełniająca układ naczyniowy nie będzie wystarczająca do prawidłowego krwioobiegu. Stan ten następuje wskutek utraty bardzo dużej ilości krwi lub porażenia naczyń. To ostatnie zjawisko jest właśnie pospolitym wynikiem niektórych zatruć.
Toksyczny skurcz naczyń nigdy nie bywa dość trwały, aby mógł stać się przyczyną paraliżu serca, będąc jednakże niemniej ważnym czynnikiem objawów groźnych podniesień ciśnienia krwi i utraty przytomności. Mechanizm śmierci w zatruciu temi truciznami bywa bardzo złożony.
Na pierwszem miejscu pośród środków wywołujących toksyczny skurcz naczyń umieścić należy adrenalinę (substancję czynną nadnercza), kokainę i sole baru. Te ostatnie działają bezpośrednio na mięśnie naczyń. Skutkiem zmian w czynności serca i naczyń, a także uszkodzenia śródbłonka naczyniowego, powstają w ustroju dalsze zmiany, połączone zawsze ze zwiększoną przepuszczalnością naczyń. Wraz z osłabieniem serca i przepełnieniem żył powstają wyżej omówiane obrzęki, obok swoistych dla wielu zatruć krwotoków, najwyraźniejszych zwykle w błonkach surowiczych i w białej tkance mózgowej.
Zwiększona dla płynnych składników krwi przepuszczalność naczyń krwionośnych zwiększa ilość limfy, a w odpowiednich okolicznościach powoduje powstawanie miejscowych toksycznych obrzęków i pokrzywki. Są to zjawiska obserwowane po dożylnem dostarczaniu, a u wrażliwszych jednostek nawet przy dostarczaniu przez kanał trawienny, szeregu, jakby się zdawało obojętnych, substancyj, jak np. ekstraktu mięśni raków, ślimaków i niektórych narządów (nerek, wątroby tegoż samego zwierzęcia) także alkoholu, eteru, wyciągów z roślin powszechnie używanych jako pożywienia — poziomek, słonecznika i t. p.
Do takich substancyj należą prawdopodobnie także i niektóre trucizny bojowe, a przedewszystkiem grupa fosgenu. Tu przepuszczalność naczyń musi być jeszcze większa, o ile można wnioskować ze składu płynu w obrzęku płucnym.
Raptowne wydzielenie znacznej ilości płynu ze krwi sprowadza szereg poważnych a niebezpiecznych dla życia zmian: są to objawy zagęszczenia krwi. Zależnie od tego, czy wysięk zawiera ilość białka mniejszą niż plazma, lub takiejże samej zawartości, mamy dwa rodzaje zgęstnienia krwi. W pierwszym wypadku powstaje tak zwana anhydremja, czyli nadmierne stężenie plazmy krwi, (jak to bywa w biegunkach toksycznych wskutek zatrucia arsenem, i zwykłych postaciach obrzęku płuc u zatrutych chlorem albo chloropikryną) — w drugim następuje powiększenie stosunkowej ilości krwinek w plazmie krwi. Stosunek ten może być zwiększony dwukrotnie, a nawet i więcej. Stan podobny zowie się toksyczną polyglobulją. Dotychczas był obserwowany tylko w zatruciach truciznami grupy fosgenu. Polyglobulja częściowa, to jest dotycząca tylko części krwioobiegu, jest zjawiskiem bardzo pospolitem w zatruciach jakiemikolwiek truciznami, wywołującemi osłabienie czynności serca. Każde osłabienie szybkości prądu krwi sprawia, że ciałka zatrzymują się w naczyniach włoskowatych obwodu, wówczas gdy plazma odpływa powoli. W ten sposób, w związku z powstającym zwykle w tych warunkach obrzękiem, tworzy się kompletne zatkanie naczyń przez nieruchome masy ciałek czerwonych przylegających do siebie ściśle w postaci jednolitej masy. Jest to tak zw. zastój krwi. Zjawisko to jest odwracalnem w ciągu dość długiego czasu. Polepszenie warunków działalności serca, dostarczenie nowych ilości płynu przez wlewanie rozczynu soli do żył może zaradzić skutkom nawet bardzo rozwiniętych postaci zastoju i spowodować zniknięcie ich. Zazwyczaj jednak stan tego rodzaju połączony bywa ze skrzepnięciem krwi w żyłach, a następnie z martwicą tkanki. Skutkiem ogólnego zgęstnienia krwi bywa: po pierwsze zmniejszenie ilości płynu napełniającego naczynia, po drugie wzrost oporu przeciwstawianego krążeniu krwi, gdyż gęsty jak smoła płyn potrzebuje mocniejszego ciśnienia, aby przedostać się przez naczyńka włoskowate. Ciśnienia takiego serce zwykle nie jest w stanie wykonać i okazuje się niezdolnem do pracy.
Co do krwotoków toksycznych, to obok częstych uszkodzeń naczyń przez środki żrące, jak kwasy i ługi w przełyku i żołądku, mamy do czynienia z powstawaniem wysięków krwawych, stanowiących oznakę najsilniejszego stopnia zapalenia, albo z mniej lub więcej powoli następującemi zmianami w śródbłonku naczyń.
Ta ostatnia forma krwotoków zjawia się albo za życia, dość długo przed śmiercią, jak w zatruciu fosforem i innemi podobnemi w działaniu truciznami, albo też wskutek miejscowych zmian zastoinowych w ostatnich chwilach konania. Takie przedzgonne krwotoki, przy których niema czasu dla zmiany własności krwi, noszą specjalną nazwę plamek Tardieu. Obok zatruć jadami pochodzenia zewnętrznego są one zwykłym objawem zaduszenia, czyli zatrucia kwasem węglowym.
Zasadniczą właściwością trucizn jest oddziaływanie ich na czynności poszczególnych narządów lub tkanek. Istnieją wszakże trucizny, działanie których rozprzestrzenia się na cały ustrój przez uszkodzenie zasadniczych czynności żywej zarodzi i jej zdolności do przemiany materji. Trucizny takie nazwano truciznami przemiany materji. Działanie ich w skutkach swoich jest następujące: 1) jakościowe i ilościowe zmiany rozkładu produktów odżywczych i wskutek tego zmiany ilości jednostek wytwarzanej w ustroju energji (ilości kaloryj); 2) zmiany chemicznego składu krwi i wydzielin, przedewszystkiem moczu; 3) zmiany anatomiczne, jako skutek tych ogólnych zmian. Zmiany te, stosując się do pewnych tylko tkanek, nie mają zwykle ściśle określonego umiejscowienia. Najczęściej mamy tu do czynienia z tłuszczową metamorfozą narządów, przedewszystkiem wątroby, lub z uszkodzeniami szkieletu.
Treść działania jest tu dość rozmaita, zależnie od grupy do jakiej należy dana trucizna. Z grup tych najważniejsze są: 1) środki wywołujące zatrucie kwasami, t. zw. acidozę; 2) środki obniżające przemianę materji; 3) środki podnoszące tę przemianę; 4) środki powodujące toksyczny rozkład białka; 5) środki oddziaływujące na przemianę węglowodanów; 6) środki działające na przemianę purinową.
Ponieważ przemiana materii jest jedynem żródłem powstawania ciepła w ciele, temperatura ciała jest też w pewnym stopniu zależną od działania tych trucizn. Przy normalnej jednak czynności układu nerwowego regulacja temperatury jest tak ścisła, że znaczniejsze nawet podniesienie lub obniżenie ilości wyprodukowanego ciepła nie jest w stanie zmienić temperatury ciała. Dlatego chwiejność temperatury jest zwykle wskazaniem uszkodzenia układu nerwowego.
Co do przykładów trucizn przemiany materii to acidoza jest skutkiem zatrucia wszystkiemi środkami, które same są kwasami, lub dają podczas rozkładu kwaśne związki. Do ostatnich należy znaczna część środków bojowych, jak naprzykład: fosgen, pality, sulvinity i t. p. Treść acidozy polega na obniżeniu zawartości jonów OH i wskutek tego mniejszej zawartości CO2 we krwi w stanie węglanów i obecności ciał tak zwanych acetonowych (kwas oksymasłowy, acetooctowy i aceton). W moczu wzrasta w dużym stopniu zawartość amoniaku, kosztem mocznika.
Obniżenia stopnia przemiany materji wywołuje chinina, jej podniesienia zaś — jodotyrina, związek wytwarzany przez gruczoł tarczowy, wskutek tego wszystkie trucizny działające na ten gruczoł, np. jodki, dają takież same wyniki. Możliwem jest też, że podobne działanie posiada iperyt.
Toksyczny rozkład białka, który cechują niedostateczny stopień utlenienia oraz wydzielanie z moczem obfitej ilości pośrednich produktów przemiany materji, jest skutkiem zatrucia fosforem, arsenem, antymonem, selenem i niektóremi środkami organicznemi (np. niektóre olejki eterowe).
Nieprawidłowa przemiana węglowodanów, której skutkiem bywa cukromocz, jest dość pospolitem zjawiskiem, towarzyszącem wielu zatruciom. Cukromocz jest zależny albo od obecności we krwi nadmiaru cukru gronowego (powyżej od 0.1%) albo od specjalnych zmian własności nerek (obniżenia stopnia ich przepuszczalności). Pierwszego rodzaju zmiany zależą od dostarczania drogą pokarmową w dużej ilości łatwo rozpuszczalnych węglowodanów, albo też od niezdolności organizmu do zużytkowania tych węglowodanów, lub przetwarzania ich w glikogen. Niezdolność tego rodzaju pochodzi z nieprawidłowej czynności nadnercza, a przedewszystkiem trzustki, jak również z nieprawidłowego krwioobiegu wątroby, wskutek uszkodzeń odpowiednich części układu nerwowego. Toksyczny cukromocz jest więc skutkiem zatrucia jadami działającemi albo na proces utleniania, w znaczeniu obniżania go, (np. czad, trucizny w rodzaju kurary) albo na nerki, jak florydzyna, glikozyd zawarty w korzeniu jabłoni i gruszy. Ciekawe jest, że zupełny brak cukru we krwi wskutek obecności nadmiaru produktu wewnętrznej sekrecji trzustki, t. zw. insuliny, wywołuje również zjawiska ostrego zatrucia, napady drgawek, wreszcie — śmierć.
Przemiana purinowa jest miarą stopnia rozkładu jąder komórkowych w ustroju. U człowieka, skutkiem wahań przemiany purinowej jest zmienna zawartość kwasu moczowego w moczu, jak również stan chorobowy, tak zwany artretyzm. Z punktu widzenia specjalnie toksykologicznego, stan ten nie przedstawia nic osobliwie ciekawego, zwrócimy tu więc tylko uwagę na fakt, że w przewlekłem zatruciu ołowiem zauważono pewien stopień artretyzmu toksycznego.
Źródła trucizn są bardzo liczne stosownie do sposobu powstawania zatruć. Zasadą podziału ich jest przeciwstawienie zatruć pochodzenia zewnętrznego, gdy trucizna znajduje się w gotowym stanie w środowisku otaczającem, zatruciom pochodzenia wewnętrznego, gdy źródłem trucizn są procesy tworzące się w samym ustroju. Do ostatnich należą:
1) procesy fermentacji w kanale trawiennym, mianowicie rozkład pewnych materiałów spożywczych pod wpływem działalności odpowiednich drobnoustrojów. Ponieważ zawartość kanału trawiennego nie jest częścią żywego organizmu, zatrucia takie w istocie należą raczej do zatruć pochodzenia zewnętrznego.
2) Zatrucia tworzące podstawę chorób zakaźnych, w których źródłem trucizn jest działalność obcych komórek pasorzytujących we krwi albo tkankach.
3) Tak zwane samozatrucia — skutki ilościowych albo nawet jakościowych uchybień w przemianie materji i czynności narządów wydzielania zewnętrznego i przedewszystkiem wewnętrznego. Zatrucia pochodzenia wewnętrznego odgrywają poważną rolę w patologji, stanowiąc podstawę dużej ilości chorób, dla toksykologji nie posiadają jednak większego znaczenia, tem więcej dla toksykologji środków bojowych; nie będziemy tu też o nich mówili.
Co do zatruć zewnętrznych, to źródłem trucizn, z któremi mamy do czynienia, jest prawie wszystko, z czego składa się nasze otoczenie: ziemia pod naszemi nogami, woda, którą pijemy, powietrze, pokarm, odzież — wszystko to może być świadomie albo nieświadomie zatrute.
Jadowite pierwiastki są składnikami wielu minerałów i stąd mogą się dostawać do roślin, wytwarzając jadowity pył, albo jadowite związki, zatruwające powietrze. Jest bardzo wiele roślin zdolnych do wytwarzania najokropniejszych trucizn, które od najdawniejszych czasów są używane jako środki medyczne, środki dla niszczenia szkodników, do polowania i rybołóstwa, wreszcie jako sposoby zwalczania silniejszego wroga. Przedewszystkiem zwrócę tu uwagę na liczne trucizny do dzisiejszego dnia używane przez różne narodowości krain podzwrotnikowych Azji (sok anczaru — Upas toxicaria), Afryki (przeważnie Strophantus Kombe) i Ameryki (słynne kurare, którego czynnym składnikiem jest ekstrakt rozmaitych roślin gatunku Strychnos).
Wśród świata zwierzęcego znajdujemy też obfite źródła trucizn. Wszystkie zwierzęta jadowite dadzą się wogóle podzielić na jadowite czynnie i biernie. Pierwsze posiadają zdolność nietylko wyrabiania trujących wydzielin w specjalnych gruczołach, ale też i odpowiednią broń do wstrzykiwania ich w ciało wroga, czy zdobyczy — jak naprzykład zęby wężów, żądła os i pszczół.
U istot biernie jadowitych trucizna zawarta jest w odpowiednich tkankach, najczęściej w gruczołach płciowych, albo i w całem ciele. Za przykład jadowitości tego rodzaju może posłużyć znany owad majka, albo pryszczawka, zawierająca okropną truciznę — kantaridinę.
Najpotężniejszem wszakże źródłem trucizn jest obecna działalność techniczna człowieka. Przerabiając materjały dostarczone przez przyrodę, człowiek nietylko zdołał stworzyć niezliczony szereg trucizn, dotychczas nieznanych, ale prócz tego posiadł możność wyrabiania ich w olbrzymich ilościach, o jakich przodkowie nasi nie mieli pojęcia. Do tego trzeba dodać, że w niektórych razach trucizny takie nie stanowią nawet celu zabiegów technicznych. Zatrucie wody rzek, zanieczyszczenie powietrza jadowitemi gazami, dymem i kurzem fabryk i zakładów, są ujemnemi stronami przemysłu na wielką skalę.
Otrzymywanie trucizn w sposób sztuczny przy pomocy syntezy chemicznej, jest prawie jedynem źródłem teraźniejszych gazów bojowych. Ani roślinne, ani tem więcej zwierzęce trucizny nie dałyby się otrzymać w ilościach odpowiadających dzisiejszym zadaniom taktycznym (chociaż w starożytności używane były z dodatniemi wynikami), a ich niestałość oraz zbyt wielkie koszta wyrobu jeszcze bardziej stanęłyby na przeszkodzie. To też użycie trucizn jako pospolitego środka walki stało się możliwe dopiero w ostatnich czasach, dzięki rozwojowi przemysłu chemicznego, gdy materjałem służącym do otrzymywania tych trucizn są rozmaite związki pochodzenia mineralnego, znajdywane w naturze w dużych ilościach, albo produkty ich przerobu, albo wreszcie takie materjały roślinne jak alkohol, gliceryna, produkty suchej destylacji drzewa, które można dostarczyć w nieograniczonej ilości. Nic więc dziwnego, że, dzięki swemu rozwiniętemu przemysłowi chemicznemu, Niemcy pierwsi potrafili zastosować te środki. Następnie za ich przykładem poszły inne państwa. Duże ilości trucizn bojowych są nietylko odpadkami pewnych przemysłów chemicznych, ale wyrabiane są w specjalnych zakładach prawie wszędzie narówni z prochem i innemi środkami wybuchowemi.
Z punktu widzenia praktycznego, to jest zadań lekarskich, zatrucia pochodzenia zewnętrznego podzielić możemy na cztery grupy.
1) Zatrucie przypadkowe. Do tej grupy należą wszystkie pojedyńcze wypadki zatruć przy samobójstwach, mordach, omyłkach lekarskich, nieszczęśliwych wypadkach, jak np.: użycie do potraw biernie jadowitych roślin i zwierząt. Do tej grupy w pewnym stopniu zaliczyćby można zatrucia bojowe, najlepiej jednak odpowiadające następnej grupie.
Oczywiście prawie wszystkie istniejące trucizny posłużyć mogą do wywołania takich przypadkowych zatruć.
2) Zatrucia zawodowe — spowodowane użyciem w pracy jadowitych materjałów, w nieodpowiednich warunkach wentylacji, w szczególności w braku wentylacji brudnych warsztatów, niedbalstwa samych robotników i t. d. W tych warunkach powstają zazwyczaj powolne chroniczne zatrucia, przewlekłe postacie chorób, albo przygodne ostre zatrucia.
Najważniejszemi są zatrucia ołowiem, rtęcią, arsenem, chromem i przedewszystkiem czadem. Mniejsze znaczenie mają gazy i pary drażniące, jak np. chlor.
Ponieważ w teraźniejszych warunkach również żołnierze zmuszeni są przebywać w obecności nietylko specjalnie użytych przeciwko nim środków bojowych, ale prócz tego otoczeni są zewsząd produktami spalania prochu i innych środków wybuchowych, zawierających duże ilości czadu i tlenków azotu — zatrucia bojowe można też zaliczyć do tej grupy.
3) Zatrucia zwyczajowe, albo nałogowe. Do tej grupy należą wszystkie zatrucia, w których trucizna jest świadomie użyta przez osobę zatruwającą się, w celu wywołania pewnych stanów odurzenia. Liczba tych trucizn jest dość znaczna — należą do niej: alkohol, tytoń, opium, morfina, kokaina i haszysz.
Wszędzie, od samego początku istnienia ludzi, środki te prawdopodobnie były używane. Zatrucia tego rodzaju, obok bardzo poważnego znaczenia społecznego, są też bardzo ciekawe z punktu widzenia toksykologicznego, posiadają bowiem pewne specjalne cechy, których brak zupełnie we wszelkich innych zatruciach. Cechami takiemi są:
a) niezwykła odporność nałogowych osobników, dochodząca do wytrzymywania niewiarogodnych dawek trucizny, nieraz kilkanaście razy przewyższających zwykłe dawki śmiertelne i b) objawy głodu truciźnianego (najwyraźniejszy z nich jest głód morfinowy), szereg zjawisk chorobowych, powstających u nałogowych ludzi, jeżeli nie otrzymują trucizny w dawce, do której są przyzwyczajeni.
4) Zatrucia pokarmowe — do tych należą skutki użycia zepsutych środków spożywczych. Zepsucie to może być zależne od procesów fermentacji i gnicia, wywołanych przez działania drobnoustrojów, jak również od spożycia mięsa zwierząt chorych.
Obok zatruć pokarmowych uwagę zwrócić należy również na istnienie całego szeregu zachorowań masowych, powstających nie wskutek obecności w pokarmie jakichkolwiek trucizn, a naodwrót, z powodu braku zawartych zwykle w pokarmie minimalnych ilości swoistych składników — witaminów.
Co do dróg przenikania trucizn wewnątrz ustroju i do komórek żywych musimy zwrócić uwagę głównie na następujące zasadnicze podstawy działania trucizn.
1. Aby być czynną, trucizna musi być rozpuszczalną w wodzie albo w lipoidach, substancjach podobnych do tłuszczu.
2. Aby wywołać zmiany w żywych komórkach, trucizna nietylko musi być obecną we krwi, lecz musi także posiadać zdolność przenikania do ciała żywej komórki.
Czynne trucizny są zwykle obecne w otoczeniu, albo w stanie pary i gazów, albo w stanie rozczynów wodnych. Twarde cząsteczki, składniki pyłu okazują się albo mniej więcej rozpuszczalnemi w płynach organizmu, więc działają jako płyn, lub odgrywają role czynników tylko mechanicznych.
Głównemi drogami przenikania trucizny z otaczającego środowiska są:
1) kanał trawienny, 2) drogi oddechowe, 3) skóra, 4) dostępne śluzówki — jama ustna i nosowa, prostnica i pochwa i 5) spojówka oka.
W razie sztucznego wprowadzenia trucizn temi drogami trzeba dodać: 6) podskórek i miąższ mięśni, oraz innych organów (wstrzykiwania podskórne i miąższowe), 7) naczynia krwionośne, przedewszystkiem żyły, 8) jamy surowicze, 9) dostępne zzewnątrz narządy — pęcherz moczowy, macica i t. d.
W badaniu trucizn bojowych obchodzą nas tylko drogi naturalne.
Wchłanianie trucizn w przewodzie pokarmowym podlega tym samym prawom, co wchłanianie substancyj pokarmowych, przyczem ustalono, że najważniejszem miejscem wchłaniania są jelita cienkie. Jama ustna, gardziel i przełyk stykając się zwykle z trucizną przez krótką chwilę, już dlatego nie odgrywają poważniejszej roli, o ile naturalnie nie chodzi o uszkodzenie miejscowe.
W żołądku obserwowano wchłanianie alkoholu i niektórych innych związków organicznych, lecz wogóle wchłanianie jest tutaj nieznaczne; dlatego zatruciu łatwo mogą zapobiec wymioty, czy to sztucznie wywołane, czy występujące samodzielnie. Rozczyny tłuszczowe w żołądku nie podlegają wchłanianiu zupełnie.
Sam sposób wchłaniania jest bardzo złożony i nie we wszystkich wypadkach jednakowy. Zauważmy przedewszystkiem, że między znajdującą się w naczyniach krwią, a rozczynami trucizn w jelitach leży warstewka nabłonka jelitowego, otaczającego zarówno kosmki okrywające powierzchnię, jak liczne gruczoły Lieberkühn’a w samej śluzówce. Przenikając do wnętrza śluzówki, pochłaniana substancja musi koniecznie przejść przez warstwę śluzu pokrywającego nabłonek. Nabłonek leży na tkance łącznej, obfitującej w naczynia chłonne i włoskowate, których tkanki złożone są także z żywych komórek śródbłonka. Żadna z tych warstw komórek żywych, mając wogóle własności błonki organicznej, t. j. podlegającej prawom dyalizy, nie odpowiada w szczegółach własnościom martwej błonki z pergaminu i dlatego wyniki rezorpcji też nie odpowiadają wynikom prostej dyalizy.
Przedewszystkiem podlegają wchłanianiu rozczyny nietylko izotoniczne, ale i hypertoniczne, o mocniejszem nawet stężeniu cząsteczkowem, z szybkością niezależną od warunków osmotycznych. Przez śluzówkę jelit przenikają także i tłuszcze i inne lipoidy, które nie przechodzą przez martwe błonki.
Losy rozmaitych substancyj, po przejściu przez nabłonek jelitowy, są też niejednakowe.
Największa część ich może przeniknąć bezpośrednio do naczyń krwionośnych, a przez nie do krwioobiegu wrotnego wątroby; są jednak i takie związki, przedewszystkiem tłuszcze i rozpuszczalne w nich substancje, które przenikają bezpośrednio tylko do naczyń chłonnych i do krwi trafiają razem z mleczkiem do żył szyi, omijając wątrobę. Jest to bardzo ważny szczegół, ponieważ wątroba, obok innych zadań, jest też najczynniejszym narządem odtruwającym.
System oddechowy jest miejscem wchłaniania gazów i par znajdujących się w powietrzu. Z wyjątkiem tlenu i nielicznych omówionych już gazów (CO, H2S, HCN, NO), łączących się z hemoglobiną w niestałe związki chemiczne i zdolnych do wchłaniania się w stosunkach ilościowo większych niż ich rozpuszczalność w osoczu krwi, wszystkie inne gazy podlegają prawom częściowego ciśnienia i znajdują się we krwi w stężeniach odpowiednich do ich zawartości w atmosferze. Nabłonek oddechowy nie przedstawia, o ile wiadomo, żadnej przeszkody do wchłaniania i każdy gaz, który przeniknie do pęcherzyka płucnego, bezwzględnie dosięga też krwi.
Jednak trzeba też zauważyć, że przed temi pęcherzykami leży jeszcze długi kanał oddechowy, pokryty nabłonkiem o ogólnych własnościach nabłonka przewodu pokarmowego, czyli jest zawsze wilgotny i pokryty śluzem. Ta wilgoć może pochłaniać znaczną ilość trucizn zawartych w powietrzu, dlaczego też mamy zwykle objawy działania miejscowego przedewszystkiem w tych górnych częściach dróg oddechowych. Do chłonnej działalności tych dróg oddechowych należy też prawdopodobnie i zdolność płuc do pochłaniania znacznej ilości płynów powstałych w płucach wskutek obrzęku, albo dostarczonych przez tchawicę. Wreszcie narząd oddechowy jest jedynem miejscem w ustroju, gdzie mamy też pochłanianie cząstek stałych pyłu. Znaczniejsza część tego pyłu nie dosięga pęcherzyków płucnych, zatrzymana przez śluzówki jamy nosogardzielowej i górnych części dróg oddechowych, poczem bywa wyrzucana nazewnątrz w składzie plwociny. Jednak nawet w zwykłych warunkach pewna część pyłu dostaje się do samych pęcherzyków.
Dlatego też u każdego człowieka dorosłego płuca są zabarwione na czarno, dzięki obecności w nich licznych cząsteczek węgla, pochodzącego z dymu i sadzy powietrza naszych miast.
Cząsteczki takie nie pozostają stale w pęcherzykach. Dostają się one następnie do wnętrza białych ciałek krwi częściowo znajdujących się i w plwocinie (t. zw. komórki pyłochłonne). Komórki te, dzięki swym ruchom czynnym, razem z swą zawartością przechodzą przez ściany pęcherzyków do naczyń i gruczołów chłonnych oskrzeli i płuc. W razie skupienia znacznej ilości takich cząstek w tkankach powstaje zapalenie o długotrwałym chronicznym przebiegu i w wyniku zjawia się marskość płuc. Takie stany chorobowe nazywają się pylicami.
Prawdopodobnie pewne specjalne postacie tych pylic będą odgrywały ważną rolę, jako skutki działania dymów bojowych, a przedewszystkiem mocno drażniących sternitów (dymów wywołujących kichanie).
Skóra człowieka oraz wszystkich istot przystosowanych do życia w powietrzu, jest przedewszystkiem narządem ochronnym, którego celem jest zapobiegać jakiemukolwiek wchłanianiu z powierzchni. Inne warunki mamy u istot wodnych, albo przystosowanych do życia zarówno w powietrzu jak i w wodzie. Skóra kijanek łatwo wchłania trucizny z wody, żaba przez skórę pochłania wszelkie pary wraz z parami wody.
Naodwrót ani ssaki, ani ptaki nie są zdolne do pochłaniania przez skórę płynów i gazów w warunkach normalnych, t. j. składników atmosfery i rozczynów wodnych.
Podobna odporność skóry polega na obecności w powierzchownych warstwach naskórka dużej ilości tłuszczów skórnych (eterów cholesteriny). Ta sama jednak cecha skóry czyni ją łatwo przepuszczalną dla wszystkich związków rozpuszczających się w tłuszczach lub zdolnych do wytwarzania wraz z niemi płynnych zawiesin.
W tych warunkach drobne cząsteczki zawarte w tłuszczu przedostają się przez ujścia gruczołów łojowych i potowych do dolnych żywych warstw naskórka, albo do nabłonka gruczołów. W ten sposób tłumaczy się chłonienie przez skórę rtęci, srebra, olejków eterowych, chloroformu i t. d. a z pośród chemicznych środków bojowych iperytu, luizytu i wszelkich trucizn drażniących skórę.
Bardziej zdolne do wchłaniania są śluzówki dostępne zzewnątrz: śluzówka jamy ustnej, nosa, gardzieli, wysłane wielowarstwowym nabłonkiem żywym, albo częściowo zrogowaciałym. Takie śluzówki podobne są do skóry zwierząt wodnych. Bardziej zastosowaną do wchłaniania rozczynów wodnych jest śluzówka prostnicy i dolnych części jelit grubych, co umożliwia dostarczanie lekarstw tą drogą, jak również daje powód do zatruć przez lewatywę.
Zmienioną częściowo w swych właściwościach skórą jest też, bardzo czuła na podraźnienie, spojówka i jeszcze czulsza rogówka oka. W tym wypadku mamy przedewszystkiem do czynienia ze zmianami o charakterze przeważnie miejscowym w zależności od małej objętości worka spojówki i od stałego prądu łez usuwającego z tego worka obce substancje. Ani oko, ani ucho nie przedstawiają drogi dla zatruć ogólnych.
Ze wszystkiego, co tu było powiedziane, wynika, że zasadniczą podstawą przenikania trucizny do krwi, o ile nie chodzi o bezpośrednie wstrzykiwania dożylne, jest zawsze przenikanie do wnętrza żywej komórki. To samo zjawisko jest podstawą następnego rozwoju zatrucia, gdzie trucizna działa na narządy życiowe.
Dlatego stosunek pomiędzy komórką żywą a otaczającem ją (zwykle płynnem) środowiskiem, jest jednem z najważniejszych zagadnień fizjologji i toksykologji.
Naogół żywa komórka opiera się przenikaniu substancyj obcych do wnętrza jej zarodzi. Dlatego wśród mnóstwa znanych barwników, używanych w technice mikroskopowej, tylko bardzo niewielka liczba jest w stanie zabarwić żywą komórkę, lecz i w takich razach barwią się tylko pewne jej składniki. Takiemi barwnikami są naprzykład: Neutralrot (czerwień obojętna) — dla ziarnek protoplazmy, Methylenblau (błękit metylenowy) — dla włókienek nerwowych.
W tych wypadkach nagromadzenie barwnika w tkankach przybiera duże rozmiary nawet w rozczynach bardzo rozcieńczonych. Kijanki barwią się na ciemno-czerwono w rozczynie Neutralrot (czerwieni obojętnej) 1/50 000.
Zawartość w krwinkach czerwonych dużej ilości potasu, obok zupełnego prawie braku sodu i odwrotny stosunek plazmy krwi wykazują, że chodzi tu o bardziej skomplikowane procesy niż prosta dyfuzja.
Z tego punktu widzenia możemy ustalić podział następujący:
1. substancje zupełnie niezdolne do przenikania wewnątrz żywej protoplazmy. Do tych należą prawie wszystkie sole, oraz znaczna część innych rozpuszczalnych w wodzie substancyj. Komórka stosuje się do ich rozczynu jako prawdziwy osmometr. Wynika to ze znanych zjawisk plazmolizy komórek roślinnych. Roślinna komórka jest workiem protoplazmy, który zawiera we wnętrzu dużą kroplę płynu — (wodniczkę), przylegającą ściśle do twardych ścianek z cellulozy (drzewnik). W warunkach normalnych stężenie płynu wewnętrznego jest większe niż stężenie otoczenia, wskutek czego ciśnienie osmotyczne powoduje wyżej wzmiankowane ścisłe przyleganie protoplazmy do twardej ścianki. Jeżeli zwiększymy ciśnienie osmotyczne środowiska do stopnia wyższego niż stężenie płynu zawartego w wodniczce, ta ostatnia zmniejszy się aż do zupełnego zniknięcia, a pomiędzy protoplazmą i ścianką z cellulozy powstanie pusta przestrzeń. Następuje to wówczas, jeżeli protoplazma jest przepuszczalną dla wody, a nieprzepuszczalną dla zawartych w niej składników.
2. Substancje łatwo przenikające przez protoplazmę. Do takich należy naprzykład mocznik. Zjawiska plazmolizy nie dadzą się zauważyć w użyciu takich ciał, które nie wytwarzają różnicy stężenia, a zatem i ciśnienia osmotycznego, stężenie pozostaje wówczas jednakowe, zarówno w komórce, jak w środowisku otaczającem. Osmotyczne ciśnienie otaczającego środowiska jest izotonicznem wówczas, gdy równa się ciśnieniu wewnątrzkomórkowemu i heterotoniczne, gdy różni się od niego. Zwykle mamy niewielką nadwyżkę ciśnienia wewnątrzkomórkowego wobec ciśnienia krwi. Ciśnienie krwi u człowieka i kręgowców jest liczbą bardzo stałą, waha się ono pomiędzy:
Δ (depresja) jest różnicą pomiędzy temperaturą zmarznięcia rozczynu i czystego rozczynnika.
Nawet w wyjątkowych warunkach (dożylnego wstrzykiwania stężonego rozczynu soli i przepełnienia przewodu pokarmowego w stanie głodu wodą destylowaną) ciśnienie krwi może podnieść się nie wyżej niż Δ = − 1,13 i obniżyć do Δ = − 0,37. (Według doświadczeń wykonanych w mojem laboratorjum przez pp. Nowaczka i Winogradowa).
Związkami chemicznemi, dla których żywe błonki organiczne bywają nieprzepuszczalne, są przedewszystkiem sole, rozpuszczalne w wodzie węglowodany i wiele innych związków organicznych.
Odporność żywej zarodzi wobec obcych składników środowiska nie bywa nigdy absolutna. W rzeczywistości mamy do czynienia raczej z substancjami przenikającemi łatwo albo trudno. Dlatego zjawiska, zależne od powstawania nierównowagi osmotycznej nie wykluczają możności działania chemicznego, jak również naodwrót.
Ponieważ objawy nierównowagi osmotycznej, w razie usunięcia wody, polegają na podniesieniu wrażliwości odruchowej aż do powstania napadu kurczów, a w razie nasycenia wodą na postępującym niedowładzie, aż do zupełnego porażenia, przeto w każdem doświadczeniu toksykologicznem należy unikać powikłań, które mogą powstawać w ten sposób. W myśl tego nie należy używać do zastrzyku, zwłaszcza dożylnego, mocnych rozczynów (w znacznym stopniu hypertonicznych), po wtóre unikać należy w miarę możności wody destylowanej, biorąc natomiast izotoniczny rozczyn soli kuchennej, 0,9% dla ssaków, a 0,6% dla płazów.
Przy długotrwałych doświadczeniach używano bardziej skomplikowanych rozczynów (przez wzgląd na specyficzne działanie pewnych jonów) w których część soli kuchennej zastępują chlorki potasu, wapnia i dwuwęglanu, oraz fosforanu sodu.
Podtrzymywanie ścisłej równowagi osmotycznej w żywym ustroju jest wspólnym wynikiem czynności całego szeregu narządów, połączonej przedewszystkiem z przemianą mineralnych składników ustroju i wody. Dlatego też naruszenie tej równowagi staje się rychło powodem uszkodzenia tych narządów ze zwykłemi objawami zatrucia. W wyniku powstają: 1) pewne objawy mocznicy w uszkodzeniu nerek, 2) liczne objawy obrzęku, 3) zmiany składu krwi, a w niektórych wypadkach objawy hemolizy.
Dalej zauważymy, że odporność żywej komórki na działanie hypotonicznych rozczynów nie jest także czemś stałem. Waha się ona w pewnych granicach nawet w warunkach normalnych, podlega jeszcze większym wahaniom, zwykle w znaczeniu obniżenia wskutek działania niektórych trucizn. Tego rodzaju zjawiska najdokładniej zostały zbadane na krwinkach czerwonych. Jest to sposób badania bardzo dostępny; jako wskaźnik służą, zabarwienie płynu przez występującą z ciałek hemoglobinę, oraz zmiany objętości krwinek określane zapomocą specjalnej wirówki (hematokritu).
Okazało się, że krwinki są w stanie wytrzymać znaczny stopień obniżenia stężenia cząsteczkowego, zmieniając swą objętość, ale nie podlegając hemolizie. Dla normalnego człowieka granica hemolizy leży pomiędzy 0,3 i 0,4% NaCl. Najmniejsze ilości, t. zw. hemolitycznych trucizn podnoszą to stężenie do tego stopnia, że hemoliza powstaje nawet w rozczynie hypertonicznym (wyżej 0,9%).
Na podstawie tego wszystkiego musimy przypuszczać, że nieprzepuszczalność protoplazmy dla pewnych substancyj zależną jest od wielu warunków i w żaden sposób nie może zapobiec zatruciu, jakkolwiek wytwarza przeszkody dla działania trucizn na komórki.
Pewne substancje są zdolne nietylko do przenikania wewnątrz protoplazmy, lecz mają jeszcze własności nagromadzania się w ilościach znacznie większych niż stężenie w środowisku. Nagromadzenie takie nazywa się cytotropizmem, o ile chodzi
o samą komórkę, albo organotropizmem, jeżeli mamy do czynienia z całemi narządami. Jest to zasadniczą cechą działania wszystkich trucizn, z wyjątkiem tylko mocnych kwasów, ługów, stężonych rozczynów soli ciężkich metali i t. d., gdy właściwie mamy do czynienia nie z zatruciem, a raczej ze zniszczeniem żywej tkanki.
Stopień organotropizmu jest bardzo niejednakowy, np. jest bardzo znacznym względem niektórych związków arsenowych, przedewszystkiem względem słynnego salwarsanu, zabijającego pasorzyty kiły wpierw niż komórki ciała. W pewnych wypadkach salwarsan wywołuje jednak dzięki temuż cytotropizmowi niebezpieczne zmiany w układzie nerwowym.
W zatruciach innemi związkami arsenowemi, używanemi jako środki bojowe, występuje wyraźny pneumotropizm, czyli uszkodzenie płuc po wprowadzeniu trucizny bezpośrednio do krwi albo pod skórę. Takiego rodzaju własności posiada np. luizyt.
Najpospolitszemi objawami tej kategorii są uszkodzenia narządów wydzielania, w których nagromadzają się duże ilości niektórych trucizn. Ztąd powstają toksyczne zapalenia nerek, jelit, płuc, niezależnie od sposobu przenikania trucizny.
Zdolność komórek tejże samej tkanki do nagromadzania trucizn jest też bardzo niejednakowa, od czego zależną jest swoistość działania np. na układ nerwowy. Stężenie, wystarczające dla wywołania zjawisk zatrucia, będzie oczywiście osiągnięte wcześniej w narządach, względnie komórkach o większym stopniu organotropizmu, niż w innych komórkach ciała.
Co do treści zjawisk organotropizmu i samego sposobu połączenia się trucizny z komórką żywą istnieją dwie zasadnicze możliwości. Po pierwsze możliwem jest czysto fizyczne połączenie przez powstanie odpowiednich rozczynów, zwykle lipoidalnych, albo wskutek adsorpcji analogicznie do działania barwników, po drugie — nie ulega wątpliwości, że w niektórych warunkach mamy do czynienia z prawdziwemi odczynami chemicznemi, których skutkiem są zmiany we własnościach zarówno zatrutej tkanki, jak i samej trucizny. Losy trucizn są też bardzo niejednakowe; do dokładniejszego omówienia ich przystąpimy nieco dalej.
Co się tyczy nagromadzenia pewnych trucizn w stanie niezmienionym, zjawisko takie zależy przeważnie od obecności w odpowiednich komórkach dużej ilości specjalnych substancyj, w których dana trucizna jest łatwiej rozpuszczalna niż w wodzie, a więc i w plazmie krwi. Same te substancje są podobnie jak tłuszcz mało albo wcale nierozpuszczalnemi w wodzie i stosownie łatwo rozpuszczalnemi w tak zwanych rozpuszczalnikach organicznych — alkoholu, eterze, chloroformie i acetonie. Z tego powodu zostały naogół nazwane lipoidami (λίπος — tłuszcz). Co do chemicznego składu, są to związki bardzo rozmaite, które obok C, H, i O jak tłuszcze i steriny, mogą zawierać również P, N i w niektórych wypadkach S. W komórkach dają one zwykle złożone połączenia z białkiem, tworząc tak zwane lecitalbuminy i lipalbuminy. Najważniejszemi lipoidami są: trójglicerydy (zwykle tłuszcze); lecytyny, tłuszcze zawierające kwas fosforowy i związki azotowe; cholesteryny czyli steryny, alkohole o budowie złożonej; woski (estry) połączenia wyższych kwasów tłuszczowych z jednoatomowemi wyższemi alkoholami. Mniej znanemi a bardziej złożonemi lipoidami, ogromnie rozpowszechnionemi w komórkach są: fosfatydy, podobne ze składu pierwiastków do lecytyny, mogące zawierać w liczbie składników swej cząsteczki zamiast gliceryny — galaktozę (składnik cukru mlecznego) oraz pewne specjalne składniki, jak aminoalkohol sfingozinę.
Połączenie trucizn z lipoidami jest podstawą słynnej teorji narkozy Overtona-Mayer’a. Teorja ta została przystosowana do działania takich trucizn, jak eter i chloroform, zasadniczą cechą których jest chwilowe odurzenie, utrata przytomności, głęboki sen z następnym powrotem do normy. Okazało się jednak, że nawet prawdziwe narkotyki, jak chloroform, nie są zupełnie obojętnemi, i że sposobność nagromadzenia się w znacznych ilościach wskutek rozpuszczalności w lipoidach jest zasadniczą cechą wielu trucizn o zupełnie innych sposobach działania na organizm.
Podstawą teorji Overtona-Mayer’a, mającej takie poważne znaczenie dla zrozumienia sposobu działania trucizn wogóle, jest znane prawo chemji fizycznej, według którego stężenie substancji, rozpuszczalnej w dwóch nawzajem nierozpuszczalnych lub mało rozpuszczalnych płynach, tworzących więc dwie oddzielne fazy, jak woda i olej, jest zależne od jej rozpuszczalności w każdym z tych płynów. Stężenie jest wprost proporcjonalne do tej rozpuszczalności. Okazało się, że zdolność wywoływania narkozy wzrasta równolegle do powiększenia rozpuszczalności w oleju i zmniejsza się równolegle do rozpuszczalności w wodzie. Naprzykład omówione stosunki dla alkoholów szeregu tłuszczowego są takie (doświadczenia na kijankach).
| Wzór | Rozpuszczalność | Stężenie narkotyzujące | |
| w wodzie | w oleju | ||
| CH3OH | ∞ | 1/50 | 16,04 |
| C2H5OH | ∞ | 1/1 | 12,4 |
| C3H7OH | 8/1 | 1/1 | 6,6 |
| C4H9OH | 1/12 | ∞ | 2,74 |
| — | — | — | — |
| C6H13OH | 1/2000 | ∞ | 0,04 |
Dla estrów etylowych homologicznych kwasów tłuszczowych mamy takie stosunki.
| Wzór | Rozpuszczalność | Stężenie narkotyzujące | |
| w wodzie | w oleju | ||
| C2H5CO2H | 1/1 | 4/1 | 5,18 |
| C2H5CO2CH3 | 1/15 | ∞ | 3,06 |
| C2H5CO2C2H5 | 1/50 | ∞ | 3,06 |
| C2H5CO2C3H7 | 1/200 | ∞ | 0,56 |
| C2H5CO2C4H9 | 1/500 | ∞ | 0,27 |
Dla pewnych środków nasennych (doświadczenia na ludziach).
Stos. rozp. woda
|
Dawka na kg
| |
olej
| ||
| Chloralhydrat | 0,22 | 0,025 |
| Bromalhydrat | 0,7 | 0,020 |
| Sulfonal | 1,1 | 0,006 |
| Trional | 4,0 | 0,0018 |
| Tetronal | 4,4 | 0,0013 |
Znaczna część tych substancyj zostaje wydzielona z organizmu w stanie niezmienionym, albo w połączeniu z kwasem glikuronowym, w stanie nietrującego związku, lub wreszcie spala się całkiem, aż na wodę i kwas węglowy. Są to więc wszystko trucizny wyłącznie czynnościowe, a działanie ich zwykle jest chwilowe. Wskutek tego najprawdopodobniejsze będzie przypuszczenie, że mamy tu do czynienia, co do istoty zjawiska, również z porażeniem wskutek przeładowania.
To zjawisko, składające się z nagromadzenia w protoplazmie pewnych substancyj w stanie niezmienionym, zaczynając od wody, odznacza się obniżeniem wrażliwości na podrażnienie oraz czynności komórek, aż do zupełnego porażenia i jest przejawem bardzo zwykłym ujemnych stanów istnienia. Zjawisko to istnieje jako fakt ustalony dla wielu tkanek, a najlepiej da się obserwować na mięśniach.
Na podstawie powyższych danych wyprowadzamy wniosek, że przenikające do ustroju substancje mogą: 1) połączyć się w miejscu wprowadzenia ze składnikami organizmu i pozostać na niem (działanie pierwotne miejscowe);
2) podlegać rezorpcji i w ten sposób dostawać się do krwi;
3) przejść ze krwi do tkanek, a nawet do wnętrza komórek, gdzie albo wytwarzają stałe połączenia, albo zatrzymują się na pewien czas, przedostając się potem na nowo do krwi i do organów wydzielania.
Stosunek trucizny do ustroju jest zależny od czasu jaki upłynął od chwili wprowadzenia. Z początku znajduje się ona w miejscu wprowadzenia i w pewnych warunkach, jak np. w jelitach może pozostawać tam przez dość długi czas. Równie możliwe jest długotrwałe zatrzymanie trucizn na skórze, lub w drogach oddechowych, jak np. w wypadku pylic.
Obecność substancji obcej we krwi, o ile brak stałego źródła dostarczania jej (np. nagromadzenia w tkankach, albo na powierzchni ciała), bywa zwykle zjawiskiem bardzo krótkotrwałem, ponieważ przenika ona prędko do tkanek, albo zostaje wyrzucona nazewnątrz przez narządy wydzielcze, z moczem, kałem, wydychanem powietrzem albo potem w wydzielinach skórnych.
Bardzo często znajdujemy we krwi i wydzielinach już nie pierwotną substancję, lecz te lub inne łączne z nią związki albo produkty rozkładu.
Stałe nagromadzenie obcych substancyj w tkankach jest dość rzadkiem zjawiskiem, tyczącem się przeważnie substancyj mineralnych (ciężkich metali).
Zwykłem miejscem takich nagromadzeń jest wątroba, a w pewnych wypadkach (nagromadzenie srebra) skóra i nerki, również kości i tłuszcz.
Trwałość takich nagromadzeń, w razie powstania nierozpuszczalnych związków, może być bardzo znaczna.
Miejscem zmian chemicznych substancyj, które dostały się do organizmu, może być miejsce dostarczania trucizn, które również mogą podlegać różnym powikłanym zmianom w ciągu procesu trawienia. Część tych zmian może dokonywać się nazewnątrz komórek, we krwi, lub płynie tkankowym, najliczniejsze jednak i najwybitniejsze zmiany są zawsze czynnością żywych komórek, a miejscem ich wykonania jest żywa zarodź, więc żywa micella.
Ciała obce wewnątrz organizmu mogą wywołać cały szereg zmian, z których jedne połączone są ze zmianami samej dostarczonej substancji, aż do całkowitego przetworzenia jej, zaś drugie przebiegają bez jakiejkolwiek zmiany wywołującego je czynnika. Substancje pierwszego rodzaju nazywano chemicznie czynnemi, drugie chemicznie biernemi. Ponieważ w tym ostatnim wypadku czynnikiem wywołującym zmiany w ustroju jest cała nietknięta cząsteczka obcej substancji, przeto działanie takich związków nazywamy cząsteczkowem (molekularnem).
Substancje zupełnie nie ulegające w organizmie zmianom chemicznym stanowią raczej wyjątek. W przeważnej ilości wypadków mamy do czynienia jedynie ze złudnemi stosunkami ilościowemi — obca substancja ulega częściowemu rozkładowi, a druga jej część wydziela się z organizmu w niezmienionym stanie. Tak np. alkohol etylowy utlenia się prawie całkowicie, jednak zawsze pewna nieznaczna jego ilość zostaje wyrzucona na zewnątrz razem z powietrzem oddechowem (1—2%), i z moczem (2—3%). Dla benzolu mamy stosunek odwrotny — organizm jest w stanie przerobić nie więcej niż 30% tej substancji.
Dlatego musimy przypuścić, że z reguły, współrzędnie z działaniem cząsteczkowem, istnieją też pewne odczyny chemiczne i odwrotowe.
Odpowiednio do tego nie należy przeciwstawiać sobie obu wyżej zarysowanych rodzaji działania, o ile dogodniejsze będzie rozpatrywanie treści tych działań niezależnie od tego, czy są one wyłącznemi własnościami danej substancji w stanie nietkniętym, czy też nie.
Każda obca substancja w rzeczywistości może wywołać cały szereg zjawisk, nie ograniczając się do jakiegokolwiek jedynego w swoim rodzaju odczynu. Zjawiska te, co do sposobu ich powstania, zależne są od licznych fizycznych i chemicznych własności obcej substancji i dlatego bywają bardzo rozmaite. Najważniejszą cechą każdej takiej substancji jest stopień jej rozpuszczalności w płynach organizmu i pewne własności uzależnione od tej rozpuszczalności. Dalej mamy do czynienia z bardzo powikłanemi zjawiskami absorpcji i odczynów katalitycznych i wreszcie z jeszcze więcej zagadkowem działaniem energji promienistej (radium i odczyny światłoczynne czyli fotoaktywne).
Niezależnie od tych zjawisk fizycznych każda rozpuszczalna substancja wogóle podlega w mniej więcej znacznym stopniu chemicznym zmianom, zazwyczaj również bardzo złożonym. Organizm w zasadzie nie jest przystosowany do tych zjawisk i dlatego obecność każdej substancji stwarza dlań nienormalne warunki istnienia i może być przyczyną jego choroby, lub, ściślej mówiąc, zatrucia.
Obcemi substancjami dla ustroju są wszystkie te, które nie wchodzą normalnie w skład jego tkanek i płynów, lub zjawiają się w nieodpowiednich ilościach, w nieodpowiedniem miejscu. Takie materjały spożywcze, jak białko albo cukier, niezbędne dla organizmu, przy sztucznem dostarczaniu dużych ilości do krwi, mogą wywoływać bardzo niebezpieczne zjawiska i z tego punktu widzenia mogą być zaliczone do szeregu trucizn. Stosownie do tego substancje obce można określić jako takie, których obecność wywołuje jakościowe, albo ilościowe zmiany w normalnym składzie organizmu.
Ponieważ życie organizmu jest szeregiem w zupełnie ścisły sposób wzajemnie do siebie przystosowanych chemicznych i fizycznych odczynów, przeto wszelkie zmiany tych stosunków musimy rozważać jako zaburzenia równowagi najzupełniej niezbędnej dla organizmu.
O ile organizm jest z natury przystosowany do obecności w otaczającem środowisku, lub w nim samym w odpowiedniem miejscu i odpowiedniej ilości, tych lub innych substancyj — mogą one być uważane za normalne, a nawet za niezbędne dla jego istnienia, lub też za źródło przetworów potrzebnych dla podtrzymania w nim przemiany materji i energji. O ile jednak takie przystosowanie nie jest dostateczne co do składu dostarczonej substancji, bądź też co do jej ilości, lub sposobu dostarczenia, wówczas obca substancja staje się trucizną.
Na podstawie tych zasadniczych cech wszystkie substancje, które można wprowadzić wewnątrz ciała zwierzęcego, dadzą się podzielić na następujące kategorje:
1. substancje potrzebne dla organizmu, które mogą być uważane jako materjały odżywcze;
2. substancje niepotrzebne, jednakże nie wywołujące chorobowych objawów wskutek zupełnego do nich przystosowania się organizmu, albo zupełnej ich fizycznej i chemicznej bierności. Takie substancje nazywamy obojętnemi;
3. substancje wywołujące zjawiska chorobowe, które musimy nazwać truciznami.
Istnienie organizmu jest niemożliwe bez ciągłej przemiany materji, ciągłego dostarczania mu substancyj odżywczych. Każdy organizm, zarówno roślinny jak zwierzęcy, musi bez przerwy pobierać jedne a wydzielać inne substancje. Są to — woda i pewne związki mineralne łącznie z gazami powietrza, jednakże materjały te wystarczają tylko dla zielonych roślin. Dla organizmu zwierzęcego niezbędny jest jeszcze ponadto cały szereg, częściowo nawet bardzo skomplikowanych, związków organicznych. Co się tyczy pierwiastków, z których złożone są te związki, należy podkreślić, że wszystkie najpospolitsze pierwiastki naszego otoczenia mogą być składnikami nietylko samej żywej materji ale i organizmów wogóle. Wynika to z zestawienia składu kory ziemi, wody oceanów i innych zbiorowisk wodnych i atmosfery z jednej strony, a ciała ludzkiego z drugiej.
| % zawartości w otoczeniu według Clarke’a | % zawartości w ciele zwierzęcym według Sherman’a | |
| O tlen | 50,02% | 65% |
| C węgiel | 0,18% | 18% |
| H wodór | 0,95% | 10% |
| N azot | 0,03% | 3% |
| Ca wapń | 3,47% | 2% |
| P fosfor | 0,12% | 1% |
| K potas | 2,88% | 0,35% |
| S siarka | 0,11% | 0,25% |
| Na sód | 2,36% | 0,15% |
| Cl chlor | 0,2% | 0,15% |
| Mg magnez | 2,08% | 0,05% |
| Fe żelazo | 4,18% | 0,004% |
| J jod | ślady | ślady[2] |
| F fluor | 0,1% | ślady |
| Si krzem | 27,74% | ślady |
| Al glin | 7,85% | 0 |
| Ti tytan | 0,46% | 0 |
| Br brom | 0,008% (w wodzie morskiej) | 0 |
| B bar | 0,08% | 0 |
| Mn mangan | 0,08% | znikome ślady |
| Sr stront | 0,02% | 0 |
| Inne pierwiastki razem — 0,47% | Li — lit znikome ślady |
| As — arsen „ „ | |
| Inne pierwiastki 0 |
Fluor jest stałym składnikiem szkliwa zębów. Obecność litu, arsenu, jak również baru, wanadu i glinu w tkankach ssaków, naogół biorąc, podlega wątpliwości.
Inne stworzenia mogą zawierać znikome ilości innych pierwiastków, tak np. wiele ślimaków zawiera miedź.
Znaczenie tych pierwiastków dla odczynów życiowych zupełnie nieodpowiada ich ilości. Zupełnie znikoma zawartość jodu w czynnej wydzielinie tarczycy nie przeszkadza, iż jest to pierwiastek bezwzględnie niezbędny dla życia. Stosunek ten zależy od tak zwanych zjawisk oligodynamicznych, o których będzie mowa niżej.
Z przytoczonych danych widzimy, że gdy najpospolitsze pierwiastki otoczenia jak krzem, glin i żelazo, są obecne w organizmie w znikomo małych ilościach, inne gromadzą się w ilościach znacznie większych od przeciętnej ich zawartości w otoczeniu. Takiemi są: azot, fosfor, siarka i również jod. Najpospolitsze składniki ciała węgiel, wodór i tlen, a z metali wapń i sód, zawarte są w większych ilościach niż w otoczeniu. Wogóle mamy wyraźną skłonność do nagromadzenia pewnych zasadniczych pierwiastków, co daje się stwierdzić, przy porównaniu najważniejszego z nich — węgla, którego ilość o sto razy przewyższa zawartość jego w otoczeniu. Do tego trzeba dodać, że pierwiastki tworzące organizm w żaden sposób nie mogą być zastąpione przez inne, choćby najbardziej pokrewne. Tak np. potas odgrywa zupełnie inną rolę w organizmie niż Na, Sr nie może zastąpić Ca, albo Br innych chlorowców.
Substancjami odżywczemi mogą być wyłącznie te związki, które zawierają niezbędne do życia pierwiastki. Warunki dokładnego żywienia zawarte są w tak zw. prawie minimum, ustalonem przez Liebiga dla roślin, ale w zasadzie słusznem również w stosunku do zwierząt. Prawo to głosi, że: 1) wyniki żywienia odpowiadają zawsze zawartości tego z niezbędnych pierwiastków, którego jest najmniej w pokarmie, 2) dla wszystkich składników istnieje pewne minimum, poniżej którego równowaga przemiany materji już nie może być podtrzymywana.
W razie obniżenia zawartości jednego z zasadniczych pierwiastków poza minimum, powstają zjawiska nieprawidłowego przebiegu procesów życiowych, mające wiele wspólnych cech z zatruciami, a które nazywamy głodem.
Zatem można mówić np. o głodzie azotowym, tlenowym, solnym, wapiennym i t. d. W organizmie zwierzęcym, którego zdolności syntetyczne są dość ograniczone, niezbędne pierwiastki muszą być dostarczane w stanie odpowiednich związków organicznych. Jedne z tych związków podobnie do zasadniczych pierwiastków: C, H, O, N, S, P, Ca, Na, K, Cl muszą być obecne w dużych ilościach i tworzą główne źródło energji, drugie, podobne do takich pierwiastków jak magnez, żelazo, jod, wystarczają w znikomo małych ilościach — trzecie, obejmujące wszystkie pierwiastki, zatrzymywane tylko w stanie znikomych śladów, są prawdopodobnie przypadkowemi składnikami pożywienia. W warunkach chorobowych, chronicznych zatruciach, mamy nagromadzenie zupełnie obcych pierwiastków, jak np. rtęci i srebra.
Wśród organicznych przetworów spożywczych rolę pospolitych pierwiastków odgrywają w organizmie zasadnicze składniki pokarmowe — węglowodany i tłuszcze, jako źródła C, H i częściowo O; białka, jako źródła N, P i S. Ca, i Cl są dostarczane zwykle w stanie związków mineralnych.
Rola czynników o działaniu oligodynamicznem przypada w udziale dwóm rodzajom związków, tak zw. witaminom i produktom czynności gruczołów naczyniowych, czyli hormonom.
Witaminami nazwano pewne związki zawierające azot, a występujące w bardzo małych, znikomych ilościach w żywych tkankach zarówno roślin jak i zwierząt. Związki te okazują się niezbędnemi do prawidłowego przebiegu żywienia układu nerwowego, rozwoju procesów wzrostu wogóle i w szczególności wzrostu szkieletu, i t. d. Istnienie ich zostało ustalone zaledwie kilka lat temu i chemiczny ich skład jest jeszcze mało znany. Wogóle rozróżniają dwa ich rodzaje: jedne rozpuszczalne w tłuszczu i drugie nierozpuszczalne w nim.
Brak witaminów w pokarmie wywołuje głód witaminowy, czyli awitaminozę, przyjmującą postać pewnych chorób bardzo podobnych do chronicznych zatruć.
Hormonami nazywamy wszystkie związki podtrzymujące tak zwaną korelację chemiczną, t. j. ściśle określony stosunek pomiędzy czynnościami chemicznemi poszczególnych narządów. Już z małej objętości najważniejszych gruczołów naczyniowych (ciałka nabłonkowe tarczycy — parathyreoideae u człowieka są czterema ziarenkami wielkości nasionka słonecznika, przysadka nie jest większą od orzecha laskowego, miąższowa część nadnercza jest cieniutką warstewką o powierzchni 4—5 cm kwadratowych), wynika, że ilość tych wyrabianych przez nie wydzielin musi być znikomo mała.
Mamy więc do czynienia z odczynnikami o działaniu niemniej mocnem, niż działanie najsilniejszych trucizn. Rzeczywiście mamy dwa równoległe szeregi chorób, z których jedne są skutkiem obecności w ustroju zbytecznej ilości tych hormonów, a drugie — głodu hormonowego, wskutek tak zwanej organolepsji czyli niewystarczającej czynności, albo zupełnego zaniku odpowiednich gruczołów. Zarówno pierwsze jak i drugie mają też wyraźne cechy zatruć.
Wśród zjawisk zależnych od braku pewnej ilości zasadniczych pierwiastków szczególne dla nas znaczenie mają: głód tlenowy, oraz niodostateczna zawartość wody w organizmie. Są to ważne czynniki w powstawaniu zatruć chemicznemi środkami bojowemi, mianowicie truciznami działającemi na ośrodki oddechowe.
Jakkolwiek skład chemiczny organizmu obfituje w tlen, zawierając go około 65% w stanie połączeń chemicznych, a przeważnie w stanie wody, jednakże najważniejszem źródłem tlenu okazuje się powietrze i ustrój zwierzęcy, pozbawiony tlenu w stanie wolnym, istnieć nie może. Anaerobioza — utlenienie jednych składników kosztem odtlenienia innych, w warunkach istnienia kręgowców ustępuje na dalszy plan, i jest raczej rzadkim wyjątkiem, mającym znaczenie wyłącznie w pewnych specjalnych zadaniach przemiany materji, mianowicie w głodzie tlenowym. Głód tlenowy jest niezbędnym skutkiem takich zmian w organizmie, w których zawartość tlenu we krwi staje się mniejszą niż w normie. Do takich zmian należą.
1) Nieprawidłowy skład otaczającego powietrza, ściślej rzecz biorąc, za małe cząsteczkowe ciśnienie tlenu. Organizm nie może przystosować się do ciśninia tlenu mniejszego od 1/8 normalnego, t. j. 1/40 atm., co odpowiada 0,5% O2 i jest granicą dyssocjacji hemoglobiny. Człowiek jest znacznie wrażliwszy na tego rodzaju głód niż inne ssaki.
Z nieszczęśliwych wypadków podczas podnoszenia się samolotów wiemy, że śmierć może nastąpić już przy 260 mm ciśnienia barometru (Croce Spinelli i Siwer) więc 7,2% O2 przeciętnie w ciągu 1/2 godziny.
2) Zmniejszenie ilości czynnej hemoglobiny we krwi, więc niedokrwistość jakiegokolwiek pochodzenia. (Żaby mogą przez pewien czas znosić zupełny brak hemoglobiny we krwi, co jest niemożliwe u istot mających ciepłą krew).
W tym samym sensie działa przetworzenie oxyhemoglobiny w karboxy- albo methemoglobinę.
3) Niewystarczająca czynność narządu oddechowego, t. j. płuc lub oskrzeli. Tylko nieznaczna ilość kręgowców może, jak to czynią żaby i inne płazy, oddychać wyłącznie przez skórę. Przyczyną takiej niewystarczającej czynności mogą być: a) przeszkody w drogach oddechowych — zaduszenie we właściwem znaczeniu tego wyrazu, b) porażenia mięśni oddechowych, wskutek uszkodzenia narządu oddechowego, przecięcie rdzenia pacierzowego poniżej 2-go kręgu, jak też i samych mięśni; trychinoza, zatrucie kurarą, c) zanik ujemnego ciśnienia w klatce piersiowej wskutek przenikania do niej powietrza, t. zw. pneumotorax, d) zmniejszenie powierzchni oddechowej — napełnienie pęcherzyków płucnych wysiękiem, płynem obrzękowym albo wodą wskutek utonięcia.
4) Niedomoga sercowa, skutkiem której jest osłabienie prądu krwi w płucach. Taka niewystarczająca działalność serca występuje najwyraźniej w lewej jego połowie, której czynność zanika wcześniej niż w prawej. W ogóle każde zatrzymanie w dostarczaniu krwi do jakichkolwiek tkanek wywołuje zanik ich czynności na stałe, albo w każdym razie na czas braku krążenia krwi. Porażenie może następować też po chwilowem podrażnieniu. Tak np. kora mózgowa odpowiada na brak krwi z początku powstawaniem ogólnych skurczy mięśniowych, a następnie porażeniem wszystkich mięśni; niedokrwistość rdzenia przedłużonego wywołuje paraplegię, t. j. porażenie tylnej połowy ciała. Niemniej wrażliwym od układu nerwowego jest mięsień serca. Zatkanie tętnicy sercowej powoduje natychmiastową śmierć. Sam sposób działania tlenu w organizmie, czyli treść procesów utleniania i odtleniania będą dokładnie rozpatrywane poniżej. Na tem miejscu wystarczy powiedzieć, że pochłonięty tlen wchodzi prawie całkowicie w skład przetworów utlenienia, których końcowem stadjum jest kwas węglowy i woda. Utlenianie idzie zawsze stopniowo i powoli po przez długi szereg przejściowych okresów. Przetwory częściowego utlenienia w normalnych warunkach prędko zostają wydalone i dlatego są obecne w ustroju tylko w znikomych ilościach. W głodzie tlenowym ilość ich znacznie wzrasta. Mają one wogóle własności kwasów organicznych i są silnemi odczynnikami odtleniającemi. Dlatego podczas głodu tlenowego zdolność tkanek do wykonywania redukcji przedewszystkiem dostarczonych do krwi obcych substancyj, zarówno jak i składników samego organizmu, okazuje się wyraźnie podniesioną. Reakcja odtleniania jest podstawą bardzo pięknej metody badania zjawisk odtleniania w organizmie wogóle. Pewne barwniki, jak np. błękit metylenowy, lub indygokarmin wytwarzają przez odtlenienie bezbarwne związki, t. zw. leukoprodukty, co daje się też łatwo osiągnąć np. przez działanie wodoru in statu nascendi. Produkty te powstają również w tkankach, w których barwniki te podlegają redukcji. Stopień odbarwienia pewnej ilości rozczynu o znanem stężeniu, jak również czas potrzebny na powrotne powstanie zabarwienia przy utlenianiu tlenem powietrza jest miarą natężenia odtleniania w danej tkance, lub stopnia powinowactwa jej do tlenu.
Tego rodzaju wchłanianie jest własnością tylko żywych komórek. Substancje łatwo podlegające rozkładowi wewnątrz komórek są albo zupełnie słabemi reducentami, albo utleniają się bardzo powoli nawet w nadmiarze tlenu w ich otoczeniu — we krwi albo w powietrzu. Takie zewnątrzkomórkowe utlenianie jest znacznie łatwiejsze w odczynie zasadowym. Wskutek tego musimy uznać proces utlenienia w organizmie za proces fermentacji, uzależniony nie tylko od obecności tlenu, lecz także od obecności odpowiednich fermentów komórkowych.
Od ilości i stopnia czynności tych fermentów: oksydaz i katalaz, zależą ostatecznie losy tlenu obecnego w organizmie. Nieczynność tych fermentów w pewnych zatruciach, np. zatruciu kwasem pruskim, czyni proces utlenienia niewykonalnym i dlatego w wypadku podobnych zatruć oxyhemoglobina pozostaje nietknięta.
Ciało ludzkie zawiera tlen przeważnie w stanie wody. Tlen zawarty w tej postaci stanowi 56% ogólnego ciężaru ciała, z pozostałych 44% na tlen przypada jeszcze 9%. Ogólna zawartość wody w organizmie dorosłego człowieka równa jest 65%, u noworodka nawet 71%. Dla tego usprawiedliwionem jest rozpatrywanie organizmu jako środowiska składającego się przedewszystkiem z rozczynów wodnych.
Co do zawartości wody w poszczególnych tkankach, to mamy (według Abderhaldena) dla człowieka następujące dane:
| szkliwo zębów .... | 0,2 |
| zębina ....... | 10,0 |
| kości szkieletu .... | 22,0 |
| tłuszcz (tkanka) .... | 30,0 |
| tkanka sprężysta ... | 50,0 |
| chrząstka ...... | 55,0 |
| wątroba ...... | 70,0 |
| rdzeń pacierzowy ... | 70,0 |
| biała substancja mózgu . | 70,0 |
| skóra ....... | 72,0 |
| mięśnie ....... | 76,0 |
| śledziona ...... | 76 |
| grasica ....... | 77 |
| trzustka ...... | 78 |
| jelita ....... | 79 |
| płuca ....... | 79 |
| serce ....... | 79 |
| krew ........ | 80 |
| tkanka łączna .... | 80 |
| nerki ....... | 83 |
| kora mózgu ..... | 86 |
| ciało szkliste .... | 99 |
Jeżeli prócz tego zwrócimy uwagę, że organizm wydziela codziennie przeciętnie 11/2 l moczu i oddaje przez skórę i płuca w stanie pary jeszcze około 1/2 l wody, to przyjdziemy do wniosku, że potrzebna do podtrzymania życia ilość wody jest bardzo znaczna, a więc głód wodny, czyli pragnienie, musi mieć bardzo ciężkie następstwa. Takiemi następstwami są, oprócz męczącego uczucia pragnienia, zgęszczenie krwi, t. zw. anhydremja, której skutkiem bywa podniesienie jej kleistości do tego stopnia, że krwioobieg staje się zupełnie niemożliwy, zatrzymanie wszystkich wydzielin, przeważnie moczu i wzmożenie wrażliwości wszystkich tkanek, a nadewszystko układu nerwowego. Organizm zatrzymuje chciwie ostatnią niezbędną dla siebie ilość pozostającej jeszcze w nim wody, wskutek czego prosty brak wody w pokarmie nie wystarcza jeszcze dla zmniejszenia się jej zawartości w ustroju. Zwierzę w tym stanie nie będzie jadło pokarmu pozbawionego wody, jak również zwierzę pozbawione pożywienia nie będzie piło wody w zwykłej ilości. Wyższe stopnie zmniejszenia się zawartości wody we krwi i w tkankach wywołać można jedynie przez usunięcie wody z organizmu. Sposobami takiego usunięcia są: 1) obfita diureza (powiększenie ilości moczu) wskutek dożylnego wstrzykiwania mocnych rozczynów soli. W ten sposób można osiągnąć w ciągu 1/2 do 1 godziny utratę wody wyższą od wydalanej ilości moczu w ciągu całej doby. 2) Silne biegunki, jak to bywa w cholerze. 3) Powstawanie obfitych wysięków z płynem o mniejszej zawartości białka niż we krwi. Takim jest wysięk zapalny w oparzeniach, jak również płyn napełniający płuca w obrzęku, przedewszystkiem obrzęku pochodzenia toksycznego. 4) Oddychanie absolutnie suchem i ogrzanem powietrzem i połączone z tem wydzielanie wody przez skórę. Organizm może wytrzymać w tych warunkach przez pewien czas tylko w razie dostarczania mu wody w ilościach równych poniesionym stratom.
Źródłem wody dla organizmu jest przedewszystkiem woda dostarczana do przewodu pokarmowego w postaci napojów. Woda ta nie bywa nigdy chemicznie czysta, lecz zawiera zawsze pewną ilość mineralnych składników, przeważnie soli wapnia, magnezu i sodu, w formie chlorków, węglanów i siarczanów. Przypuszczalna jadowitość czystej wody (destylowanej) według najnowszych danych podlega wątpliwości.
Drugiem źródłem wody, jednak znacznie mniej obfitem, są pewne jej ilości powstałe w samym organizmie, jako końcowe produkty wielu odczynów. U człowieka i innych ssaków są to ilości prawie znikome, lecz u pewnych owadów są one według wszelkiego prawdopodobieństwa głównem, jeżeli nie jedynem, źródłem wody zawartej w ich tkankach (np. dla pospolitego mola).
Trzeciem źródłem, mającem znaczenie tylko w wyjątkowych warunkach, jest woda zawarta w powietrzu. Niezaprzeczalnem źródłem dla podtrzymania równowagi w organizmie jest ona prawdopodobnie tylko dla płazów.
Rola obcych substancyj w tej przemianie wody w ustroju jest oczywistą. Każda dostarczona do krwi i podlegająca wydzielaniu substancja potrzebuje zawsze równoczesnego wydzielania pewnej ilości wody — każdy obrzęk toksyczny może stać się przyczyną niebezpiecznej anhydremji. Obok tego istnieją swoiste środki działające na nerki, (t. zw. diuretica) wywołujące podniesienie ich czynności niezależnie od warunków osmotycznych. Środkami takiemi są: kofeina i teobromina, jak również zawarta w przysadce pituitryna.
Zarówno woda, tlen i wszystkie związki nieorganiczne, jakkolwiek są składnikami niezbędnemi do życia organizmu, nie są jednak o ile chodzi o organizm zwierzęcy, przetworami odżywczemi we właściwem tego słowa znaczeniu. Aby dany produkt mógł zasłużyć na nazwę spożywczego, musi on być równocześnie źródłem energji, czyli procesy jego rozkładu w organizmie muszą być egzotermiczne.
Własności takie posiadają liczne substancje — w szczególności te z nich, które podlegają w organizmie utlenianiu. Pozostaje wszakże nierozwiązaną kwestja, czy w każdym wypadku powstała energja jest użyteczną dla organizmu, czyli zdolną do przetwarzania się w inne jej postacie, czy też jest ona wydzielana wprost w stanie ciepła, jak to mamy w każdym wypadku nadmiernego żywienia u ssaków.
Ilość powstałego w organizmie ciepła może zmieniać się, poczynając od pewnego minimum w bardzo znacznych granicach; u człowieka pomiędzy 2000 i 10000 kaloryj na dobę.
Istnieją też dwa punkty zapatrywania na rozkładające się w organizmie substancje. Według jednej teorji (Voit-Rubnera), każda substancja będąca źródłem energji, jest już przez to samo substancją odżywczą — według drugiej tylko taka, z której powstają cząsteczki żywej materji. Jest to treść teorji Chauveau.
Z punktu widzenia tej ostatniej teorji, nie każda utleniająca się substancja jest źródłem użytecznej energji, a tylko taka, która może przetworzyć się w glikogen, wobec tego jedynym prawdziwym środkiem spożywczym, stanowiącym źródło energji, jest cukier gronowy.
Ustalone w ostatnich czasach ciekawe dane co do skutków zupełnego zaniku cukru gronowego we krwi przy zatruciu insuliną (hormonem trzustki), mającem charakter prawdziwego zatrucia, nadaje teorji Chauveau wiele cech prawdopodobieństwa. Ponieważ jednak podtrzymanie temperatury ciała na odpowiednim poziomie jest niezbędne dla ustroju, to w braku innych źródeł będzie zużywał on również w tym celu cenny glikogen. Dlatego inne utleniające się w ciele substancje mogą odgrywać rolę dodatkowych substancyj odżywczych, chroniących glikogen od spalania. Źródłami glikogenu są bez wątpienia wszystkie węglowodany z 6 atomami węgla w cząsteczce, prawdopodobnie też pewne związki z 3 atomami węgla, jak gliceryna. Są też niemi i tłuszcze powstające z węglowodanów i mogące odwrotnie stać się ich źródłem w organizmie. Białka muszą być źródłem zarówno glikogenu jak i tłuszczów. Wszakże droga przetwarzania białka w glikogen jest bardzo powikłana i znaczna ilość białka okazuje się w tych warunkach zniszczoną. Dlatego też białko w razie dostarczania go w nadmiernej ilości spala się prawie całkowicie.
Tylko te trzy rodzaje substancyj spożywczych zasługują na swoją nazwę w istotnem znaczeniu tego słowa, będąc jednocześnie, jak już było mówione, źródłem najobfitszych w organizmie pierwiastków, a białko nawet jedynem źródłem azotu.
Stosownie do tego ilość białka zawartego w pokarmie nie może być obniżoną poniżej pewnego minimum, zwanego minimum azotowem. Wszystkie zaś inne składniki pokarmu dają się zastąpić jeden przez drugi, stosownie do ilości powstałych przy ich spalaniu kaloryj.
Z tego powodu, równocześnie z głodem wskutek braku potrzebnych dla organizmu pierwiastków, istnieje także głód wskutek braku wytwarzania energji — głód kaloryjny. Głód tego rodzaju zmusza organizm do niszczenia własnych tkanek, z początku złogów glikogenu, potem tłuszczów, a wkońcu białka, stanowiącego składnik żywej protoplazmy. Pewne trucizny mogą działać na organizm w kierunku podniesienia przemiany materji wogóle, to jest zmuszając go do wytwarzania większej ilości kaloryj kosztem wszystkich normalnych źródeł ciepła, albo też przeważnie w drodze rozkładu tylko białka. Taki rozkład białka nazywa się — rozkładem toksycznym (patrz § 13).
Substancje zupełnie niezdolne do rozpuszczania się w płynach organizmu lub składnikach żywych komórek, nie podlegające żadnym zmianom chemicznym i również nie wywołujące zjawisk nagromadzenia — nazywamy substancjami obojętnemi. Wydzielają się one z ustroju zazwyczaj w stanie niezmienionym, albo też odkładają się jako bierne masy w tkankach (pylice, zjawiska tatuowania i doświadczalne koniozy tkankowe). Zwykle nagromadzenia nierozpuszczalnych cząstek znajdują się w gruczołach chłonnych. Nawet substancje, w których skład wchodzą najjadowitsze pierwiastki, jak np. arsen, mogą w takich warunkach pozostać zupełnie nieczynnemi. Jako przykład służyć może całkiem bierna trójfeniloarsyna (C6H5)3As.
Zwrócimy uwagę na fakt, że bardzo podobna do niej etylo lub metylo arsyna (C2H5)H2As, i (CH3)H2As, jak również i sam arseniak AsH3 są silnemi truciznami, a chlorowe pochodne tych substancyj stanowią nawet wybitne środki bojowe, zwane „sternitami“, jak fenilodwuchloroarsyna C6H5Cl2As.
Brak czynności chemicznej, w razie dostatecznego stopnia rozpuszczalności, nie pozbawia tych związków własności czynników fizycznych, które występują w sposób bardzo jaskrawy.
Wszystkie substancje zdolne do wywoływania w ustroju warunków, do których komórki nie są przystosowane i których skutecznie nie mogą zrównoważyć, nazywamy truciznami wogóle. Każda taka substancja jest zasadniczą przyczyną pewnej choroby czyli zatrucia.
Określając jednak w ten sposób trucizny musielibyśmy zaliczyć do nich prawie wszystkie istniejące substancje i dlatego do powyższej definicji należy dodać jeszcze, jako niezbędny warunek działania toksycznego, pojęcie o ilości dostarczanej trucizny, czyli o wysokości jej dawki.
Właściwa trucizna jest w stanie wywoływać zjawiska chorobowe w ilościach stosunkowo bardzo małych. Dawka trująca nie jest stałą, ani w stosunku do użytej trucizny, ani też w stosunku do gatunku zatrutych zwierząt. Istnieją warunki w których zupełnie obojętna w pierwszych dawkach substancja staje się w użyciu ponownem najmocniejszą trucizną, zabijając w znikomych ilościach (objaw uczulenia czyli anafilaksji). W innych znowu warunkach, w tak zwanych zatruciach nałogowych, mamy stopniowe przyzwyczajanie się do używania środków niebezpiecznych w ilościach dziesiątki razy większych od przeciętnej dawki śmiertelnej dla normalnego człowieka. Niema trucizn bezwzględnych, to jest zabójczych dla każdego ustroju w dawkach nie przewyższających pewnej granicy, jak również nie istnieją bezwzględnie obojętne substancje. Do tego dodać musimy, że pewne powszechnie znane trucizny, jak np. alkohol etylowy, są równocześnie dobremi źródłami energji, ochraniającemi od rozkładu glikogen, a więc substancjami odżywczemi w ścisłem tego słowa znaczeniu.
To też pojęcia substancji spożywczej, obojętnej i trującej, są pojęciami względnemi. Losy ich w ustroju zasadniczo nie różnią się między sobą.
Pierwszą nieuniknioną zmianą, której podlega w organizmie każda substancja czynna, jest jej rozpuszczanie. Zwykle jednak wszystkie prawie substancje pochłaniane z kanału trawiennego są już rozpuszczone w wodzie. Prócz wody, która zazwyczaj odgrywa tu rolę rozpuszczalnika, mogą nim być jedynie lipoidy. Lecz lipoidy, wchodząc w skład komórek otrzymują rozpuszczalne w nich substancje również z rozczynów wodnych; a więc wśród lipoidów ustroju bezpośredniemi rozczynnikami obcych substancyj mogą być tylko nieznaczne ilości lipoidów skórnych. Dlatego też twierdzić można, że rozpuszczalność obcych ciał w środowiskach otaczających komórki, lub w samych komórkach, jest kwestją rozpuszczania się tych ciał w wodzie.
Jeszcze starożytni alchemicy i lekarze nauczali: corpora non agunt nisi soluta — i aforyzm ten pozostał nieobalony do dziś.
Rozpuszczalnością w ścisłem tego słowa znaczeniu nazywamy taką właściwość ciał, w zasadzie niezdolnych do jakichkolwiek reakcyj chemicznych pomiędzy sobą, dzięki której mogą one wytwarzać samorzutnie mieszaninę, w której już nie jesteśmy w stanie ani rozróżnić jej pierwotnych składników przy pomocy przyrządów optycznych, ani też wydzielić ich w prosty mechaniczny sposób, mieszanina ta dlatego robi na nas wrażenie jednolitego środowiska, czyli fazy. Takiemi są mieszaniny gazów i par — substancje te mogą być zmieszane w dowolnych ilościach stosunkowych. Niektóre stopy metalów mają takież same właściwości jak mieszaniny gazów, t. j. powstają niezależnie od ilościowych stosunków ich składników. Wreszcie mieszaniny płynów z jakiemikolwiek bądź innemi co do stanu skupienia substancjami, należą też do tego rodzaju ciał.
Rozczyny w potocznem tego słowa znaczeniu, są to mieszaniny, w których rozpuszczalnikiem jest płyn; zasługują one na specjalne uwzględnienie.
Tylko nieliczne rozczyny płynów w płynach mogą powstawać w nieograniczonych stosunkach ilościowych; w większości wypadków ciała stałe i gazy rozpuszczają się w płynach tylko do pewnej granicy. Rozczyn, który osiągnął tę granicę nazywa się nasyconym. Dla niektórych substancyj granica ta w odpowiednich warunkach może być na pewien okres czasu przekroczona. Wówczas powstaje rozczyn przesycony, znajdujący się w stanie równowagi niestałej i łatwo przechodzącej w stan rozczynu nasyconego, z wydzieleniem nadmiernej ilości rozpuszczalnego składnika. Takie rozczyny przesycone powstają przy rozpuszczaniu w wodzie pewnych soli, zawierających wodę krystalizacyjną, jak np. siarczan sodu. Zresztą w wypadku zupełnego rozpuszczania się związków nieorganicznych, wytwarzają się one o wiele rzadziej niż w rozczynach organicznych, których krystalizacja często nastręcza ogromne trudności techniczne.
Warunki rozpuszczania się gazów i par, w temperaturze wyżej punktu wrzenia, są nieco inne. Mimo stopnia rozpuszczalności, który może być bardzo niejednakowy dla rozmaitych substancyj i niezależny od ich stanu, gazy podlegają prawu ciśnienia cząsteczkowego. Ilość gazu rozpuszczonego w płynie jest proporcjonalna do cząsteczkowego ciśnienia tego gazu w otoczeniu, niezależnie od obecności innych gazów lub par.
W wypadkach gdy rozpuszczalność jest ograniczona, wzrasta ona stosownie do temperatury. Dla ciał stałych i płynów mamy w przeważającej ilości wypadków zwiększenie się rozpuszczalności równolegle ze wzrostem temperatury. Bardzo nieliczne ciała, jak np. sól kuchenna, rozpuszczają się w ilościach mało zależnych od temperatury, a jeszcze mniej jest takich, których rozpuszczalność zmniejsza się w temperaturach wyższych. Rozpuszczalność gazów zawsze spada wraz z podniesieniem temperatury.
Proces rozpuszczania się jednych ciał w drugich stanowi jeden z najpospolitszych zresztą objawów zjawiska bardziej ogólnego — wzajemnego rozpraszania się ciał, czyli dyspersji. Proces
ten polega na rozdzieleniu się danego ciała (fazy dyspersowanej) na mniejsze lub większe cząsteczki, pomiędzy które wchodzi faza dyspersująca. Z początku mamy grube mieszaniny, jak np. kurz lub zawiesina cząsteczek stałych w powietrzu, następnie emulsje, powstające wskutek zawieszania się drobnych kropelek płynu nierozpuszczalnych w danej cieczy, jak np. woda i olej, wreszcie suspensje, o ile zachodzi zmięszanie się płynu z cząsteczkami ciała stałego.
W razie wciąż wzrastającego mieszania się cząsteczek powstają tak zwane rozczyny koloidalne: dymy i mgły, emulsoidy i suspensoidy, o własnościach bardzo ciekawych i ważnych dla tłumaczenia procesów biologicznych. W jeszcze większym stopniu dyspersji zostaje osiągnięta granica budowy cząsteczkowej i substancja dyspersowana rozkłada się na swe cząsteczki. Taka mieszanina wytwarza już tylko jedną fazę. Takiemi właśnie rozczynami molekularnemi są wszystkie wodne rozczyny nie poddające się elektrolizie, a więc rozczyny większości rozpuszczalnych związków organicznych. W jeszcze większym stopniu dyspersji, w rozczynach przepuszczających prąd elektryczny, który jest możliwy wyłącznie u elektrolitów, już same molekuły rozpadają się na dwa przeciwległe naładowane jony. Stopień tego rozkładu zależy zarówno od natury chemicznej rozpuszczalnika i ciała rozpuszczalnego, jak też od stopnia rozcieńczenia, czyli od stosunku pomiędzy fazami dyspersowaną i dyspersującą, dosięgając maksymum t. j. zupełnego rozkładu na jony wówczas, kiedy stosunek ten dobiega nieskończoności.
Rodzaj dyspersji zależy od właściwości obu wchodzących tu w grę składników. Tak np.: sól kuchenna, tworząca zjonizowany rozczyn z wodą, daje rozczyn molekularny z alkoholem i może dać koloidalny suspensoid z benzolem.
W warunkach istniejących w organizmie, z substancyj obcych dostarczonych w nierozpuszczonym stanie, mogą powstać, zależnie od okoliczności, zarówno molekularne jak i jonizowane rozczyny. Koloidalne rozczyny prawdopodobnie nie powstają, chociaż w pochłanianiu i transporcie tłuszczów tworzą się bardzo delikatne emulsje. Substancje obce dostarczone w stanie koloidalnych rozczynów mogą być wydzielone w takim samym stanie (jak np. obce białka), lub mogą podlegać rozkładowi. Tak zwane suspensoidy nie mogą istnieć w organizmie, ponieważ w obecności zjonizowanych rozczynów soli, które się w nim stale zawierają, podlegają one natychmiastowemu strącaniu. Losy emulsoidów, któremi są przeważnie koloidy pochodzenia organicznego, a przedewszystkiem wodne rozczyny białka, zasługują z punktu widzenia toksykologicznego na szczególniejszą uwagę.
Wszystkie t. zw. antygeny, substancje wywołujące zjawiska alergji — czyli podniesionej wrażliwości lub odporności (anafilaksji lub immunitetu), są w zasadzie rozczynami koloidalnemi. Takież właściwości koloidalne posiadają wszystkie dotychczas znane zaczyny, stanowiące główne odczynniki komórek naszego organizmu. Są to substancje wyjątkowo czynne, posiadające zdolność wywoływania odpowiednich reakcyj w zdumiewająco małych stężeniach. Tak np. zaczyn inwertaza jest w stanie rozłożyć 200.000 razy większą ilość cukru trzcinowego, chymosina skręca 400.000 razy większą ilość kazeiny, a peroksydaza chrzanu jest czynną nawet w rozcieńczeniu 1/500.000.000.
Podobne do fermentów są toksyny bakterjalne, np. toksyna tężcowa, która wytwarza się w hodowli prątków tężca w buljonie z mięsa. Kilka setnych cm3 tej toksyny może zabić nieuodpornionego konia. Po uodpornianiu w ciągu kilku tygodni, można wstrzykiwać koniowi setki cm3 takiego samego bulionu. Przystosowanie się ustroju do obecności we krwi obcych białek, a bardzo być może i innych koloidów, polega na wytwarzaniu się specjalnych zaczynów, rozkładających te substancje. Istnienie ich zostało ustalone przez Abderhaldena (Schutzfermente).
Z wyjątkiem nielicznych specjalnych wypadków, rozczyny obcych substancyj, dostarczone do organizmu, nie posiadają stanu koloidalnego, wówczas gdy sam organizm, a w szczególności zarodź komórek jego, oraz płyny tworzące środowisko międzykomórkowe, są zawsze rozczynami koloidalnemi, złożonemi z dużej ilości faz dyspersowanych, dla których rolę fazy dyspersującej odgrywa mieszanina molekularnych i jonizowanych rozczynów wodnych.
Dlatego też niemal wszystkie reakcje chemiczne w organizmie odbywają się w specjalnych warunkach stanu koloidalnego.
Wśród tych warunków na wyróżnienie zasługują: 1) duża rola energji powierzchniowej, zależnej od niejednostajności koloidalnych rozczynów i obecności wielkich powierzchni rozrzucających się faz; 2) zjawiska adsorpcji; 3) istnienie dwóch postaci typowych — sola i gela; 4) lepkość koloidalnych rozczynów i zależna od tego skłonność tych dyspersyj do przybierania określonej formy; 5) niezdolność koloidów do osmozy.
Wszystkie te właściwości są bardzo niestałe i łatwo zmieniają się pod wpływem zarówno fizycznych jak chemicznych czynników, do których przedewszystkiem należą pewne obce substancje. Koloidalne rozczyny ulegają sui generis zatruciom w niemniej typowych formach niż istoty żywe.
Zjawiska zależne od wielkości energji powierzchniowej polegają na tem, że na granicy pomiędzy dwiema stykającemi się fazami, cząsteczki każdej z tych faz znajdują się z jednej strony pod wpływem cząsteczek swojej własnej fazy, a z drugiej — cząsteczek fazy obcej. Wpływ ten powoduje inny stopień przyciągania pomiędzy cząsteczkami jednej i tej samej i różnych faz, mniejszy albo większy, zależnie od warunków.
Wynikiem tego jest powierzchniowe napięcie, dzięki któremu każda z tych faz dąży do tworzenia jak najmniejszej powierzchni. Dlatego każda kropla płynu znajdująca się w otoczeniu innego płynu lub gazu, przybiera postać kulistą, mającą dla danej objętości powierzchnię najmniejszą. Na tem też polegają tak ważne dla wielu procesów fizjologicznych zjawiska rozpowszechniania płynów na powierzchni ciał stałych.
W płynach, których dyspersja dosięgła już granicy cząsteczki, zjawiska napięcia powierzchniowego mogą powstać tylko w miejscu zetknięcia się tego płynu ze ścianami naczynia i z powietrzem, w rozczynach zaś koloidalnych miejscem takiem jest powierzchnia każdej dyspersowanej cząsteczki.
Równoważne sił napięcia powierzchniowego są skierowane prostopadle do powierzchniowej warstewki kropli rozczynu i dlatego powierzchniowe napięcie takich koloidalnych rozczynów jest bardzo nieznaczne; wskutek tego gele dążą do wytworzenia kłaczków, sole do tworzenia kropel znacznej wielkości. Skutkiem tego powstają też trwałe zmiany właściwości rozczynów koloidalnych, których dyspersowane cząsteczki dążą do skupienia się na powierzchni i do tworzenia warstw różnej koncentracji, skąd powstaje zdolność koloidalnych rozczynów do samorzutnego stężenia się.
Stopień dyspersji faz nie jest bynajmniej czemś stałem i waha się od stanu prawdziwych emulsyj i suspensyj do stanu rozczynów bliskich dyspersji molekularnej.
Wogóle rozróżniamy następujące odmiany jako stopnie dyspersji.
1) Cząsteczki, które można zauważyć w badaniu mikroskopowem; najmniejsza średnica ich nie zniża się ponad 0,1 μ (0.0001 mm). Cząsteczki takie mogą być oddzielone od dyspersującej fazy zapomocą zwykłego sączenia przez papier. Napotykamy je w zwykłych suspensjach i emulsjach. Nazywają je mikronami.
2) Cząsteczki mniejsze, aż do 0,6 μμ (0.0000006 mm), można zauważyć tylko zapomocą badania ultramikroskopowego. Przechodzą one łatwo przez najlepszy papier do filtrowania, lecz mogą być oddzielone od fazy dyspersującej zapomocą specjalnych ultrafiltrów z żelatyny lub kolodium, w zwykłych warunkach nie mogą one przejść przez błonkę dializatora. Nazwano je ultra-mikronami. Stanowią one typową cechę rozczynów koloidalnych. Każda taka cząsteczka zawiera kilka molekuł substancji dyspersowanej, a w razie emulsoidów, może się do nich przyłączyć (przez adsorpcję) jeszcze pewna ilość molekuł rozczynnika (tak zwane lyofilne koloidy), tworząc złożoną cząsteczkę jakby rozczynu o innej koncentracji. W taki sposób rozczyn staje się optycznie jednolitym, co jest zasadniczą cechą tego rodzaju koloidów.
3) Cząsteczki mniejsze od 0.6 μμ są zupełnie niewidzialne i nazywają się amikronami. W tych granicach około 1 μμ wahają się średnice molekuł przeważającej części związków chemicznych — skrobia 5 μμ, chlorofrom 0,8 μμ, woda 0,1 μμ. W rzeczywistości nawet prawdopobnie molekularne rozczyny ciał, złożonych z bardzo dużych molekuł, podobnych np. do skrobi, mają już własności koloidalne.
Miarą stopnia dyspersji jest wzrost powierzchni cząsteczek zależnie od ich rozmiarów i stosownie do pierwotnej objętości, którą uznano za jednostkę. Tak z sześciana o boku 1 cm, mającego 6,0 cm2 powierzchni, otrzymamy przy rozdzieleniu go na sześciany o bokach po 1 mm 1000 cząsteczek z powierzchnią 6.103 cm2. Ta powierzchnia cząsteczek powstałych z 1 cm3 dyspersowanej substancji jest dla suspensyj i emulsyj większa od 6.105 cm2, dla koloidów większa od 6.107 cm2. Wyżej tej granicy leżą już cząsteczkowe rozczyny. Koloidalne własności rozczynu znikają, poczynając od stopnia dyspersowania, w którym cząsteczki dyspersowanej fazy tworzą z cząsteczkami fazy dyspersującej jedyny system sił przyciągających i odpychających, a nie dwa różne systemy, jak to bywa w razie istnienia dwóch faz. Więc w prawdziwym rozczynie fazy nie istnieją i dlatego jest on jednostajny.
Określenie stopnia napięcia powierzchniowego wykonywa się przez porównanie wysokości, do której może podnieść się w pewnej określonej rurce włoskowatej (kapilarnej) odpowiednio dany rozczyn i woda (t. zw. kapilarymetrja), albo przez zliczanie ilości kropli powstałych z danej objętości płynu w porównaniu z ilością powstałych z tejże objętości kropel wody. Stosunek pomiędzy ilościami, pomnożony przez ciężar gatunkowy danego płynu i przez 100 jest współczynnikiem powierzchniowego napięcia. Sposób ten nazywamy stalagmometrją (σταλαγμος — kropla). Domieszka jakiejkolwiek substancji do danego rozczynnika zawsze zmienia jego współczynnik napięcia powierzchniowego, zależnie od swoich specyficznych własności. Tak np.: sole nieorganiczne zawarte w nim podnoszą ten współczynnik; cukier lub suspensoidy mają wpływ bardzo nieznaczny; mydła, sole kwasów żółciowych i wogóle wszystkie emulsoidy, przedewszystkiem białka, wywołują znaczne jego obniżenie.
Płyny mające nieznaczny stopień napięcia powierzchniowego łatwo tworzą, przy zmieszaniu z innemi substancjami, piany. W takich pianach (a piana stanowi normalny stan, w którym zazwyczaj przebywa masa protoplazmy), powierzchnia zetknięcia się wchodzących w nie płynów (faz) jest w znacznym stopniu zwiększona i wielkość jej ulega ciągłym zmianom.
Ponieważ zmniejszenie tej powierzchni jest źródłem energji, a wzrastanie pochłania pewną jej ilość — zmiany takie nie są obojętne dla ogólnej przemiany energji w organizmie, z czego wynika, że każda obca substancja, zmieniając stopień napięcia powierzchniowego już przez to samo działa na organizm.
Rozpuszczone w płynach organizmu obce substancje nie pozostają na zawsze w tych płynach. Muszą one stawać się po pewnym czasie składnikami komórek i dlatego muszą być przez nie pochłonięte. Tego rodzaju pochłanianie, prowadzące do powstawania niestałego fizycznego połączenia dwu substancyj nazywamy adsorpcją. Adsorpcja jest oczywiście odczynem powierzchniowym, umiejscowionym na granicy dwu różnych faz i dlatego jest typową właściwością stanu koloidalnego.
Zależnie od charakteru danej fazy, może ona być dodatnia, albo ujemna, to jest faza dyspersowana może w jednym wypadku zabierać i nagromadzać obcą substancję, w drugim zaś oddawać ją. Wszystkie substancje obniżające napięcie powierzchniowe bywają adsorbowane w znaczeniu dodatniem i same są dobremi środkami adsorbującemi. W takich wypadkach rozpuszczona substancja koncentruje się na powierzchni dyspersowanej fazy. (Prawo Gibbs-Thomsona).
Dlatego też zdolność danej fazy do adsorbowania jest zależna od wielkości powierzchni adsorbującej, więc od stopnia dyspersji. Stosownie do tego uważamy zjawisko adsorpcji za jedną z najważniejszych cech koloidalnego stanu materji. Zdolność danej substancji do adsorbowania jest z pewnego punktu widzenia mniej więcej niezależna od chemicznych właściwości substancji adsorbującej. Zdolność ta jest jednak specyficzna dla każdej z substancyj adsorbujących stosownie do każdej adsorbowanej, czemu realny wyraz daje istnienie pewnego współczynnika adsorpcji, który jest liczbą stałą dla każdej z takich kombinacyj, analogicznie do współczynnika rozdzielania ciał pomiędzy różnemi fazami mieszanin wielofazowych. Współczynnik ten jest zasadniczo stosunkiem pomiędzy nagromadzeniem substancji na powierzchni fazy adsorbującej, a zmniejszeniem jej stężenia w rozczynniku.
Adsorpcja może istnieć między gazami a ciałami stałemi (proszkami), gazami a płynami, płynami a płynami, i skutkiem jej może być zupełne usunięcie tego lub innego składnika z otoczenia, nawet powstanie absolutnej próżni.
Tak naprzykład, aktywowany węgiel adsorbuje gazy z taką siłą, że jest używany do wytwarzania absolutnej próżni w naczyniach dewarowskich lub rurkach Roentgena.
Istnienie zjawisk adsorpcji, powodując nagromadzanie się danej substancji na powierzchni rozczynnika, nadaje pewnym rozczynnikom szereg poważnych cech. Na tem zjawisku polega naprzykład powstawanie trwałych i stałych pian i błonek na powierzchni rozczynów białka, fermentów, barwników. Zjawiska barwienia ciał stałych i odbarwiania płynów, czynność czerni platynowej i proszku paladu są ważne dla wyrobu masek ochronnych, właściwości węgla aktywowanego i t. d. Tłumaczą one również losy pewnych obcych substancyj w ciele. Substancje takie mogą, po pierwsze, adsorbować pewne składniki organizmu, a po drugie, mogą same być adsorbowane przez organizm, niezależnie od jakichkolwiek bądź zmian chemicznych, działając więc w tym sensie, jak np. rozpuszczalne w tłuszczach narkotyki w stosunku do lipoidów komórki. Dalsze losy adsorbowanej substancji są bardzo rozmaite. Może ona pozostać niezmienną, może też zmienić swoje właściwości fizyczne. (I tak np.: adsorbowane białka zwykle podlegają strąceniu). Może wreszcie stać się źródłem reakcyj chemicznych jak np. utlenianie, powstające pod wpływem czerni platynowej. Taka zmiana warunków chemicznych odczynów w organizmie jest istotną treścią działania koloidalnych rozczynów metalowych, przedewszystkiem zaś koloidalnego srebra czyli kollargolu.
Każdy rozczyn koloidalny może składać się z zupełnie dowolnych ilości zasadniczych faz. Wskutek tego może on mieć bardzo różne konsystencje, rozpoczynając od konsystencji zupełnie ruchliwej cieczy, aż od stanu galarety, albo nawet ciała twardego, jak ebonit. Niezależnie od tego pewne warunki wywołują w takich rozczynach zasadnicze zmiany właściwości, jak np. ponowne rozdzielenie się faz i powstanie osadu, w stanie proszku lub kłaczków. Takiemi warunkami mogą być zmiany koncentracji elektrolitów w fazie dyspersującej, podniesienie temperatury, działanie pewnych zaczynów i t. d. Dopóki mamy do czynienia z prawidłowo dyspersowanemi fazami, mówimy o koloidalnych solach, z chwilą, gdy powstanie rozdzielenie faz, przetwarzają się one w gele. Proces ten może być zarówno odwracalny jak i nieodwracalny. Rozczyn białka strącony przez ogrzewanie, w żaden sposób nie może powrócić do stanu początkowego, lecz tenże rozczyn strącony przez dodanie siarczanu amonu odzyskuje znowu swoje właściwości po dodaniu dostatecznej ilości wody. Powstały osad albo jest zupełnie pozbawiony zawartości rozczynnika, jak to obserwujemy zwykle w strącaniu suspensoidów (lyofobne koloidy) lub zawiera ten rozczynnik w pewnych ilościach, co jest znów charakterystyczną cechą emulsoidów (lyofilne koloidy).
Takie zmienione w swoich własnościach dyspersowane fazy koloidów nazywamy gelami. Nieodwracalne zmiany właściwości rozczynu koloidalnego nazywamy jego denaturacją.
Takiego rodzaju denaturacje, wytwarzające najczęściej bardzo dogodne warunki dla działania zaczynów są bardzo pospolitemi skutkami działania licznych obcych substancyj.
Jak już mówiliśmy, właściwości rozczynu koloidalnego zmieniają się zależnie od koncentracji fazy dyspersowanej. Mianowicie rozczyn ten przybiera w pewnej mierze cechy ciała stałego. Stosownie do powiększenia koncentracji wzrasta i wewnętrzne tarcie rozczynu, zdolność jego cząsteczek do wzajemnego przyciągania się, jak również do czepiania się ścian naczynia, co jest przyczyną wzmagającej się kleistości.
Właściwości rozczynów koloidalnych są zależne od stosunków ilościowych pomiędzy fazami i od stopnia dyspersji, szczególnie jeżeli chodzi o emulsoidy.
Przez emulgowanie płynnego oleju z wodą zawierającą ślady mydła, lub białka, otrzymujemy z początku zupełnie ruchomy płyn. Przez podniesienie stosunku oleju do wody lepkość płynu wzrasta aż do powstania gęstej maści podobnej do galarety.
Jeszcze znaczniejsza zawartość oleju znów powoduje rozcieńczanie. Mikroskopowe badanie takiej emulsji wskazuje, że lepkość płynu wzrasta dopóty, dopóki fazą dyspersowaną jest olej. W odpowiednim momencie olej staje się dyspersującą fazą i lepkość spada stosownie do zmniejszenia zawartości wody.
Podobne zjawisko daje się obserwować również w wypadku zastygnięcia rozczynu żelatyny w mieszaninie wody i alkoholu. Z początku mamy kropelki gęstszego rozczynu żelatyny otoczone płynem. Podczas obniżenia temperatury liczba tych kropelek wzrasta, następnie poczynają one wytwarzać strukturę podobną do siatki, dalej zaś do plastra miodu, lub do piany, płyn okazuje się już substancją wypełniającą pozostałe pomiędzy ściankami piany przestrzenie.
Zatem i w tym wypadku mamy przetworzenie się fazy dyspersującej w dyspersowaną.
Prawdopodobne jest, że każda galareta, która w badaniu mikroskopowem wydaje się być homogenną (jak np. galareta z żelatyny i wody), posiada analogiczne właściwości i powstawanie jej z płynu istotnie polega na tem, że fazy dyspersująca i dyspersowana zamieniają wzajemnie role, przechodząc jedna w drugą.
Równolegle z tem wzrasta też zdolność do adsorbowania fazy dyspersującej i zależne od tego powiększenie objętości galarety wskutek tej fazy. Zmiany te są źródłem dwóch, poważnych z punktu widzenia fizjologicznego właściwości koloidów, szczególnie emulsoidów — powodują ich lepkość i zdolność do pęcznienia.
Ponieważ prawie wszystkie płyny organizmu są rozczynami koloidalnemi, a tkanki także są koloidami, dwie te właściwości są zasadniczemi warunkami zarówno dla ruchliwości tych płynów w ciele, jak dla rozdzielenia wody w organizmie. Lepkość można określić jako stopień oporu, jaki przedstawia dany płyn przy przetłaczaniu go przez cienkie rurki. Opór ten jest tem większy, im więcej skoncentrowany jest rozczyn koloidalny, prócz tego zależy on również od zawartości w rozczynie innych substancyj. Stopień lepkości określamy przez porównanie z lepkością czystej fazy dyspersowanej, a więc dla płynów fizjologicznych — wody. Znikoma domieszka hydrofilnych koloidów, (np. białka), podnosi jej lepkość w bardzo już znacznym stopniu.
Pęcznienie koloidów jest skutkiem ich zdolności do zwiększania obecnej w nich zawartości wody w odpowiednich warunkach i powiększania przez to swej objętości. Siła, z którą takie koloidy powiększają swą objętość, jest olbrzymia, dosięga ona w pewnych wypadkach setek atmosfer. Woda zawarta w organizmie utrzymuje się tam przedewszystkiem dzięki tej właściwości i dlatego nawet w bezwzględnie suchem powietrzu zwierzę traci wodę swych tkanek tylko bardzo powoli. Tak np. w jednem z doświadczeń żaba, znajdująca się w powietrzu absolutnie suchem, straciła na wadze 20%, gdy zawartość wody w jej krwi spadła o 50%, więc tkanki straciły tylko 21% wody. Zwierzę ginie od anhydremji, zanim nastąpi znaczniejsza suchość tkanek.
Zarówno lepkość jak i zdolność do pęcznienia są w dużym stopniu zależne od obecności w otaczającem płynie pewnych składników. Wogóle obecność kwasów, jak również i zasad podnosi ilość wody, adsorbowanej przez koloidy, powiększając jednocześnie lepkość rozczynu.
Sole częściowo powiększają stopień adsorpcji wody w obojętnej reakcji, przy kwaśnej albo zasadowej zazwyczaj obniżają ją, lub nawet wywołują odpęcznienie, czyli utratę wody przez koloid. Najmocniejszemi odczynnikami odpęcznienia są cytryniany i winiany pierwiastków dwuwartościowych, najsłabszemi — chlorki sodu i potasu.
Ze zjawiskami adsorpcji łączą się w organizmie liczne zjawiska katalizy. Katalizatorami nazywamy substancje przyspieszające przebieg pewnego odczynu, lub nawet umożliwiające jego wykonanie w warunkach niezwykłych, nie biorąc jednak czynnego udziału (przynajmniej pozornie) w tym odczynie i pozostające wskutek tego bez żadnych zasadniczych zmian po ukończeniu reakcji. Rolę takich katalizatorów w odczynach pomiędzy ciałami nieorganicznemi odgrywać mogą nawet pewne pierwiastki, mianowicie węgiel i metale platynowe (platyna, irid, palad), jak również magnez, nikiel, mangan i żelazo.
W organizmie rolę katalizatorów odgrywają przeważnie tak zwane enzymy, czyli zaczyny lub fermenty. Znaczenie niektórych pierwiastków mianowicie żelaza i manganu, jako katalizatorów nieorganicznych, biorących udział w procesach utleniania, nie jest jeszcze wyjaśnione w stopniu dostatecznym, jak również możliwe działanie katalityczne pewnych pierwiastków jadowitych, jak np. fosforu. Dlatego w badaniach toksykologicznych większe znaczenie posiadają zmiany działania własnych zaczynów ustroju, zależne od wpływów niektórych obcych substancyj. Niemniej ciekawe jest działanie na organizm obcych dla niego zaczynów lub substancyj do nich podobnych z właściwości swoich. Substancjami tego rodzaju są toksyny bakteryjne, wytwarzane przez drobnoustroje narówni z właściwemi zaczynami, oraz pewne substancje zawarte w truciznach pochodzenia zwierzęcego. Zasadniczemi cechami zaczynów są: 1) ich nietrwałość chemiczna — żaden zaczyn nie wytrzymuje gotowania i działania silnych odczynników chemicznych; 2) ich swoistość — każdy zaczyn jest ściśle przystosowany zwykle do wykonywania jednego tylko odczynu; 3) bardzo złożona budowa chemiczna, wskutek czego dotąd żaden zaczyn nie mógł być otrzymany w stanie czystym; 4) zdolność wywoływania odczynów odwracalnych, charakteryzujących się stanem pewnej równowagi, którą one osiągają. Zależnie od warunków, ten sam zaczyn może wywołać zarówno utlenienie, jak i odtlenienie, zarówno rozkład jak i syntezę estru i innych złożonych cząsteczek; 5) powstawanie wyłącznie tylko w warunkach odczynów komórki żywej, zwierzęcej lub roślinnej. Żaden zaczyn nie był jeszcze otrzymany sztucznie.
Istnieje nawet hypoteza, że zaczyny w rzeczywistości nie są określonemi substancjami, lecz raczej pewnemi właściwościami niektórych koloidów — mianowicie białka, lub nukleoproteidów.
Zaczyny bywają czasami tak dalece trwałe, że mogą działać jeszcze po wydobyciu się nazewnątrz z komórki, z której powstały, np. zaczyny trawienne; częściej jednak są to substancje bardzo niestałe, czynne tylko wewnątrz swych macierzystych komórek, i dające się oddzielić tylko w wyjątkowych warunkach. Takim wewnątrzkomórkowym zaczynem jest np. zymaza Buchnera, enzyma fermentacji alkoholowej. Celem otrzymania tego enzymu sok drożdży, roztartych z piaskiem, przetłaczano prasą hydrauliczną o ciśnieniu kilkuset atmosfer, przez odpowiedni filtr.
Zewnątrzkomórkowe zaczyny zwykle są wydzielane w stanie tak zwanych zymogenów, lub profermentów, z których powstają zaczyny czynne pod wpływem nowych aktywatorów, lub kinaz, mających też właściwości zaczynów.
Z drugiej strony zaczyny są tak zwanemi antygenami i powtórne wprowadzenie ich do ustroju obcego wywołuje powstawanie antyfermentów — substancyj, które paraliżują ich czynność.
Prawie wszystkie odczyny chemiczne w ustroju odbywają się przy udziale takich zaczynów, czyli katalizatorów organicznych. Same zaczyny w czasie tych odczynów pozostają pozornie nietknięte. Stężenie ich wpływa przyspieszająco na przebieg reakcji.
Jako substancje koloidalne zaczyny posiadają właściwości adsorbujące, jak również same mogą łatwo ulegać adsorpcji, (nawet przez proszek węgla lub drobne nieorganiczne osady jak np. osad fosforanu wapnia). Dlatego też wszystkie warunki zmieniające przebieg adsorpcji wpływają na reakcje fermentacyjne. Zwracamy uwagę, że i wśród katalizatorów nieorganicznych stopień dyspersji, która wpływa przedewszystkiem na wielkość powierzchni czynnych, odgrywa w większości wypadków (węgiel, platyna, palad) zasadniczą rolę.
Zaczyny, stosownie do wywoływanych przez nie odczynów, dzielimy na cztery grupy.
I. Oksydazy (reduktazy) — zaczyny utleniania.
II. Hydrolazy (dehydrolazy) — zaczyny wywołujące lub hamujące hydrolizę.
III. Zymazy — zaczyny złożonych procesów fermentacyjnych, zależnych od czynności drobnoustrojów.
IV. Zaczyny syntezujące mało jeszcze znane.
Co do stosunku pomiędzy czynnościami zaczynów a losami obcych substancyj w ustroju, to najważniejsze odczyny chemiczne wykonywane w komórce, są zasadniczo wynikiem działalności pewnych zaczynów i każde odchylenie tych odczynów od równowagi może mieć jak najbardziej niebezpieczne następstwa.
Już dla katalizatorów nieorganicznych znane są substancje, które mogą paraliżować ich działanie. Nierównie wyraźniejsze obniżenie czynności zaczynów i nawet zupełny jej zanik mogą wywołać bardzo liczne substancje, jak np. kwas pruski. Z drugiej strony istnieją również substancje, które w znikomo małych ilościach potęgują w wysokim stopniu czynność pewnych zaczynów: tak np. fluor w minimalnych dawkach podnosi czynność zymazy, zaczynu wywołującego rozkład cukru z powstawaniem alkoholu i CO2.
Jest rzeczą oczywistą, że tego rodzaju trucizny zaczynów, jak również ich aktywatory, muszą wywoływać daleko idące zmiany w przebiegu życiowych odczynów organizmu. Prawdopodobnie wpływ tych substancyj na czynność zaczynów wewnątrzkomórkowych stanowi rzeczywistą podstawę cząsteczkowego działania trucizn, jak również zjawisk oligodynamicznych.
Prócz tego, same zaczyny i podobne do nich substancje mogą odgrywać rolę trucizn. Przedewszystkiem każdy zaczyn, nawet taki, który jest normalnym składnikiem danego ustroju, wprowadzony bezpośrednio do krwi, wywołuje cały szereg odczynów ogólnych, zależnie od swych właściwości antigennych. Takiemi odczynami są: obrzęk i zapalenie w miejscu zastrzyku, toksyczny rozkład białka i podniesienie się ciepłoty ciała. Miejscowościowe odczyny dla pewnych zaczynów mogą być wyjątkowo silne (tak zw. flogoziny). Prócz tego, niektóre zaczyny działają swoiście na pewne rodzaje komórek, zabijając i rozpuszczając je częściowo lub całkowicie. Odczyny tego rodzaju nazywamy cytocidnemi, lub cytolitycznemi (zabijającemi i rozpuszczającemi komórki). Tak naprzykład, jad żmii zawiera mieszaninę flogozynów, hemolizynów, hemorrhaginów i najmocniejszych neurocidynów, t. j. zaczynów wywołujących zapalenia, krwotoki, rozpuszczanie się czerwonych krwinek i wreszcie porażenie układu nerwowego.
Zasadniczą cechą trującego działania zaczynów jest wyraźny okres wylęgania, co świadczy o katalitycznem ich działaniu. Treścią tego działania jest przyspieszenie odczynu, czyli zwiększenie nasilenia. To też powiększenie dawki nie tyle zmienia siłę i właściwości odczynu, ile zmniejsza czas wylęgania, a po przekroczeniu pewnej granicy staje się zupełnie obojętnem, nie może bowiem podnieść czynności zaczynu ponad pewne maksymum.
Do działań cząsteczkowych, niezależnych od rozkładu chemicznego trującej substancji, musimy dołączyć niektóre bardzo zagadkowe zjawiska, których przyczyną jest obecność pewnych związków o niezwykłych swoistych właściwościach. Pewne substancje, szczególniej te, które posiadają zdolność do tak zw. fluorescencji, nie będąc z natury swej jadowitemi i zupełnie obojętnemi dla istot, znajdujących się w ciemnym pokoju, stają się bardzo jadowitemi w obecności światła, a zwłaszcza światła obfitującego w promienie czynne chemicznie (o krótkich falach). Działanie to występuje przedewszystkiem w postaci zapalenia skóry, przeważnie na słabo zabarwionych miejscach, lub u osobników z mało rozwiniętym barwnikiem skórnym (blondyni, albinosi). W dalszym ciągu dołączają się do tego także zmiany we krwi i innych tkankach. Skutkiem takiego zatrucia u małych zwierząt (jak np. u myszy) może być nawet śmierć. Zjawiska te nazwano fotoaktywnemi. Tłumaczono je jako zdolność tych ciał do przetwarzania długich fal świetlnych w krótkie. Barwniki najlepiej zbadane, jak eozyna i fluoresceina są prawie całkiem wydzielane z moczem.
Jeszcze mniej znanemi i trudnemi do wytłumaczenia są właściwości promieniotwórcze, dotychczas rozpatrywane jako specjalne cechy niewielu tylko pierwiastków. Obecnie ustalono je u całego szeregu ciał. Możliwem jest np., że zasadnicza różnica w działaniu toksycznem pierwiastków tak podobnych do siebie pod względem chemicznym jak potas i sód, bar i stront oraz znana wyjątkowa jadowitość uranu, są wynikiem promieniotwórczości niektórych z tych pierwiastków.
Przejściowe miejsce między substancjami o działaniu cząsteczkowem i substancjami rozkładającemi się w organizmie zajmują substancje zdolne do jonizacji. Już z powodu procesu dyspersji powiedzieliśmy, że w rozczynach wodnych pewne związki mineralne, kwasy, ługi i sole, również niektóre związki organiczne, jak kwasy, zasady i sole organiczne, rozkładają się na dwie części, posiadające przeciwległy ładunek elektryczny.
Ten rozkład uwidocznia się przez przepuszczanie prądu elektrycznego, który pociąga za sobą pewne cząsteczki materii, przenoszące ładunek dodatni do ujemnego bieguna i ładunek ujemny do dodatniego. Zowiemy je jonami, rozróżniając katjony, spływające z biegiem prądu i naładowane dodatnio, i anjony, dążące przeciw prądowi i unoszące nabój ujemny.
Po wyładowaniu na elektrodach jony stają się cząstkami chemicznie czynnemi, zależnie od swej natury i składu środowiska; łączą się w cząsteczki różnych związków chemicznych, np. jony wody dają wkońcu wodór H2 i tlen O2, wodny rozczyn siarczanu miedzi, miedź Cu2, kwas siarkowy H2SO4 i tlen O2, i t. d.
W rozczynach elektrolitów stopień jonizacji zależy od rozcieńczenia. Stopień rozkładu nazywamy stopniem dysocjacji elektrolitycznej. Rozróżniamy związki ze znacznym stopniem dysocjacji, jak np. kwas solny i z bardzo małym — jak np. kwas octowy. Rozkład na jony nie odpowiada wzorom istniejących związków. W stanie jonów mogą istnieć połączenia zupełnie niezdolne do samodzielnego istnienia. Tak np. rozpatrywany z punktu widzenia chemicznego kwas siarkowy jest H2O + SO3, zaś elektrolitycznie rozpada się on na jony H + H + SO4.
Jako skutek jonizacji mamy przedewszystkiem nienormalny przyrost ciśnienia osmotycznego rozczynów.
Ciśnienie osmotyczne rozczynu cząsteczkowego zależy tylko od jego stężenia cząsteczkowego PM V, gdzie M jest ciężarem cząsteczkowem, P ilością rozpuszczonej substancji i V ilością litrów rozczynnika.
Przy dodawaniu wody ciśnienie osmotyczne będzie zmniejszało się proporcjonalnie do wzrostu objętości. W razie rozczynu zjonizowanego wzór ten zmieni się w tym sensie, że ilość cząsteczek zawartych w każdym litrze rozczynu będzie wzrastała zależnie od stopnia jonizacji, czyli, że będzie tem większa, im bardziej rozcieńczonym okaże się rozczyn. Przy nieskończenie dużem rozcieńczeniu wszystkie cząsteczki rozpadają się na jony, wobec czego w wypadku gdy cząsteczka daje dwa jony, koncentracja zamiast PMV stanie się 2PMV, więc i ciśnienie będzie dwa razy większe od obliczonego teoretycznie.
Dlatego w obecności składników zdolnych do jonizacji, jak to ma miejsce we wszystkich płynach ustroju, ciśnienie osmotyczne nie da się obliczyć z prostej kalkulacji stężenia cząsteczkowego, ponieważ nawet stopień jonizacji tych roztworów różni się od teoretycznego, zależnie od równoczesnych złożonych odczynów chemicznych w komórkach.
Drugim skutkiem jonizacji jest niestałość równowagi odczynów w płynach ustroju. Jak wiadomo, odróżniamy odczyny kwaśne, obojętne i zasadowe, przeważnie zapomocą zabarwienia papieru lakmusowego.
Z punktu widzenia teorji jonizacji odczyn kwaśny zależny jest od obecności jonów , zaś zasadowy od jonów — równowaga tych dwóch czynników daje odczyn obojętny. Nadmiar tych lub innych jonów może być określony w sposób elektrometryczny, lub przez miareczkowanie, z użyciem szeregu wskaźników różnej czułości. Nawet absolutnie czysta woda jest w nieznacznym stopniu zjonizowana. Stopień jej jonizacji (zawartość jonów H’), równa się 0,8.10−7 jonów na litr. Oczywiście, że woda zawiera jednocześnie i takąż samą ilość jonów , gdyż jest ciałem obojętnem. W temperaturze (18°C) iloczyn zawartości jonów H’ i OH’ jest wielkością stałą, równą ((0,8.107)2 = 0,64.10−14).
Liczba ta, podzielona przez zawartość jednego z jonów daje zawartość drugiego dla każdego rozczynu wodnego. Kwasowość odczynu określamy zwykle przez zawartość jonów H’. Jeżeli zawartość ta jest większa od 0,8.10−7 mamy odczyn kwaśny — jeżeli zaś jest mniejsza, zasadowy. Dla oznaczenia zawartości jonów wodoru stosuje się zwykle metodę Sörensen’a polegającą na tem, że zamiast skomplikowanej formuły a.10−n, używa się jej logarytmu ujemnego i nie zaznaczając znaku ujemnego pisze się poprostu PH = n − lga. Tak więc np. PH dla czystej wody będzie 7,097. Normalny rozczyn kwasu zawierający 1 molekułę H na litr ma PH = 3,347.
Oczywiście trzeba pamiętać, że mniejsze liczby PH odpowiadają mocniejszym stężeniom jonów wodoru i odwrotnie.
Ponieważ zdolność koloidów, więc i składników żywych komórek do absorbowania nie jest jednakowa dla jonów H’ i OH’, przeto w organizmie mogą łatwo powstać nadmiary tych lub innych jonów, przeważnie jednak jonów wodoru. Dlatego odczyn płynów organicznych nie bywa nigdy ściśle obojętny. Tak np. dla zasadniczych płynów organizmu mamy następujące wahania (według Schade’ego).
| Stężenie jonów wodoru | PH | ||
| Sok żołądkowy | max. | 6.10−2 | 1,222 |
| min. | 2.10−9 | 4,699 | |
| Mocz | max. | 1.10−5 | 5,000 |
| min. | 1.10−9 | 7,000 | |
| norm. | 4.10−6 | 5,398 | |
| Krew | max. | 8.10−8 | 7,155 |
| norm. | 3.10−8 | 7,51 | |
| min. | 1.10−8 | 8,000 | |
| Sok jelitowy | max. | 8.10−9 | 8,046 |
| min. | 2.10−9 | 8,699 | |
Z tego wywnioskować można, że nerki, a w mniejszym stopniu śluzówka żołądka (kwaśne składniki soku żołądkowego podlegają ponownej resorpcji i zobojętnieniu w jelitach) są narządami podtrzymującemi w odpowiednim stopniu kwasowość płynów organizmu. Do tego trzeba dodać, że odczyn krwi zależy w dużym stopniu od zawartości kwasu węglowego w stanie jonów — (HCO3’ + H’) = CO2 + H2O, a przez usunięcie ze krwi CO2 prądem powietrza zawartość jonów H’ znacznie się obniża — z PH 7,09 do 8,2. Zjawisko to ma szczególne znaczenie w każdem zatruciu kwasami czyli w tak zw. acydozie, gdyż CO2 podnosi kwasowość krwi. Wobec tego płuca są narzędziem regulacji odczynu krwi[3].
Poza tem znaczenie stężenia jonów H’ polega na działaniu ich na koloidy. Wiadomem jest, że stałość rozczynów koloidalnych, ich lepkość, działanie absorpcyjne i zdolność do pęcznienia zależne są wogóle od jakości i ilości obecnych jonów, a przedewszystkiem od jonów H’.
Wreszcie trzeba podkreślić, że wogóle charakter odczynu w organizmie zależnym jest przy działaniu związków mineralnych od stężenia jonów i że rola rozmaitych soli w organizmie uzależniona jest przedewszystkiem od obecności odpowiednich anjonów, gdy katjony są mniej więcej równoznaczne.
Najważniejszemi zmianami, jakim w ustroju podlegać mogą substancje obce jak również trucizny, są zmiany chemiczne. Omówione wyżej różne rodzaje działania cząsteczkowego stanowią raczej wyjątki. Wyjaśnienie losów obcej substancji w organizmie można uzyskać tylko drogą poznania przebiegu zmian chemicznych, którym ulega.
Przemiany chemiczne, zachodzące w ustroju, są mniej więcej jednakowe dla wszystkich związków, które mogą rozkładać się lub brać udział w procesach syntetycznych, pod tym względem środki spożywcze zasadniczo w niczem nie różnią się od trucizn.
Do najważniejszych chemicznych odczynów w organizmie należą.
1. Zjawiska utleniania przez tlen oksyhemoglobiny, a w pewnych wypadkach również i kosztem redukcji innych substancyj.
2. Odtlenianie czyli redukcja, odczyn przebiegający zazwyczaj równolegle z poprzednim.
3. Hydroliza, lub zmydlenie — rozszczepienie cząsteczki wskutek powiązania z nią jonów wody (H’) i (OH’).
4. Odszczepienie wody przez połączenie się dwóch cząsteczek w jedną lub tworzenie się doparków.
5. Dezamidacja, czyli odszczepienie grupy aminowej (zwykle w stanie NH3) wskutek dołączenia się wody do aminów.
6. Amidacja — odczyn odwrotny do poprzedniego.
7. Alkylowanie, czyli połączenie z rodnikami alkoholowemi, przeważnie z grupą metylową CH3.
8. Odszczepienie alkylów, czyli dezalkylacja.
9. Połączenie się z rodnikami kwasów mineralnych, przeważnie kwasu siarkowego, lub kwasów organicznych (np. glikuronowego).
10. Polymeryzacja, czyli połączenie kilku mniejszych, a przytem jednakowych, cząsteczek w jedną większą.
11. Rozszczepienie złożonych cząsteczek związków niestałych na kilka mniejszych ale stałych. Najpospolitszym przykładem tego odczynu w organizmie jest odszczepienie bezwodnika kwasu węglowego.
12. Wewnętrzne zmiany budowy cząsteczki, wskutek czego powstaje przetworzenie mniej stałych związków w stalsze.
Wszystkie te odczyny były obserwowane tylko wyjątkowo w czystych pojedyńczych przejawach. Losy rozkładającej się w ciele substancji zwykle bywają mocno powikłane i składają się z szeregu odczynów, o których była wyżej mowa.
Jako przykład przytoczymy losy zasadniczych substancyj spożywczych, najlepiej i najdokładniej zbadanych.
Jako końcowy przetwór wszystkich węglowodanów tworzy się w ustroju glikogen. Podlega on hydrolizie, której wynikiem jest powstanie cukru gronowego:
Cukier gronowy podlega rozszczepieniu (Odczyn 11) na dwie cząsteczki aldehydu glicerynowego: COH−CHOH−CH2OH = C3H6O3. Z tego aldehydu bezpośrednio, wskutek wewnętrznych zmian budowy (Odczyn 12), albo przez odszczepienie (powstawanie metylglyoksalu COH−CO−CH2), a następnie przez ponowne dołączenie się wody, wytwarza się kwas mlekowy, jako związek stalszy COH−CHOH−CH2OH = COOH−CH−OH−CH3. Kwas mlekowy w dalszym ciągu podlega równocześnie utlenianiu (Odczyn 1) i odszczepianiu wody, skąd powstaje kwas pirowinny CH3.CH(OH).COOH−H2O + O = COOH.CO.CH3. Kwas ten dalej rozszczepia się na CO2 i aldehyd octowy CH3COH, który wreszcie, również przez utlenienie, przechodzi w CO2 i H2O według wzoru CH3COH + 5O’ = 2CO2 + 2H2O.
Tłuszcze podlegają: 1° zmydleniu, a następnie utlenieniu, które dotyczy tak gliceryny, jak i samych kwasów tłuszczowych. 2° Ten ostatni odczyn ma przebieg następujący: z kwasu tłuszczowego CH3(CH2)n.CH2CO2H wytwarza się przez dołączenie O’ odpowiedni β-oksykwas CH3(CH2)n-l.CHOH.CH2CO2H. Kwas ten przez dołączenie O’ daje znów kwas tłuszczowy zawierający 2C mniej, niż poprzedni i łatwo utleniający się kwas octowy CH2CO2H.
Rozkład białek zaczyna się od stopniowej hydrolizy dobiegającej aż do pojedyńczych aminokwasów R. CH. CHNH2. CO2H. Aminokwasy odszczepiają CO2 i wytwarzają aminy R. CH2. CH2NH3 + CO2. Aminy przez hydrolizę przetwarzają się w odpowiednie alkohole i amoniak R−CH2−CH2NH2 + H2O = R.CH2CH2OH + NH3, zaś alkohole, podlegają łatwo utlenieniu. W innych wypadkach mamy redukcję (dołączenie H2) z jednoczesnem powstaniem zamiast CO2 kwasu mrówczanego H−CO2H, lub bezpośrednią hydrolizę aminokwasu z powstaniem oksykwasu, RCH2CH.OH. CO2H — albo też wreszcie przez jednoczesne utlenienie i dezamidację powstaje ketokwas RCH2CO−CO2H, i odwrotnie przez jednoczesną redukcję i dezamidację kwasów tłuszczowych RCH2CHNH2CO2H + H2 − NH3 = R.CH2CH2CO2H.
Najważniejsze źródło energij w ustroju zwierzęcym stanowią odczyny utleniania, przebiegające z udziałem jednego lub kilku atomów tego pierwiastka. Tlen jest najobfitszym składnikiem ustroju i znajduje się w nim przedewszystkiem w stanie stałych połączeń z innemi pierwiastkami, po drugie w stanie bardzo niestałego, bardzo łatwo podlegającego dysocjacji związku z barwnikiem krwi, oxyhemoglobiną — po trzecie w stanie wolnym, rozpuszszony w płynach organizmu, stosownie do ciśnienia cząsteczkowego O2 w otoczeniu, lub absorbowany przez pewne składniki organizmu i wreszcie odszczepiając się w stanie powstawania od związków mających właściwości nadtlenków lub powstając podczas innych reakcyj, jak naprzykład przez działanie chlorowców na wodę we krwi i tkankach:
2HOCl + Na2CO2 = 2NaCl + CO2 + H2O + O’.
Mocno utleniające środki, jak np. kwasy azotowy i chromowy wywołują natychmiastowe skrzepnięcie białka, jak to zresztą czynią wszystkie mocne kwasy, a także bromiany, jodany, nadmanganian i również natlenki, jak nadtlenek wodoru. Wywołują one też powstawanie methemeglobiny, i dlatego są niebezpiecznemi truciznami. A jednak, w porównaniu ze znacznemi ilościami tlenu obecnemi w organizmie, ilości zawarte w największych nawet możliwych dawkach tych trucizn są niewielkie. Co do losu substancyj zawierających nadmiar tlenu, to rozumie się, że podlegają one w ustroju redukcji. Wszakże należy podkreślić, że w wielu wypadkach, np. podczas bardzo wyraźnego działania chloranów, wydzielają się one z moczem w stanie prawie niezmienionym.
Szybkość i stopień utleniania zależą od natury samej substancji utlenianej, jak również od szeregu innych warunków, w których ten odczyn przebiega. Bywają substancje łatwo i trudno utleniające się. Łatwo utleniają się w organizmie takie związki jak alkohole lub kwasy organiczne, które na zewnątrz organizmu, w obojętnym odczynie i temperaturze 37°C, są niemal bezwzględnie stałemi związkami. Odczyn zasadowy może powiększyć znacznie zdolność do utleniania. Tak np. pyrogallol, dość stały w kwaśnych lub obojętnych rozczynach, jest typowym pochłaniaczem tlenu w reakcji zasadowej. Z alkoholu benzylowego w obecności węglanu sodu bardzo łatwo wytwarza się kwas benzoesowy, co stwierdzono również dla aldehydu salicylowego. Ponieważ równowaga pomiędzy jonami H’ i OH’ w ustroju jest bardzo niestała, więc też i wzmożenie się odczynów utleniania wskutek chwilowej przewagi jonów (OH) staje się zupełnie możliwe. W innych wypadkach dało się zauważyć, że przebieg utleniania bywa znacznie ułatwiony w obecności pewnych aktywatorów. Takiemi dla organizmu zwierząt mogą być żelazo i w wyjątkowych razach miedź, składniki barwników oddechowych; w pewnych jednak wypadkach rolę podobną odgrywa również mangan.
Warunki procesu utleniania w organizmie zmuszają nas do przypuszczania, że przebieg tej reakcji w ustroju jest inny niż w probówce (in vitro). Stosownie do tego, mamy cały szereg teoryj utleniania. Pierwszą próbą takiej teorji była teorja działania ozonu (Schönbein 1845), odrzucona następnie, okazało się bowiem, że ozon jest dość mocną trucizną komórkową, oprócz tego nie można go było w żaden sposób wykazać ani w organizmie zwierzęcym ani w roślinnym.
Drugą teorją jest teorja aktywacji podczas redukcji, czyli rozszczepiania nieczynnej molekuły O2 przez wodór w stanie powstawania, na dwa czynne atomy, z których jeden łączy się z wodorem i daje wodę, a drugi utlenia inne substancje. Powstanie wodoru i węglowodorów zachodzi w zjawiskach anaerobiozy. Tak np. podczas fermentacji masłowej, cukier gronowy rozkłada się w sposób następujący: C6H12O6 = C4H8O2 + 2CO2 + 4H. Autorem tej teorji jest Hoppe Seyler.
Trzecią teorję — teorję powstawania nadtlenków zaproponował Traube. Składa się ona z dwóch założeń: pierwsze, że łatwe do utlenienia substancje rozkładają wodę, tworząc jon hydroksylowy, wytwarzając jednocześnie czynny wodór; drugi, że ten czynny wodór łączy się z cząsteczkami tlenu, tworząc nadtlenek wodoru, będący właśnie czynnikiem utleniania.
| Mamy więc: | 1) R + 2H2O = R(OH2)2 + 2H’ 2) O2 + 2H’ = H2O2 |
W nieco innej formie przedstawia powstawanie nadtlenków teorja Englera. Według niej, na substancje łatwo utleniające się działa bezpośrednio tlen molekularny O=O, który przybierając postać −O−O− łączy dwie cząsteczki takich substancyj w nadtlenek R−O−O−R.
Obecnie powszechnie uznaną teorją utleniania w ustroju jest teorja utleniających zaczynów, czyli oksydaz.
Oksydazy, jak zresztą wszystkie zaczyny wogóle, należą do bardzo złożonych substancyj koloidalnych, wyrabianych przez komórki żywe; obfitują w nie przedewszystkiem komórki drobnoustrojów. Działanie oksydaz bywa w zasadzie swoiste, t. j. dla każdej substancji zdolnej do utleniania przez działanie zaczynów istnieje własna oksydaza, z reguły nieczynna w stosunku do innych. Z tego wynika, że teorja oksydaz stanowi raczej tylko częściowe wytłumaczenie odczynów utleniania. Pomimo tego jednak można wytłumaczyć w ten sposób istotnie znaczną ilość faktów ustalonych.
Obok różnego rodzaju oksydaz w procesach utleniania biorą udział i inne zaczyny, dotąd niedostatecznie zbadane. Są to tak zw. dehydrazy, czyli zaczyny powodujące odszczepienie od cząsteczki atomu wodoru i powstawanie w ten sposób związków nienasyconych; katalazy, zaczyny działające na nadtlenki z powstaniem wody, lub innych tlenków i cząsteczkowego tlenu O2, który pozostaje biernym; wreszcie peryksydazy wywołujące powstawanie nadtlenków.
Nazewnątrz ustroju odczyny odtleniania powstają w ten sposób, że pewna łatwo utleniająca się substancja pochłania tlen innego związku i w ten sposób równolegle z utlenieniem jednej powstaje odtlenienie innej substancji. Tak np., przepuszczając wodór przez ogrzany tlenek żelaza, Fe2O3, powodujemy redukcję tego tlenku aż do powstania żelaza metalowego, kosztem utlenienia wodoru do stanu wody: Fe2O3 + 3H2 = 3H2O + Fe2.
Zjawiska tego rodzaju są rozpowszechnione w ustroju, szczególnie o ile bierze się pod uwagę związki organiczne. Dlatego wydaje się, że tak pojmowane utlenienie może powstawać tak przez usunięcie z cząsteczki 2 atomów wodoru (odczyn tak zw. dehydrogenacji), jak przez dość powikłane współdziałanie cząsteczek tejże samej substancji, podczas którego jedna molekuła podlega redukcji kosztem utlenienia drugiej (znana reakcja Canizzaro).
Tak np. dla aldehydu octowego mamy:
| 1) CH3COH + H2O = CH3C. | OH OH=CH3. COOH + H2 H |
| 2) 2.C3COH + H2O = CH3COOH + CH3CH2OH | |
W tych złożonych reakcjach jednoczesnego utleniania i redukcji biorą udział oczywiście nietylko składniki ustroju, lecz i różne substancje obce. Dlatego niektóre trucizny zostają wydzielane z ustroju w stanie utlenionym, jak np. morfina, która wydziela się w stanie oksydwumorfiny, inne zaś podlegają redukcji, jak np. liczne barwniki i pochodne fenolów i wkońcu trzecie są całkiem spalane do stanu wody i kwasu węglowego, jak np. alkohol i niektóre kwasy organiczne.
Zjawiska hydrolizy rozpowszechnione są niemniej niż odczyny utleniania i redukcji. Zależnie od zdolności danego związku do dysocjacji mamy trzy zasadnicze stopnie tego odczynu. W pierwszym może wystarczyć dla hydrolizy już sama obecność wody, czyli taka ilość jonów H i OH, jaka zwykle znajduje się w czystej wodzie. W drugim potrzebna jest obecność pewnych katalizatorów lub zaczynów. W trzecim wreszcie hydroliza jest możliwa tylko w obecności mocnych kwasów lub ługów, t. j. tylko w znacznym nadmiarze jonów OH lub H i nawet tylko w dużem podniesieniu temperatury.
W organizmie mamy do czynienia prawie wyłącznie z przypadkiem drugim, dlatego też z punktu widzenia fizjologji hydroliza jest wyłącznie odczynem fermentacyjnym.
Istotnie mamy cały szereg zaczynów hydrolitycznych zarówno dla substancyj odżywczych, jak i wszelkich innych, a nawet dla trucizn.
Podobnie jak zaczyny wogóle, posiadają one wyraźne cechy swoistości. Nie znamy jednego ogólnego fermentu hydrolitycznego; raczej wręcz przeciwnie, mamy cały szereg najrozmaitszych swoistych zaczynów, bądźto dla pewnych kategoryj związków, np. węglowodanów (cukrów), białek, bądź też dla jakiegoś jednego związku, jak np. emulsyna do amigdaliny albo laktaza do laktozy.
Losy substancji zdolnej do hydrolizy są więc zależne od tego, czy znajdzie się w ustroju odpowiedni zaczyn. Tak np. amygdalina, trucizna zawarta w gorzkich migdałach, dostarczona bezpośrednio do krwi jest zupełnie obojętna i wydziela się wraz z moczem w stanie nierozłożonym. Jeżeli jednak temu samemu zwierzęciu wstrzykniemy dożylnie emulsję z migdałów słodkich, tak samo zresztą obojętną przy dostarczaniu drogą pokarmową, powstanie natychmiast śmiertelne zatrucie kwasem pruskim, przetworem hydrolizy amygdaliny; a to dlatego, że emulsja ta zawiera odpowiedni zaczyn, którego niema ani we krwi, ani w czystej amygdalinie.
Zaczyny hydrolityczne, jak również przeważna część innych zaczynów mają właściwości działania odwrotnego. Ten sam ferment, który wywołał hydrolizę, może w razie odpowiedniej zmiany warunków wywołać znów połączenie przetworów rozkładu, z odszczepieniem wody. Dla każdego zespołu warunków, jak to bywa i w zwykłem działaniu wody, istnieje pewien stan równowagi i w końcu reakcji mamy zawsze mieszaninę produktów rozkładu i nierozłożonej substancji.
Zaczyny odczynów hydrolitycznych nazywamy wogóle hydrolazami, rozdzielając je stosownie do substancyj, wobec których są one czynne. Tak więc mamy: 1° karbohydrazy, zaczyny rozkładu polysacharydów (węglowodanów złożonych z kilku cząsteczek prostych cukrów): sacharazy, jak np. diastaza i zaczyny rozkładu glikozydów (połączenie cukru z innemi substancjami) — glikozydazy, jak np. emulsina. 2° Estrazy — zaczyny rozszczepienia estrów, czyli połączeń resztek alkoholowych z resztkami kwasowemi, jak np. lipazy — zaczyny zmydlania tłuszczów. 3° Proteazy — zaczyny rozkładu lub odwrotnie, syntezy, lub krzepnięcia białka, jak np. pepsyna, trypsyna, papayotina i, z drugiej strony, chymozina (zaczyn krzepnięcia mleka) i trombina (zaczyn krzepnięcia krwi). 4° peptazy — zaczyny dalszego rozkładu przetworów hydrolizy białka, powstałych przy działaniu proteaz. Są to zaczyny podobne do erepsyny, rozkładającej polipeptydy na odpowiednie aminokwasy według ogólnego wzoru:
| NH2 R.CO.NH.R.CO2H + H2O = R ⟨ |
NH2 CO2H |
+ R, ⟨ | NH2 CO2H |
5° Arginazy (zaczyny rozkładające argininę na ornitrynę i mocznik) oraz 6° liczne dezamidazy.
Do peptaz należą też ważne w patologji zaczyny autolityczne. Do nich dołącza się też ureaza, zaczyn rozkładu mocznika na kwas węglowy i amoniak, z których tworzy się węglan amonowy:
(HO)2:C:(NH2)2 + H2O = CO.(OH)2 + 2NH3 = CO(ONH4)2
Ureaza zasadniczo nie powstaje w ustroju zwierzęcym, jest to bowiem zaczyn właściwy tylko pewnym drobnoustrojom.
Znaczna ilość trucizn pochodzenia mineralnego hydrolizuje się bardzo łatwo bez udziału zaczynów w obecności wody, tworząc odpowiednie kwasy mineralne. Takiego rodzaju hydroliza stanowi przedewszystkiem typową cechę chlorobezwodników kwasów, do których w pierwszym rzędzie zalicza się fosgen:
Inne substancje, zawierające chlor, odszczepiają go tylko powoli. Takim np. jest rozkład iperytu S(CH2−CH2−Cl)2 + H2O = S(CH2CH2OH)2 + 2HCl. Wreszcie trzecia grupa substancyj, jak np. chloropikryna, prawie zupełnie nie podlega hydrolizie pod działaniem wody.
Zaczyny hydrolityczne, oprócz ich zasadniczej roli, w procesach trawienia i przemiany materji występują jako niezbędne czynniki rozkładu licznych trucizn należących do glikozydów, często dostępnych dla zwykłej hydrolizy organizmu zwierzęcego.
Z innych odczynów, o których mówiliśmy w § 46, tworzenie się doparków, czyli dehydroliza, jest czynnością tych samych zaczynów co i hydroliza, która jest odczynem odwracalnym. Powstawania doparków niezależnie od czynności zaczynów nie zaobserwowano. Amidacja i dezamidacja jest czynnością pewnych peptaz, ściśle związaną z hydrolizą. Rola tych odczynów w dalszych losach trucizn jest dość duża. Mianowicie powstawanie obojętnych dla ustroju doparków z kwasem siarczanym prowadzi do zrównoważenia działania trujących fenolów; takież obojętne doparki z kwasem glikuronowym są typowemi przetworami syntezy w zatruciu chloralem, kamforą i niektóremi olejkami eterowemi.
W niektórych przypadkach, jak np. w zatruciu kwasami aromatycznemi, mamy odtruwające działanie kwasu amino-octowego (glikokolu) i powstawanie kwasu hipurowego, lub jego homologów. Tworzenie się takich doparków z kwasami często następuje po poprzedniem utlenieniu substancji obcej.
Amidacja i dezamidacja substancyj obcych, z wyjątkiem wyżej omówionych procesów rozkładu białka (§ 46) są zjawiskami rzadkiemi, spostrzeganemi tylko w razie dostarczenia pewnych pochodnych aromatycznych. Zależy to prawdopodobnie od dużego stopnia swoistości odpowiednich zaczynów. Ustalono np., że proteazy, czynne wobec aminokwasów skręcających płaszczyznę polaryzacji światła na lewo, nie są w stanie rozłożyć ich optycznych antypodów i są również bezwzględnie bierne wobec obcych aminokwasów, nie powstających w ustroju.
Odczyny alkylowania i odszczepiania alkylów, przyłączenia rodników kwasowych, a przeważnie acetylu (CH3CO’) i uraminu NH2CO’, jak również polymeryzacja i wewnętrzne zmiany budowy cząsteczki nie są rozpowszechnione i występują tylko w pewnych wyjątkowych warunkach. Tak np. mamy wyraźne metylowanie w zatruciu związkami selenu lub teluru wydzielanemi w stanie dwumetyloselenu Se(CH3)2 i dwumetyloteluza Te(CH3)2; jak również wydzielenie kwasu sulfanilowego w stanie kwasu sulfanilowo-karbaminowego
SO2OHC6H5NH2 + HO.CONH2 = SO2OHC6H4CONH2 + H2O.
Rozkład na kilka mniejszych cząsteczek jest zwykłem zjawiskiem spowodowanem działaniem zymaz, i dla losów trucizn w organizmie jest on dość obojętny.
Na podstawie wszystkich omówionych szczegółów możemy wnioskować, że losy trucizn w organizmie mogą układać się w sposób następujący:
1. trucizny mogą podlegać zupełnemu zniszczeniu, przetwarzając się bądźto w końcowe przetwory przemiany materii CO2, H2O, NH3 i t. d., bądź też w inne obojętne związki.
2. Mogą przez połączenie z pewnemi przetworami przemiany materii stać się zupełnie nieczynnemi. Niemniej zupełna utrata czynności nastąpić może skutkiem częściowego utlenienia. Zjawiska tego rodzaju nazywamy samoodtruciem organizmu.
3. Mogą one pozostać całkowicie lub częściowo nietknięte przez odczyny chemiczne organizmu i odgrywać rolę katalizatorów zazwyczaj ujemnych dla całego szeregu odczynów wewnątrz-komórkowych.
Istotę tak zwanej korelacji chemicznej organizmu stanowi zdolność do walki z trucizną w drodze odpowiedniego przystosowania się do warunków niezwykłych.
Niezależnie jednakże od korelacji chemicznej wszelkie niezmienione obce substancje, bądź zmienione w swoich właściwościach i już nieszkodliwe dla organizmu, bądź też przetwory ich rozkładu, zazwyczaj po pewnym czasie zostają wyrzucone ze krwi wraz z wydzielinami ustroju.
Proces wydzielania trucizn stanowi treść następnego rozdziału.
Jak możemy wywnioskować z powyższego, pomiędzy zatruciami a chorobami innego pochodzenia nie zachodzi w rzeczywistości żadna zasadnicza różnica. W obu wypadkach objawy chorobowe są zawsze wynikiem niemożliwości należytego przystosowania się ustroju do niezwykłych warunków otoczenia. Dlatego też gdy takie warunki stają się stałemi, pewna ilość istot zastosowuje się do nich, wskutek czego warunki te przestają być dla nich chorobotwórczemi. Zjawisko to stanowi treść tak zwanego przystosowania gatunkowego. Mamy przykłady takiego przystosowania się do trucizn u farmakofagów, czyli zwierząt, przeważnie gąsienic motyli, które nietylko żywią się jadowitemi roślinami, lecz rośliny te są dla nich jedynym odpowiednim pokarmem. Tak np. różne gatunki fajecznika (Aristolochia) są wyłącznym pokarmem gąsienic podzwrotnikowych, olbrzymich Ornithoptera, jak również tutejszej Thais, wówczas gdy u wszystkich ssaków rośliny te wywołują niechybnie śmiertelne zapalenie jelit i nerek. Typowa trucizna sercowa, neriina, zawarta w liściach zwykłego oleandra, nie przeszkadza tej roślinie w żywieniu pięknej Daphnis Nerii. Rośliny zawierające atropinę, z rodzaju Solanaceae, mogą być, jak już o tem mówiliśmy, bezkarnie używane jako pokarm przez wiele gatunków zwierząt.
Dlatego też samo pojęcie „trucizna“ jest mniej więcej względnem. Trucizn bezwzględnych nie znamy, tak samo dla roślin. Na glebach zawierających duże ilości soli kuchennej, cynku, baru, przetworów rozkładu materjałów organicznych, rosną specjalnie do tego przystosowane rośliny, mogące w niektórych wypadkach stać się źródłem zatrucia dla ludzi.
Zupełnie możliwą rzeczą jest także zatrucie przez mięso i mleko zwierząt odpornych na pewne trucizny, jak to naprzykład zostało ustalone dla atropiny i kantarydyny (mięso ptaków i mleko kozy).
Mamy tu do czynienia nietylko z wyjątkową przystosowalnością poszczególnych gatunków. W zatruciach przewlekłych ukazują się zawsze przejawy przystosowania osobistego, powodującego zmiany właściwości samej jednostki zatrutej. Są to przedewszystkiem rozpatrywane już wyżej zatrucia nałogowe oraz rozmaite postacie allergji, określone poprzednio jako nietypowe odczyny na zatrucia.
Najważniejszą wszakże jest okoliczność, że każde zatrucie, o ile tylko nie powoduje śmierci, zawsze wywołuje odpowiednie przystosowanie się organizmu do nowych warunków i uwolnienie się od nich bądź drogą odtrucia, bądź też wydzielania trucizny nazewnątrz.
Odtrucie, jako objaw pewnego przystosowania się organizmu, jest skutkiem działania każdej trucizny. Odtrucie zachodzi niezależnie od dostarczania z zewnątrz jakichkolwiek odtrutek i dlatego zawsze bywa samoodtruciem. Podstawą jego są odczyny, o których mówiliśmy — odczyny przemiany materii, a w wyniku powstaje albo zupełny rozkład trucizny na obojętne składniki, lub przetwory jej połączenia z przejściowemi okresami rozkładu materiałów spożywczych.
Taki sposób samoodtrucia nazywamy zrównoważeniem chemicznem.
Czy obok tego w zatruciach pochodzenia zewnętrznego istnieje też zrównoważenie fizjologiczne w postaci wzmożonego wyrobu hormonów przeciwdziałających pewnym zmianom czynności organów, wynikłych wskutek tych zatruć, nie jest dostatecznie ustalone. Mamy jednak pewne wskazówki co do możności powstawania takich odczynów. Zanik poszczególnych gruczołów naczyniowych wywołuje zawsze pewne zmiany w innych gruczołach. Naprzykład przysadka zmienia swą budowę w nieobecności tarczycy, w ciąży i w razie kastracji; budowa nadnercza zmienia się w zaniku trzustki i t. d.
Znane są również w tych gruczołach zmiany powstające w niektórych zatruciach, a sprawiające wrażenie wzmożenia ich czynności. Wszystkie te zjawiska są jednak jeszcze zbyt mało zbadane, aby mogły być traktowane bardziej wyczerpująco. Są wskazówki, według których stan narządów wydzielania wewnętrznego może mieć zasadnicze znaczenie w przebiegu zatruć bojowych. Pożaryski podkreśla, że wśród śmiertelnie zatrutych chlorem (w początku wojny gazowej) stwierdzono duży odsetek jednostek ze status thymicolymphaticus — specjalną anomalję konstytucjonalną, składającą się z zachowania thymus (grasicy) i zatrzymania rozwoju gruczołów płciowych, przy znacznym rozroście wszystkich gruczołów chłonnych.
ZRÓWNOWAŻENIE ZATRUĆ.
Najważniejszy sposób walki organizmu z zatruciem polega na usunięciu szkodliwej substancji. Zarówno trucizny o działaniu cząsteczkowem, nie ulegające zmianom chemicznym w organizmie, jak i ostateczne przetwory przemiany materji, ulegają wydzielaniu, czyli zostają wyrzucone nazewnątrz organizmu. Cały szereg substancyj wydziela się całkowicie lub częściowo w takim samym stanie, w jakim je organizm otrzymał. Podobny los spotyka np. alkohol, z którego do 2,5% wydziela się z moczem, od 2—6% z wydychanem powietrzem, reszta zaś spala się i zostaje wydzielana w stanie wody i kwasu węglowego. Inne substancje trujące podlegają stosunkowo niedużym zmianom, najczęściej pewnemu utlenieniu, albo hydrolizie, albo wreszcie łączą się z przetworami rozkładu innych substancyj, stale obecnych w ustroju w charakterze środków odżywczych i tworzą wówczas, jak mówiliśmy, nowe związki o innych, zazwyczaj mniej niebezpiecznych właściwościach.
Wszystkie te substancje krążą przez pewien czas we krwi, dopóki nie zostaną schwytane przez komórki właściwych narządów dzięki znanemu już nam organotropizmowi. Zadaniem tych narządów jest nagromadzanie, albo wydzielanie obcych substancyj.
Stopień organotropizmu nie jest jednakowy dla poszczególnych trucizn, tak co do punktu wydzielania, jak też co do względnej ilości wydzielanych substancyj.
Do narządów zwanych wydalniczemi czyli ekskrecyjnemi należą przedewszystkiem nerki, potem skóra i płuca. W gruczołach wydzielniczych czyli sekrecyjnych mamy narządy służące do wytwarzania przetworów o zadaniach swoistych, jak np. soki trawienne. Wydzielanie obcych substancyj znajdujących się we krwi jest dla takich narządów sekrecyjnych zadaniem drugorzędnem i mniej więcej przypadkowem.
Najważniejszym z narządów wydzielania jest nerka. Prawie wszystkie ciała obce wprowadzone do krwi posiadają wyraźny nefrotropizm. Staje się to oczywiste po dostarczeniu do krwi, albo nawet do kanału trawiennego pewnych barwników. Nerki, lub narządy o czynności podobnej, jak również mocz zwierząt zabitych w czasie wydzielania, okazują się wówczas silnie zabarwionemi na odpowiedni kolor. Rozumie się, że w ten sam sposób są wydzielane substancje bezbarwne, których istnienie można stwierdzić zapomocą odpowiednich odczynów chemicznych. Tak np. nerka zwierzęcia, które otrzymało dożylnie rozczyn żelazocyanku sodu, barwi się na kolor ciemnobłękitny pod działaniem rozczynu chlorku żelaza. Wszystkie substancje rozpuszczalne wydzielają się przez nerki, z wyjątkiem własnego białka krwi, dla którego nerka normalna jest w zasadzie nieprzepuszczalna. Natomiast dla obcego białka, a więc i dla osocza krwi zwierząt innego gatunku, białka jaj i mleka, różnych sztucznych przetworów podobnych do żelatyny, jak również dla pierwszych przetworów hydrolizy białka, nerki okazują się łatwo przepuszczalnemi. W warunkach patologicznych, jak uszkodzenie nerek i nieprawidłowa czynność serca i naczyń, mocz zawiera i białko krwi, objaw tak zwanego białkomoczu.
Dla ciał krystalicznych, chemiczni nieczynnych w stosunku do białka tkanek, nerki są przepuszczalne w stopniu nie mającym prawie górnej granicy, o tyle, o ile można podnieść stężenie danej substancji we krwi, a coraz inne narządy, przedewszystkiem serce, pozostają czynnemi. Dla takich substancyj wręcz przeciwnie niż to dzieje się z ciałami koloidalnemi, których zawartość we krwi zawsze bywa większa niż zawartość w moczu, mamy wyraźne nagromadzenie ich z początku w nerkach, a następnie i w moczu. Wyjątek stanowią sole należące do liczby zwykłych składników krwi; dla nich istnieje dolna granica stężenia we krwi i wówczas mocz może stać się mniej stężony niż krew. Taki sam stosunek mamy też i dla obcych ciał, niezależnie od ich właściwości trujących, jak również dla zwykłych składników moczu.
I tak naprzykład najważniejszy przetwór przemiany azotu jest mocznik którego stężenie we krwi wynosi około 0,1%, a w moczu dosięga powyżej 2%. Dolna granica stężenia mocznika jest przedewszystkiem określona tak zwanym progiem wydzielalności.
Każda substancja, aby mogła dostać się do moczu, musi dosięgnąć we krwi pewnego stopnia stężenia niejednakowego dla poszczególnych substancyj. Próg wydzielalności istnieje nawet dla normalnych składników krwi. Tak np. glikoza, czyli cukier gronowy, zawsze obecny we krwi, zaczyna wydzielać się z moczem w chwili, gdy stężenie jego we krwi przewyższy 0,1%. Dla obcych substancyj, a więc i dla trucizn, próg ten jest bardzo niski i związki tego rodzaju odnajdujemy w moczu po dostarczeniu do krwiobiegu najmniejszych ich ilości.
Wrażliwość nerki, czyli jej zdolność reagowania na obecność obcych substancyj, nawet w stanie normalnym, zależna jest od całego szeregu warunków. Naprzykład do zatrzymania we krwi cukru gronowego jest potrzebne pewne stężenie jonów i . W stężeniu niższem niż norma, próg wrażliwości znacznie obniża się. Anatomiczne uszkodzenie, jak np. zwyrodnienie nabłonka nerki, obniża zawsze jej przenikalność, a podnosi próg wydzielalności. Staje się to zupełnie zrozumiałe jako wynik sposobu działania nerek. Proces wydzielania składa się z nagromadzenia w zarodzie nabłonka wodniczek, zawierających stężony rozczyn wydzielin i czynnego wyrzucania tej zawartości w światło kanalika. Zjawisko to jest możliwe tylko w zupełnie zdrowej komórce. Dlatego też, jeżeli nagromadzona substancja może wywoływać anatomiczne uszkodzenia t. j. zwyrodnienie nabłonka i zapalenie tkanki łącznej, to w ten sposób organotropizm trucizny powoduje głębokie zmiany w nerkach, a stąd i w składzie moczu. Substancje uszkadzające nerki są bardzo liczne. Z pośród nich najczynniejsze są sole ciężkich metali, przedewszystkiem rtęci, chromu i uranu, wszystkie substancje drażniące skórę, jak np. kantarydina, kardol i podobne związki, fosfor i arsen, niektóre toksalbuminy i t. d.
Zwykłym objawem uszkodzenia nerek jest białkomocz i tworzenie się tak zw. wałeczków nerkowych, czyli zlepków z kanalików, powstałych z białkowych ciał. Mocz zawiera też zawsze białe i czerwone ciałka krwi. Zawartość zarówno normalnych jak i obcych składników krwi w takim moczu bywa zawsze niższa niż normalnie.
Drugą zasadniczą zmianą składu moczu w zatruciach jest obecność cukru gronowego bez zmian anatomicznych w nerkach, nawet w cukromoczu pochodzenia nerkowego. Podczas takiego cukromoczu mamy wyraźne obniżenie progu wydzielalności dla cukru, wskutek czego stężenie jego we krwi obniża się dwu i trzykrotnie. Ten stan rzeczy obserwujemy np. w zatruciach florydziną. Zwykle jednak w cukromoczu mamy stosunek odwrotny, to jest nagromadzenie się cukru gronowego we krwi wskutek przyspieszonego rozkładu glikogenu.
Cukromocz toksyczny powstaje w zatruciu czadem, kurare i wielu narkotykami, oraz niektóremi środkami działającemi szkodliwie na nerki, jak np. związkami uranu.
Wydzielanie przez nerki jest poważnym czynnikiem w uzdrowieniu po zatruciach. Tak np., dzięki wzmożonemu wydzielaniu, zatrucie kurare drogą pokarmową staje się niemożliwe, ponieważ resorpcja trucizny jest powolniejsza niż wydzielanie się jej przez nerki.
Podniesienie czynności nerek w zatruciach jest wynikiem bądźto pewnych zmian składu krwi wskutek dostarczania do ustroju nadmiaru wody, soli, cukru, bądź też, co zresztą częściej zdarza się, wynikiem zmian narządów krążenia, a przedewszystkiem serca. Ilość moczu zależna jest od ciśnienia krwi. Działanie swoiste, powiększające czynność nerek, jest mało rozpowszechnione. Tak działają pochodne purynowe, jak kofeina i teobromina, również wydzieliny gruczołów naczyniowych, mianowicie przysadki, t. zw. pituitryna.
Zwiększenie ilości moczu może też nastąpić wskutek nadmiernego użycia wody, soli i powstawania w ustroju nadmiaru mocznika lub po dożylnem wprowadzeniu jego. Zwiększenie ilości moczu, niezależnie od przyczyn wywołujących je, sprowadza zawsze przyspieszenie wydzielania ciał obcych obecnych we krwi, sprzyja więc w sposób doraźny uzdrowieniu po zatruciu.
W zatruciach bojowych badanie moczu jest ważnem dla diagnozy zatruć. Obecność kwasu mlekowego i wogóle podniesienie kwasowości moczu (PH mniej od 4,82) jest wskazówką zatrucia środkami, w rozkładzie których powstaje kwas solny (chlor, trucizny grupy fosgenowej), a obecność kwasu arsenowego wskazuje na zatrucie sternitami i t. p.
Drugą mniej ważną drogą wydzielania trucizn jest przewód pokarmowy. W zawartości żołądka i jelit można znaleźć truciznę nawet po dostarczeniu jej inną drogą, np. po wstrzykiwaniu podskórnem, dożylnem lub po wchłanianiu przez płuca, skórę i t. d. Tak naprzykład, morfina wstrzyknięta podskórnie, wydziela się do żołądka w takich ilościach, że przez przemywanie żołądka można uratować zatrutego. To też powstające w tych warunkach wymioty są wyrazem samoobrony organizmu.
O wiele większa ilość trucizn (prawie wszystkie ciężkie metale) są wydzielane do jelit cienkich i grubych, wywołując w nich uszkodzenia anatomiczne podobne do powstałych wskutek czerwonki.
Zupełnie wyraźnym jest organotropizm pewnych trucizn względem dużych gruczołów trawiennych wątroby, trzustki i gruczołów ślinowych. Organotropizm ten łączy się zazwyczaj z wydzielaniem trucizn wraz z wydzieliną tych gruczołów. Wskutek warunków fizjologicznych i trudności otrzymania tych wydzielin w stanie czystym, obecność trucizny i przetworów jej rozkładu obserwowano tylko w zawartości jelit i w kale. Wyjątek stanowią gruczoły ślinowe, ponieważ ślinę łatwo otrzymać w stanie czystym. Co do czynności gruczołów to przedewszystkiem należy zwrócić uwagę na możność podniesienia się lub obniżenia jej pod wpływem niektórych zatruć.
Podczas gdy trucizny jednego rodzaju, jak np. atropina, wywołują prawie zupełny zanik wydzielania śliny, inne, jak pilokarpina i eseryna, naodwrót, wzmagają czynność gruczołów ślinnych. Takież wzmożone ślinienie można zauważyć w zatruciu rtęcią, a w mniejszym stopniu — ołowiem.
W ostatnich wypadkach łączy się on zawsze z dość obfitem wydzieleniem trucizny ze śliną, oraz wyraźnem zapaleniem i martwicą śluzówki jamy ustnej.
Zmiany czynnościowe i anatomiczne trzustki pod wpływem zatruć są prawie niezbadane, prawdopodobnie jednak niemniej znaczne niż zmiany gruczołów ślinowych. Trudność badań polega na tem, że sok wydzielający się ze sztucznych fistuł ductus pancreatici bardzo prędko zmienia normalne właściwości. Wręcz przeciwnie, wątroba jest jednym z narządów najlepiej pod tym względem zbadanych. Jednakże warunki badań zmian składu żółci i wahań jej ilości również nie są łatwe, ponieważ potrzebują zabiegów chirurgicznych i tyczą się tylko zwierząt.
Wydzielanie z żółcią szeregu obcych substancyj — barwników, soli ciężkich metali, niektórych związków organicznych i t. p. zostało stwierdzone.
Najciekawsze i najważniejsze są jednak nie czynnościowe lecz anatomiczne zmiany wątroby, dostarczające cennych wskazówek dla diagnozy zatruć w badaniach sekcyjnych.
Najpospolitszą zmianą jest zwyrodnienie miąższowe wątroby, połączone zwykle z mniej więcej wyraźną przemianą tłuszczową. Zmiany te występują najwyraźniej w zatruciach fosforem i arsenem, jak również niektóremi olejkami eterycznemi.
Drugą niemniej typową zmianą wątroby są żółtaczki toksyczne. Żółtaczka powstaje zazwyczaj wskutek działania środków hemolitycznych i wiąże się z typowemi zmianami w moczu (hemoglobinurja) oraz we krwi. W pierwszem okresie mamy typowe zabarwienie tkanek wszystkich narządów i zwyrodnienie miąższowe komórek, wraz z przepełnieniem włoskowatych kanalików żółciowych. Następnie obok tych zmian występuje wyraźna hemosyderoza, to jest zabarwienie tkanek barwnikiem, zawierającym żelazo, powstałym z rozkładu hemoglobiny. Badania chemiczne tak zmienionej wątroby wykazują jednocześnie z zanikiem glikogenu obecność stałych nagromadzeń rozmaitych trucizn (przeważnie nieorganicznych) oraz przetworów ich rozkładu. Uszkodzenie jej komórek może posunąć się tak daleko, że odrodzenie ich staje się tylko częściowo możliwe; w wielu miejscach giną one zupełnie, zaś na ich miejscu rozrasta się obficie tkanka łączna: w ten sposób powstaje jedna z najpospolitszych zmian w zatruciach chronicznych — toksyczna marskość wątroby (cirrhosis). Jest ona w doświadczeniach laboratoryjnych zwykle niewyraźna, ponieważ wymaga dla swego rozwoju bardzo długiego czasu. U człowieka dość pospolita jest marskość laennekowska, stanowiąca typowy wynik zatruć chronicznych nieoczyszczoną wódką, zawierającą znaczne ilości wyższych alkoholów i innych trucizn działających na wątrobę. Ponieważ wątroba leży na drodze wszystkich trucizn pochłanianych przez krew w kanale trawiennym jako pewnego rodzaju tama, niema więc nic dziwnego, że jej komórki zostają uszkodzone w pierwszym rzędzie.
Obecność trucizn w przewodzie pokarmowym, niezależnie od tego, czy będą one dostarczone przez usta, albo wydzielone do przewodu ze krwi, wywołuje zmiany nietylko miejscowe, t. j. zapalenie i martwicę z powstawaniem głębokich wrzodów i krwotoków, z obfitem wydzieleniem soku jelitowego i wysięku surowiczego, lecz także zmiany ruchu jelit zwanego ruchem robaczkowym czyli perystaltycznym. Ruchy te zależą przedewszystkiem od czynności mięśni, podlegają również regulacyjnemu wpływowi nerwów błędnego i trzewnego. Pierwszy jest nerwem ruchowym — drugi wstrzymującym. Dlatego też w płynie Ringera ruchy jelit są możliwe w oddzielonych odcinkach zawierających samodzielne ośrodki nerwowe. Szybkość tych ruchów razem z szybkością resorpcji określa konsystencję kału i liczbę stolców na dobę.
Większa część trucizn wydzielanych przez jelita wywołuje wzmocnienie ruchów perystaltycznych i pogorszenie warunków resorpcji. To też typowym objawem tego rodzaju zatruć jest zwykle uparta biegunka. Skutek odwrotny, to jest zaparcie, jest zawsze wynikiem działania na ośrodkowy układ nerwowy.
Wśród trucizn bojowych zdolność do wywołania biegunki posiadają chloropikryna i iperyt.
Wydzielanie przez kanał trawienny posiada znaczenie ochronne tylko w wyjątkowych przypadkach, mianowicie w przypadkach powstawania w jelitach związków nierozpuszczalnych, jak np. w zatruciu solami wapnia, ołowiu oraz baru. Zazwyczaj trucizny wydzielone ze śliną albo z sokiem żołądkowym, lub jelitowym, ulegają resorpcji w dalszych odcinkach jelit. Tworzenie się wrzodów i powstawanie zapaleń stanowią też oczywiście zjawiska ujemne.
Drogą zwykłą dla wszystkich gazów i związków lotnych, znajdujących się we krwi jest wydzielanie przez płuca, dotychczas mało zbadane. Przedewszystkiem są prawie nieznane podstawy tak zw. pneumotropizmu, czyli zdolności płuc do nagromadzania pewnych ciał w stężeniu wyższem niż we krwi. Proces ten nie jest jeszcze ustalonym nawet dla CO2, zwykłego szkodliwego składnika powietrza wydychanego. Teorja czynnego wydzielania (Bohra), polegająca na porównaniu płuc z typowemi gruczołami, niema wielkiego powodzenia. Rzeczywiście ustalonem zostało tylko tyle, że pewne substancje obce wydzielają się z ustroju częściowo przez płuca i są obecne w powietrzu wydychanem. Okoliczność tę zauważono przede wszystkiem w doświadczeniach ze związkami pachnącemi, jak np.: H2S, H2Te, H2Se, kwasem karbolowym, eterem, chloroformem, alkoholem etylowym i metylowym, acetonem, i t. d. Jednakże względna zawartość tych ciał w powietrzu wydychanem w porównaniu z ilością wprowadzoną do ustroju nie jest nigdy znaczną. Drugim dowodem wydzielania przez płuca jest powstawanie uszkodzeń, przede wszystkiem wyraźnej rozedmy i niedodmy wskutek dostarczenia pewnych trucizn bojowych podskórnie albo dożylnie. Zjawiska tego rodzaju stwierdzono w zatruciach związkami arsenowemi a przedewszystkiem luizytem, jak również po działaniu chloropikryny i iperytu. Ponieważ powstawanie rozedmy i niedodmy jest skutkiem zatkania małych oskrzelików, prawdopodobnem wydaje się przypuszczenie, że miejscem wydzielania, a więc i uszkodzeń anatomicznych są właśnie ściany tych oskrzelików, a nie nabłonek oddechowy. Wyników badań ilościowych ze ścisłem określeniem stosunku pomiędzy stężeniem wydzielonej trucizny w powietrzu wydychanem i jednocześnie we krwi, które mogłyby stanowić jedyną drogę do rozwiązania tej poważnej kwestji, dotychczas nie posiadamy.
Bardziej ciekawe, nietylko z punktu widzenia toksykologji środków bojowych, ale w większym stopniu i dla wyjaśnienia patogonezy chorób skórnych jest wydzielanie pewnych trucizn przez skórę, związane z wyraźnym dermotropizmem. Gruczoły potowe i tłuszczowe skóry są w istocie narządami wydzielniczemi, gdyż przetwory ich wydzielania dostają się z nich wprost nazewnątrz. Jednak gruczoły tłuszczowe częściej są źródłem lipoidów, które służą do wyławiania niektórych trucizn zawartych w powietrzu, jak np. mamy w zatruciach iperytem — a gruczoły potowe, zbliżone swą czynnością i budową do nerki, wyrabiają w normalnych warunkach płyn, którego stężenie jest znacznie mniejsze niż moczu. Tak np. mocznik którego normalna zawartość w moczu dosięga 2%, znajduje się w pocie tylko w ilości nie większej od 0,6%, choć w warunkach patologicznych aż do 13% ogólnej ilości azotu może być wydzielane przez skórę.
Wreszcie w niektórych zatruciach mamy do czynienia nie tyle ze zdolnością gruczołów skórnych do usuwania z ustroju ciał obcych, ile z wyraźnym dermotropizmem tych trucizn, czyli ich powinowactwem do żywych komórek nabłonka. W taki sposób powstają rozpowszechnione wypryski toksyczne (eczemy) i różne rodzaje wysypek tego samego pochodzenia. Toksyczne zapalenie gruczołów tłuszczowych, zwane trądzikiem (acne) jest zwykłym objawem zatrucia chlorowcami, przedewszystkiem zaś bromem i jodem, a w razie długotrwałego działania również i chlorem.
Pewne środki mają tak wyraźny dermatropizm, że po użyciu wewnętrznem nawet w małych ilościach są w stanie wywoływać nadzwyczaj ostre podrażnienia skóry. Tak np. azaron (trójmetoksypropylfenol C6H2C3H5. (OCH3)3), pachnąca substancja pospolitego kopytnika (Azarum europeum) wywołuje po wewnętrznem użyciu w znikomych dawkach zapalenie skóry podobne do róży.
Każde zatrucie, jak to powiedzieliśmy, jest chorobą, powstałą wskutek zachwiania równowagi odczynów chemicznych w ustroju. Każda choroba jest jakimś procesem, więc czemś, mającem swój własny rozwój w czasie, posiadającem swój właściwy początek i koniec. Dlatego w każdem zatruciu odróżniamy takie same okresy zasadnicze jak i w każdej chorobie. Różnica bywa tylko ilościowa, zależna od tego, że w pewnych ostrych zatruciach rozwój objawów jest tak szybki, że wyodrębnienie tych okresów staje się prawie niemożliwe.
Naogół w rozwoju chorób rozróżniamy następujące okresy:
1. okres wylęgania (stadium incubationis) od chwili zapoczątkowania działania warunków szkodliwych do pierwszych objawów uszkodzenia ustroju;
2. okres zwiastunów (stadium prodromale) — krótkotrwały zazwyczaj okres niewyraźnych i nietypowych objawów;
3. okres wzrastania (stadium incrementi) — stopniowe nasilanie się typowych objawów chorobowych i powstawanie nowych objawów, coraz wyraźniejszych;
4. okres nasilenia (stadium acmes) — najwyższy stopień rozwoju choroby. Śmierć następuje zwykle w ciągu ostatnich dwóch okresów;
5. okres obniżenia (stadium decrementi) — okres zaniku choroby. Zanik ten może być nagły, czyli krytyczny, albo stopniowy, powolny, czyli lityczny;
6. okres ozdrowienia (rekonwalescencja) — stopniowy powrót do stanu normalnego;
7. okres końcowy (stadium finale) — może być zupełnym powrotem do stanu przedchorobowego, może przejść w stan stałego okaleczenia, nie podlegającego już dalszym zmianom i może również bez bliżej określonej granicy przejść w rozwijający się stopniowo proces chroniczny (choroby przewlekłe). W innych wypadkach chroniczny proces ma nietylko długotrwały przebieg, lecz takiż samy powolny zdradziecki początek; niema w takim razie stadium incrementi. Niemożemy również wyodrębnić wyraźnych okresów, mamy tylko chwilowe pogorszenie i polepszenie stanu chorego, tak zwane remisje i ekzacerbacje. Jeżeli remisje są na tyle znaczne, że w ciągu ich trwania zanikają prawie wszystkie objawy choroby, to następujące po nich ekzacerbacje przybierają charakter mniej lub więcej typowych ataków. Zasadnicze te okresy w zatruciach występują w dość wyraźnych formach. Przedewszystkiem zatrucia mogą być zarówno ostre jak i chroniczne. W powolnem zatruciu nagromadzającemi się stopniowo małemi dawkami, albo w razie stałej obecności bardzo nieznacznej ilości trucizny w otoczeniu, spotykamy zwykle zasłabnięcie chroniczne, lub nagłe powstanie zatrucia ostrego po upływie pewnego okresu wylegania. W większości wypadków w zatruciach ostrych okres wylęgania bywa tak krótki, że prawie nie istnieje. Wyraźny okres wylęgania jest zasadniczą cechą zatruć powstałych wskutek nagromadzenia w ustroju trucizn obecnych w otoczeniu w stężeniu bardzo nieznacznem, na co potrzeba pewnego czasu, od kilku sekund do wielu tygodni i nawet miesięcy.
Zdolności do takiego stopniowego nagromadzenia się w organizmie posiadają liczne środki bojowe, naprzykład wszystkie drażniące (lakrymatory, sternity) oraz znaczna część trucizn skórnych. Drugą grupą środków, działających po upływie dłuższego czasu po dostarczeniu ich do ustroju, są tak zw. trucizny przemiany materji. Trzecią grupę stanowią wszystkie typowe zatrucia chroniczne, dla których ścisłe określenie chwili ich powstawania bywa zazwyczaj rzeczą niewykonalną, jak np. w zatruciu rtęcią lub ołowiem.
Okres zwiastunów w chorobach powstałych wskutek zatrucia jest niewyraźny, a nawet zwykle zmniejsza się do zera, ponieważ typowe objawy występują odrazu. Okres wzrastania istnieje zawsze, a zasadniczą cechą jego jest przewaga zjawisk podrażnienia. Dlatego też z punktu widzenia toksykologicznego nazywamy okres ten „okresem podrażnień“. Wskutek podrażnienia występuje wzmożenie czynności niektórych tkanek, a przedewszystkiem mięśni, skąd powstają kurcze, następnie i gruczołów, wyrażające się w zwiększeniu ilości wydzieliny. Najwrażliwszym jest oczywiście układ nerwowy, którego podrażnienie pociąga za sobą bądźto kurcze i wzmożenie czynności gruczołów, bądź też takie podniesienie wrażliwości, że każde podrażnienie zewnętrzne, prawie niedostrzegalne w stanie normalnym, wywołuje zjawiska odruchowe, a nawet ogólne rozpromienienie odruchów. Trucizny, wywołujące wymienione zjawiska, mogą i same przez się powodować podrażnienia, jak np. typowe środki odruchowe, lub działać przez przeczulenie układu nerwowego (ośrodków odruchowych). Miejscem działania trucizn pierwszego rodzaju, czyli prawdziwych trucizn odruchowych są zakończenia czuciowych nerwów obwodowych na powierzchniach alarmowych. Na tem polega działanie wielu środków bojowych drażniących i częściowo duszących, o ile te ostatnie wywołują pewne odruchy. Dla trucizn drugiego rodzaju miejscem działania jest ośrodkowy układ nerwowy, czyli ośrodki położone w rdzeniu pacierzowym. Przykładem tego rodzaju trucizn jest strychnina. Skurcz wywołany przez te trucizny dosięgnąć może takiego stopnia rozwoju, że powoduje niemożność oddechu, wskutek czego nastąpić może natychmiastowa śmierć — zjawisko naogół wyjątkowe w tym okresie zatrucia.
W przeważającej ilości wypadków działania najczynniejszych środków okres podrażnień, stadium incrementi, jest tak niewyraźny i krótkotrwały, że wydaje się jakoby paraliż następował bezpośrednio jako pierwszy objaw zatrucia. Trucizny takie nazwano paraliżującemi. Zwykle jednak porażenie bywa dopiero dalszym stopniem rozwoju działania trucizny, w ten sposób, że zjawisko porażenia stopniowo rozwija się ze zjawisk podrażnień. Powstawanie porażenia odpowiada okresowi nasilenia zatrucia.
Porażenie może być miejscowe, tyczące się tylko pewnych narządów lub nawet komórek lub ogólne.
Trucizny paraliżujące każdą żywą komórkę nazywamy protoplasmatycznemi. Treść działania tych trucizn nie zawsze bywa jednakowa. Do nich należą po pierwsze trucizny fermentów, jak np. kwas pruski, który zabija bez głębszych zmian anatomicznych, po drugie wszystkie substancje czynne chemiczne, w rodzaju hydroksylaminy, formaldehydu, chlorobezwodników kwasów, wolnych chlorowców, ozonu i tlenu w stanie powstawania — po trzecie, związki takie, jak np. fluorki, które usuwają z komórek jony wapnia, niezbędne jako katalizatory.
Najczęściej wszakże w przypadkach porażenia mamy do czynienia z wyraźnym organotropizmem, umiejscowieniem zatrucia w niektórych tylko tkankach, a nawet wyłącznie w pewnych specjalnych narządach. Tak np. wśród trucizn działających na układ nerwowy mamy kurare, które działa tylko na zakończenia nerwów ruchowych w mięśniach, atropinę wywołującą paraliż nerwu błędnego, narkotyki, paraliżujące korę mózgu i t. d.
Co do rozwoju porażeń podkreślić należy, że po pierwsze porażenie powstaje zazwyczaj nie odrazu, lecz rozpoczyna się od stopniowo wzrastającego niedowładu, a po drugie, że w złożonym układzie nerwowym porażenie rozmaitych ośrodków następuje nie jednocześnie, a w pewnym porządku właściwym dla każdej trucizny.
W działaniu trucizn nasennych mamy z początku porażenie kory mózgowej, co powoduje utratę przytomności i niepewność ruchów, stopniowo przechodzącą w zupełne unieruchomienie. Tylko po użyciu większych dawek i dłużej trwającem działaniu występują zjawiska porażenia ośrodków narządów życiowych, mianowicie serca i narządu oddechowego. W innych wypadkach paraliż zaczyna się od górnych ośrodków nerwów, wobec czego objawy porażeń pierwszego okresu obejmują ruchy oka, następnie rozpowszechniają się na mięśnie gardzieli i języka, wreszcie przechodzi na ośrodki nerwu błędnego. Jest to porażenie zstępujące, które zostało zauważone w pewnych zatruciach bakteryjnych, jak np. w zatruciu jadem kiełbasianym (botulismus). W pewnych chorobach układu nerwowego o pochodzeniu zakaźnem, np. w jednej postaci wodowstrętu (paraliż Landry) rozwój porażeń ma kierunek wręcz odwrotny, rozpoczynając się od tylnej części ciała (nóg) i posuwając się w górę. Taki paraliż nazywa się wstępującym. U zwierząt (psów, królików) jest to pospolite zjawisko we wszystkich prawie przewlekłych zatruciach.
Rozwój porażenia pociąga za sobą głębokie zaburzenia czynności życiowych ustroju i dlatego w tym okresie zatrucia mamy przeważającą ilość wyników śmiertelnych.
Jeżeli jednak działanie trucizny ograniczy się tylko do podrażnienia lub niedowładu, nie dotycząc ważnych ośrodków życiowych, to staje się możliwem przejście do następnego okresu decrementi. Zależy to od stopniowego niszczenia trucizny i przetwarzania jej w związki nieczynne, albo od skutecznego wydzielania z ustroju. Zarówno pierwszy jak i drugi proces może rozwijać się bardzo powoli. Wskutek tego w zatruciu zazwyczaj niema nagłego krytycznego zaniku objawów, tak pospolitego stosunkowo w wielu chorobach zakaźnych; typowy jest natomiast stopniowy, lityczny zanik objawu zatrucia. Rozumie się nie zaliczamy tu zatruć, w których działanie trucizny zostało przerwane wskutek wymiotów lub wydzielania z moczem w ilościach przewyższających stopień szybkości absorpcji (jak np. kurare, dostarczone do żołądka). W powolnym zaniku typowych objawów zatrucia mamy w dużej ilości wypadków, choć nie zawsze, bardzo wyraźny okres wyzdrowienia, zwłaszcza w razie poważniejszych zmian anatomicznych. W okresie tym napotykamy zazwyczaj typowe dla wielu zatruć działanie następcze, obok rozmaitych powikłań wtórnych. Działania następcze są zwykle skutkiem anatomicznych uszkodzeń narządów życiowych — serca, nerek, wątroby. Ustrój w większości wypadków jest w stanie zapobiec nieszczęsnemu wynikowi, dzięki procesom wyrównawczym, polegającym na odrodzeniu i rozroście tkanki, na zamianie uszkodzonych części przez inne i t. d.
Dość często jednakże procesy takie okazują się niewystarczającemi i po wyzdrowieniu z zatrucia następuje śmierć wskutek zwyrodnienia jednego z narządów. Tak np. pośród ludzi, którzy przeżyli ostre zatrucie fosgenem, duża ilość ginie po kilku dniach, lub później, wskutek nagłego porażenia serca, a powstałe wskutek zatrucia zapalenie nerek trwać może całe lata, powodując wkońcu śmierć wśród ciężkich objawów mocznicy.
Powikłania są skutkiem zmniejszonej odporności zatrutego ustroju, który łatwiej podlega wpływom różnych szkodliwych warunków otoczenia. Pośród nich najpoważniejszą rolę gra obecność ustrojów chorobotwórczych, a przedewszystkiem drobnoustrojów ropnych i gnilnych. Obumarłe tkanki, wysięki zapalne, błony rzekome i wylewy krwawe stanowią najbardziej odpowiednie środowisko dla rozwoju bakteryj i dlatego miejsce uszkodzenia ulega łatwo ropieniu, owrzodzeniu lub martwicy, których dalszy przebieg jest już zupełnie niezależny od istoty pierwotnego zatrucia.
Wyniki zatrucia bywają naogół dość rozmaite, nawet po działaniu tej samej trucizny. W ostrych postaciach zatruć, zwłaszcza wywołanych jednorazowem dostarczeniem trucizny, obserwujemy zazwyczaj, zależnie od dawki, albo prędko następującą śmierć, albo całkowite wyzdrowienie, zakończone powrotem do stanu pierwotnego. Chroniczne choroby i okaleczenia są w takich wypadkach raczej wyjątkowemi i powstają wskutek następnych powikłań, albo głębokich uszkodzeń anatomicznych, jak np. blizny przełyku i żołądka po zatruciach mocnemi kwasami, albo ługiem.
Inaczej przedstawiają się wyniki zatruć chronicznych zawsze połączonych z zasadniczemi zmianami anatomicznemi, przedewszystkiem układu nerwowego. Obok podrażnienia pewnych ośrodków (np. zjawiska uporczywego ślinienia w zatruciu rtęcią) powstają najczęściej objawy niedowładu i porażenia w postaci zapalenia nerwów obwodowych, lub zmian w ośrodkowym układzie nerwowym. Jako przykład służyć mogą zatrucia siarczkiem węgla, oraz skutki nałogowych zatruć: morfinizmu, kokainizmu i t. d.
Drugiem miejscem uszkodzeń w zatruciach chronicznych są narządy krwiotwórcze. Chroniczna niedokrwistość pojawia się jako zwykły skutek zatrucia wieloma truciznami, szczególniej ołowiem i arsenem. W mięśniach widzimy często wyraźną atrofję, aż do zupełnego zaniku pewnych grup mięśniowych, zwykle w związku z zapaleniem nerwów obwodowych, właściwem zatruciom ołowiem i arsenem. Nie brak też głębokich zmian i w szkielecie jak np. wyraźna osteoporoza w zatruciu rtęcią, lub wzmożone wytwarzanie się tkanki kostnej w zatruciu małemi dawkami fosforu. Zmiany narządów miąższowych odgrywają także poważną rolę w chorobach wywiązujących się z zatruć. Chroniczne zapalenia i marskość (cirrhosis) wątroby, nerki i mięśnia sercowego są zwykłemi następstwami zatruć chronicznych np. alkoholem, czyli raczej przetworami jego zanieczyszczenia.
Każda trucizna wywołuje dość ściśle określony szereg zjawisk, stanowiących objawy zatrucia. Objawy te mogą mieć pewne cechy ogólne, wskutek czego możliwy jest podział trucizn według ich działania. Mimo to, każda trucizna może wywoływać pewne właściwe jej tylko objawy, nie obserwowane przy innych zatruciach. Wogóle, jak zaznaczono w rozdziale pierwszym, liczba trucizn jest o wiele znaczniejsza od liczby możliwych objawów zatrucia, ograniczonej istnieniem prawa swoistych odczynów.
Obraz zatruć jest zasadniczo bardzo jednostajny i diagnoza zatrucia staje się w wielu wypadkach możliwą tylko na podstawie badań chemicznych wydzielin i tkanek ustroju. Uwaga ta stosuje się jednocześnie do zmian anatomo-patologicznych.
Objawy, na podstawie których staje się możliwem rozpoznanie zatrucia z zaliczeniem chociażby tylko do pewnej grupy toksykologicznej bez szczegółowego oznaczenia trucizny, nazywamy objawami swoistemi, a przebieg zatrucia typowym. Przebieg taki daje się obserwować w przeważającej ilości wypadków. Czasem zamiast typowego odczynu rozwijają się objawy nietypowe. Najciekawszemi z pomiędzy nietypowych są: 1) działanie odwrotne, 2) zjawiska idjosynkrazji, 3) zjawiska przyzwyczajenia i 4) zjawiska allergii, złożone ze zjawisk anafilaksji i odporności.
Działanie odwrotne stanowi wyjątkowe zjawisko, obserwowane częściej po użyciu niektórych lekarstw niż w zatruciach prawdziwych. Polega ono na tem, że zamiast oczekiwanych objawów typowych, występują wręcz odwrotne. Tak np., bywają jednostki, u których chinina wywołuje podniesienie ciepłoty, u innych makowiec (opium) biegunkę, albo zamiast uspokojenia większe podrażnienie układu nerwowego, i t. p. Dla toksykologji środków bojowych jest to poniekąd szczegół obojętny.
Ważniejszą jest idjosynkrazja, ściśle zależna od wielkości dawki i wyrażająca się bądźto w niezwykłej wrażliwości na daną substancję, bądź też w równej odporności na działania pewnych trucizn. Wysoki stopień idjosynkrazji powoduje objawy niebezpieczne dla życia nawet po zażyciu środka zupełnie obojętnego dla tego gatunku. Tak naprzykład niektóre jednostki dostają obrzęków skóry, czyli tak zw. pokrzywki i dość groźnych nawet obrzęków krtani po spożyciu raków, ślimaków, poziomek i t. d. U innych spożycie wątroby wywołuje uporczywe wymioty.
Takie same zjawiska osób nadwrażliwych powoduje zażywanie pewnych lekarstw, wywołujących w małych dawkach poważne zatrucia, co najczęściej obserwowano po użyciu morfiny. Co do środków bojowych, to znane są wypadki wyraźnej idjosynkrazji w stosunku do działania na skórę iperytu oraz wytrzymałości na działanie lakrymatorów.
Zjawiska przyzwyczajenia składają się z dwóch zasadniczych cech: niezwykłej wytrzymałości na stosunkowo duże dawki trucizny i objawów swojego rodzaju głodu w razie wstrzymania się od zażycia tejże trucizny. Dawki trucizn, zażywane przez nałogowców, mogą przewyższać kilkadziesiąt razy dawki śmiertelne dla przeciętnego człowieka. Człowiek który przyzwyczaił się do pewnych trucizn, w razie zupełnej i nagłej przerwy w zażywaniu ich dostaje charakterystycznych objawów chorobowych, a mianowicie podrażnienia układu nerwowego, osłabienia czynności serca, w morfinizmie uporczywej biegunki jak w cholerze. Wszystkie te zjawiska znikają odrazu po zażyciu wystarczającej dawki trucizny. Właściwości takie posiadają przeważnie trucizny narkotyczne, używane przez ludzi całkiem świadomie; zatrucia tego rodzaju mają zawsze charakter niebezpiecznych zatruć chronicznych.
Z punktu widzenia toksykologji środków bojowych nie mają one znaczenia.
Allergja jednoczy wszystkie zjawiska powstające jako skutek jedno albo wielorazowego dostarczania do ustroju nietrujących dawek pewnych środków o właściwościach t. zw. antygenów. Podczas gdy dostarczanie trucizn wywołujących zjawiska przyzwyczajenia nie powoduje żadnych zmian składu krwi i dlatego wstrzykiwanie takiej krwi nie wywołuje powstawania odporności biernej, wszystkie postacie allergji związane są z obecnością we krwi substancyj swoistych, nieobecnych w niej w stanie normalnym i zwanych przeciwciałami. Od tych substancyj zależy stosunek ustroju do odpowiedniego antygenu. W niektórych wypadkach allergiczne zjawiska dają się zauważyć nawet w probówce.
Allergja bywa bądź czynna, zależnie od dostarczania antygenów i wyrobu przeciwciał w ustroju, bądź bierna, zależnie od otrzymania już gotowych przeciwciał, zapomocą wstrzykiwania surowicy zwierząt czynnie uodpornionych. Antygenem może być każde białko, każdy ferment, każda komórka innego gatunku, zupełnie niezależnie od sposobu ich działania na ustrój. Powstałe przeciwciała są zawsze wyraźnie swoiste, t. j. reagują wyłącznie tylko z odpowiednim antygenem. Sama reakcja może składać się: ze zjawisk odtrucia w działaniu trujących antygenów, przeważnie pochodzenia bakteryjnego; z zaniku czynności fermentów; z powstawania osadów w rozczynach białka, lub ze zlepiania się oddzielnych komórek (np. krwinek, lub bakteryj) w większe kłaczki. Przeciwciała o takich właściwościach nazywamy antytoksynami, antyfermentami, precipitynami, aglutyninami i t. d.
Sposób wprowadzania antygenów do ustroju ma ogromne znaczenie. Jednorazowe dostarczenie, chociażby zupełnie obojętnej substancji, mającej właściwości antygenu, wywołuje po upływie pewnego czasu (około dwóch tygodni) niezwykłą czułość na odpowiedni antygen, który staje się najsilniejszą trucizną. Już znikome dawki jego wywołują zapalenie spojówki i skóry, podniesienie temperatury i ogólne niebezpieczne zjawiska, aż do śmiertelnego szoku, wywiązującego się w wyniku gwałtownej reakcji całego ustroju. Zjawiska tego rodzaju zostały ustalone przez francuskiego fizjologa Richet’a i zostały nazwane anafilaksją. Czy anafilaksja istnieje w pewnym stopniu w stosunku do substancyj nie mających właściwości prawdziwych antygenów — jest sprawą jeszcze nierozstrzygniętą. Należy zauważyć jednak, że ludzie zatruci pewnemi truciznami, jak np. siarkowodorem lub iperytem, stają się o wiele czulszymi w stosunku do tych trucizn niż inne normalne jednostki. Toksykologicznie rzecz biorąc, jest bardzo ciekawe, że wyraźne zjawiska anafilaksji dają się zauważyć również podczas pewnych zakaźnych chorób przewlekłych, w których niema odporności jak np. w gruźlicy i nosaciznie. Objawy anafilaktyczne można w tym wypadku wywołać przez użycie drobnych ilości wyciągów z odpowiednich drobnoustrojów i stosować do celów djagnostycznych.
Bardzo być może, że zwiększona wrażliwość na odpowiednie trucizny, obserwowana w niektórych wypadkach zatruć chronicznych stoi w pewnym związku z omówioną wyżej formą anafilaksji, nawet wówczas, gdy trucizny te nie posiadają właściwości uczulających. W bardzo ostrożnem i powolnem doprowadzeniu antygenów w postaci częstych wciąż wzrastających (zwykle codziennych) dawek, zauważono stopniowy zanik trującego działania antygenów, stają się one bowiem środkiem zupełnie obojętnym. Zjawiska takie nazwano odpornością humoralną.
O wiele ważniejsze dla toksykologji są szczegóły działania trucizn zależne od wrażliwości gatunkowej i od zmian przejściowych ustroju. Wiadomości nasze o działaniu trucizn polegają w znacznej części na wynikach doświadczeń czynionych na zwierzętach i na uogólnieniu odpowiednich wniosków w stosunku do ludzi. Uogólnienia tego rodzaju mogą być dokonywane tylko po bardzo uważnem uwzględnieniu wszystkich właściwości omawianej substancji i sposobów jej stosowania.
Wogóle musimy jeszcze raz podkreślić, że trucizny bezwzględne prawdopodobnie wcale nie istnieją i że im bardziej złożony jest skład chemiczny trucizny, oraz ustrój, na który działa, tem więcej może powstawać trudnych do wytłumaczenia odchyleń. Ani ilość tej czy innej tkanki, ani stopień jej zróżniczkowania, ani wreszcie miejsce zajmowane przez dany ustrój w przyjętym podziale zoologicznym nie są w danym wypadku miarodajne.
Przykładów takiej swoistości działania znamy bardzo dużą ilość. Tak np., człowiek jest istotą najwrażliwszą na działanie morfiny. Pies i królik wytrzymują dawki 50 razy większe od przeciętnie śmiertelnej dla człowieka. Dawki takich trucizn jak nikotyna, cytyzyna, nawet ołów, bezwzględnie zabójcze dla człowieka, są zupełnie obojętne dla kozy. Jeż jest wyjątkowo odporny na działanie trucizn tak silnych jak kwas pruski, olej krotonowy, jad żmij i kantarydyna. Trucizny sercowe wcale nie działają na owady, jak również nie działa na nich czad. Ślimaki dobrze wytrzymują dawki strychniny zabójcze dla człowieka.
Istnieją też różnice jakościowe. Morfina, trucizna narkotyczna dla człowieka, u psów, królików, koni i kotów wywołuje zjawiska podniecenia nerwowego.
Istnieją już pewne dane porównawcze działania środków bojowych na bardziej pospolite zwierzęta.
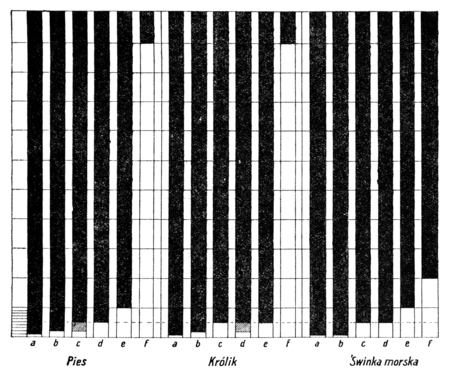
Rys. 1.
Porównanie jadowitości głównych trucizn bojowych dla rozmaitych gatunków zwierząt: a) kwas pruski, b) fosgen, c) chloropikryna, d) akroleina, e) palit, f) chlor. Wysokość białych pasków pokazuje stężenie trucizny w gramach na sześcienny metr, przy których wszystkie zatrute zwierzęta pozostają żywe.
1. Fosgen według E. K. Marschall’a zabija w ciągu 3 minut:
| psy | w stężeniu | 1,5/M3 |
| koty | ” | 1,5/M3 |
| szczury | w stężeniu | 0,9/M3 |
| świnki morskie | ” | 0,9/M3 |
| króliki | ” | 5/M3 |
| kozy | ” | 2,2/M3 |
| małpy | ” | 0,4/M3 |
2. Chloropikryna zabija w ciągu 3-ch minut wszystkie zbadane zwierzęta w stężeniu 7,4/M3. W słabszych stężeniach działających w ciągu 15′ bezwzględnie śmiertelnem jest stężenie:
| dla królików | 3,7 | w ciągu | 15′ |
| dla psów | 1,5 | ” | 15′ i 0,74 w ciągu 30′ |
| dla małp | 1,5 | ” | 15′ |
| dla kóz | 1,0 | ” | 15′ i 0,5 w ciągu 30′ |
| dla szczurów | 1,0 | ” | 15′ i 0,5 w ciągu 30′ |
3. Podajemy według danych francuskich granice stężeń bezwzględnie śmiertelnych dla całego szeregu środków bojowych. Są to stężenia ponad xg/M3.
| Psy | Króliki | Świnki morskie | |
| Kwas pruski .... | od 0,1 | 0,1 | 0,1 |
| Fosgen ...... | od 0,25 | 0,3 | 0,05 |
| Arseniak ...... | od 1,5 | 0,5 | 0,1 |
| Akroleina ..... | od 0,25 | 0,5 | 0,5 |
| Superpalit ..... | od 0,25 | 0,25 (4,0) |
— |
| Chloropikryna .... | od 0,5 | 0,25 + (0,5) |
0,25 |
| Chlorosiarczan metylu . | od 2,0 | 2,0 + (4,0) |
0,5 |
| Siarkowodór .... | od 2,0 | 0,5 + (1,0) |
0,5 (20) |
| Chlor ...... | od 5,0 | 4,25 | 2,0 |
W doświadczeniach nie udało się określić granicy stężeń, pojedyńcze zwierzęta ginęły tylko w stężeniach wskazanych w nawiasach. Słabsze stężania nie zabijały w ciągu 24 godzin i więcej (śmierć odległa).
4. Lewin podaje następujące porównawcze zestawienie jadowitości czadu.
Człowiek — dolna granica wrażliwości 0,005%; trujące (w ciągu kilku godzin) stężenia 0,06 — 0,2% — śmiertelne stężenie 0,37% i wyżej — 0,5% zabija w ciągu 20 — 30 minut.
Psy — są prawie tak samo wrażliwe jak ludzie; trujące stężenie od 0,05% — śmiertelne od 0,5% (śmierć 20 — 30 min.).
Koty są wrażliwsze od psów — natomiast świnki morskie są o wiele oporniejsze: stężenie 0,9 — 1,0% zabija je w ciągu 2 g., 2% — w ciągu 20 — 30 min., równie oporne są króliki stężenie 0,4 — 0,5% zabija je w ciągu 30 — 50 min. Najwrażliwsze są myszy i drobne ptactwo. Już stężenie 0,12% zabija je w ciągu ¾ — 1 godziny, a stężenie 4% natychmiast. Gołębie giną w atmosferze zawierającej 1,5% CO po 2 — 3 minutach.
Prócz gatunku ma również poważne znaczenie wiek zwierząt. Młode zwierzęta są naogół znacznie wrażliwsze na działanie narkotyków. Dziecko nawet jeżeli i uwzględnimy wagę jego, ginie od dawki morfiny albo alkoholu niemal zupełnie obojętnej dla dorosłego człowieka.
Różnice wrażliwości zależą ponadto od takich, zdawaćby się mogło, obojętnych czynników, jak rasa i nawet zabarwienie skóry. Murzyni są znacznie oporniejsi względem działania iperytu na skórę, aniżeli biali. Bruneci są wogóle oporniejsi od blondynów na wszystkie trucizny, a także na niektóre choroby skórne. To samo stosuje się do zwierząt. Wrażliwość rasowych psów zarówno na choroby zakaźne jak i na wszelkie trucizny jest znacznie większa od pospolitych kundlów.
Czynność trucizn jest niemniej uzależniona od różnych wahań przejściowych stanu fizjologicznego lub patologicznego ustroju. Stopień odżywienia, okres trawienia, śpiączka zimowa u zwierząt jej podlegających, ciąża — okoliczności te mogą wpływać zarówno na stopień wrażliwości jak i na skutki zatrucia. Tak np. znaczna ilość środków wywołujących skurcz macicy brzemiennej jest mało czynna w innych warunkach.
Jeszcze wyraźniejszą jest różnica działania trucizn na organizm zdrowy w porównaniu z działaniem na organizm chory. Tak np. trucizny wywołujące silny spadek temperatury po zażyciu w czasie gorączki, zażyte w okresie zdrowia okazują się pod tym względem mało czynnemi. Trucizny działające na serce są bardziej niebezpieczne w przypadkach choroby serca; to samo można wogóle powiedzieć o wszystkich truciznach z wyraźnym organotropizmem.
Ponieważ każde zatrucie jest chorobą, przeto obecność jakiejkolwiek trucizny w ustroju może zasadniczo zmienić działanie innej trucizny, wprowadzonej później.
W tych warunkach są możliwe dwa odmienne kierunki — jakby sumowanie działania obu trucizn, czyli tak zw. działanie synergiczne, albo odwrotnie powstawanie pewnych zjawisk odtrucia, czyli działanie antagonistyczne.
Są to zjawiska ogromnie ciekawe, zarówno z teoretycznego jak z praktycznego punktu widzenia.
Zjawisko synergizmu służy za podstawę do rozpowszechnionego już za dawnych czasów stosowania leczniczego niezmiernie zawiłych mieszanin zawierających połączenia kilku środków naraz zamiast jednego czynnego składnika. Tak np. do narkozy używano mieszaniny eteru, chloroformu i alkoholu, do morfiny dodawano atropiny, lub skopolaminy i t. d.
Takie synergiczne działanie jest istotnie bardziej skuteczne w zastosowaniu lekarskiem, nie ulega też wątpliwości, że w doświadczeniach toksykologicznych ma ono również swoje znaczenie, jakkolwiek naogół jest jeszcze za mało zbadane.
Synergizm trucizn bojowych nie został zupełnie wyjaśniony. W czasie wojny używanie pewnych mieszanin, jak np. chloru z fosgenem, chloru z chloropikryną, chloropikryny z siarkowodorem, chloropikryny z fosgenem, siarczanu metylu z chlorosiarczanem metylu i t. p. miało na celu zadanie tak zw. „camuflage“ czyli zamaskowanie rodzaju użytego środka, albo też dążenie do przebicia masek ochronnych. W innych wypadkach domieszki miały na celu zwiększenie trwałości zasadniczej trucizny, jak np. w słynnym francuskim ośrodku Vincennicie, który był mieszaniną kwasu pruskiego z chlorkiem arsenu i chloroformem z dodaniem ponadto chlorku cyny, dla wytwarzania dymu podczas wybuchu pocisku. W innych znowu wypadkach celem domieszki była zmiana warunków parowania (jak w razie iperytu).
Nie mamy jeszcze badań systematycznych wyjaśniających czy mieszaniny są czynniejsze od swych składników i czy w ten sposób istnieje możność wzmożenia trujących właściwości niektórych środków. O ile można sądzić na podstawie synergizmu środków terapeutycznych, przypuszczenie tego rodzaju jest bardzo prawdopodobne. Tak np.: wyraźne wzmocnienie działania kokainy zapomocą jednoczesnego użycia adrenaliny; nagłe obniżenie temperatury doprowadzające do kollapsu zapomocą połączenia trucizn wywołujących skurcze, jak np. pikrotoksyny, lub santoniny z narkotykami w rodzaju chloralhydratu lub amylenhydratu; zwiększenie hemolitycznej czynności saponinów przez jednoczesne dodanie soli amonowych i t. p. W pewnych warunkach wzmożenie jadowitości może być wywołane nawet przez dodawanie substancyj obojętnych, podobnie jak to mamy w farbiarstwie, przy używaniu t. zw. bejc, lub zapraw. Odpowiadają temu również doświadczenia Ehrlicha nad jednoczesnem działaniem pewnych barwników anilinowych i związków arsenowych.
Bardzo ciekawym przykładem zjawiska synergizmu jest niedawno ustalona właściwość cyanamidu CN—NH2, związku, który w postaci cyanamidu wapnia CN—NCa odgrywa teraz poważną rolę jako sztuczny nawóz azotowy nieorganicznego pochodzenia. Otrzymano go w wielkich ilościach przy pomocy ogrzewania w piecach elektrycznych karbidu wapnia w prądzie azotu według wzoru CaC2 + N2 = CaN2C + C.
Związek ten, będąc dość słabą trucizną, nawet w bardzo małych dawkach podnosi wrażliwość na działanie trucizn narkotycznych do tego stopnia, że naprzykład najmniejsze ilości alkoholu wywołują już prawdziwe zatrucie. To samo zauważono też i w stosunku do morfiny.
Lepiej zbadane są zjawiska antagonizmu, oddawna wyzyskane w zabiegach leczniczych celem odtrucia. Antagonizm może polegać: na niszczeniu trucizny lub na wywołaniu zasadniczych zmian w jej właściwościach — jest to tak zw. antagonizm chemiczny. Może on też polegać na przeciwieństwie działania na ustrój jako antagonizm fizjologiczny. Za przykład antagonizmu chemicznego może służyć używanie w charakterze odtrutek przeciwko kwasowi pruskiemu i innym nitrylom tiosiarczanu sodu Na2S2O2, który łączy się z niemi, tworząc niemal że obojętne rodanki; drugim przykładem mogą być sole wapnia, używane jako odtrutki w zatruciach kwasem szczawiowym, albo węglan sodowy stosowany w zatruciach kwasami wogóle.
W niektórych wypadkach przetwarzanie chemiczne trucizn nastąpić może nawet przez wywołanie różnicy rozpuszczalności. Tak np. emulsja lecytyny wstrzyknięta dożylnie może działać jako odtrutka w zatruciu chloroformem. Używając takich sposobów odtrucia nie trzeba zapominać, że organizm w żadnym razie nie może być porównany z probówką i że we wszystkich zabiegach tego rodzaju należy zwracać baczną uwagę na szybkość przebiegu reakcji, na stopień obojętności powstałych przetworów i zdolność tkanek do pochłaniania zarówno samej trucizny, jak i użytej odtrutki. Np. próby utleniania iperytu, dające dość dobre wyniki w warunkach laboratoryjnych, okazały się bardzo mało skuteczne na skórze ludzkiej.
Znacznie ciekawsze są zjawiska antagonizmu fizjologicznego. Mamy tu wynik działania dwu trucizn odmiennych co do ich właściwości toksycznych, a chemicznie zupełnie nieczynnych w stosunku jednej do drugiej. Naprzykład: serce unieruchomione wskutek zatrucia muskaryną można ożywić działaniem atropiny. Chlorek potasu powstrzymuje fermentacyjne działanie drożdży, chlorek amonu przeciwnie podnosi je; podobny stosunek znamy dla chininy i kuraryny. Antagonistami wobec gruczołów są: pilokarpina i atropina. Kurcze wywołane działaniem strychniny można złagodzić nieco przez użycie narkotyków w rodzaju chloralhydratu lub alkoholu.
Antagonizm ma zwykle znaczenie częściowe, dając się zastosować tylko do jednego z objawów, i nie posiada przeważnie znaczenia ogólnie zapobiegawczego wobec fatalnych wyników zatrucia.
Co się tyczy środków bojowych to, o ile wiadomo, nie spostrzeżono dotychczas działania antagonistycznego. Nie jest wszakże wykluczone, że zjawiska tego rodzaju dadzą się tu stwierdzić w przyszłości. Próby posługiwania się antagonizmem w celach lecznicych mają w tym wypadku takież samo znaczenie jak i w innych zabiegach, czyli posiadają tylko znaczenie zabiegów objawowych.
Truciznami, w potocznem znaczeniu tego słowa, nazywamy tylko takie substancje czynne chemicznie, które mogą wywoływać pewne zmiany, po użyciu ich w małych ilościach.
Rozpatrywanie naukowe przebiegu zatruć wymaga, aby zwrócić uwagę na zasadniczą zależność ich od wielkości dawki. Stopień rozwoju objawów, przebieg i skutki zatrucia są zależne od dwóch czynników zasadniczych, mianowicie: czasu ubiegłego od chwili zatrucia i ilości wprowadzonej do ustroju trucizny, czyli od stężenia tej trucizny we krwi. Zależność zatrucia od dawki jest jedną ze spraw w toksykologji najbardziej zawikłanych i trudnych do rozwiązania. Od wielkości dawki zależy nietylko ostateczny wynik zatrucia, lecz również obraz zatrucia oraz stopień i nasilenie objawów chwilowych.
Zmiany zachodzące w razie stopniowego podnoszenia dawki przedstawia się w sposób następujący: celem wywołania zatrucia najsilniejsza trucizna musi być zastosowana w pewnej ilości. Przez ilość trucizny rozumiemy dawkę lub stężenie, to jest stosunek ilości trucizny do rozcieńczającego środowiska, stykającego się bezpośrednio z żywemi komórkami. Środowiskiem wchodzącem tu w grę może być krew, wdychane powietrze, zawartość jelit lub tłuszcz skórny i t. d. Oczywiście, iż stężenie jest też w znacznym stopniu zależne od dawki, jednak pewną rolę odgrywają tu i inne czynniki, jako to: stopień rozpuszczalności i chemiczne właściwości trucizny, intensywność pochłaniania i wydzielania, wielkość zatrutego ustroju, a przede wszystkiem czas działania. Niektóre trucizny tworzą z białkiem krwi nierozpuszczalny osad, albo łączą się z innemi jej składnikami w związki nietrujące i dlatego posiadają działanie tylko miejscowe. Zasadnicze znaczenie ma wreszcie nietyle stężenie w środowisku, ile stężenie w odpowiednich tkankach wrażliwych lub też tylko w niektórych składnikach tych tkanek.
Ponieważ, poza nielicznemi wyjątkami stężenia w powietrzu i w wodzie, w doświadczeniach nad zwierzętami wodnemi, określenie stężenia natrafia na trudności nieprzezwyciężone, przeto zasadniczą podstawą dozometrji pozostaje dotychczas sama dawka.
Dawka może być bezwzględna to jest obliczona niezależnie od warunków, a przedewszystkiem od wagi ciała, i względna, t. j. obliczona stosownie do żywej wagi ciała. Zwykle używano do tego wzoru d/P, gdzie d jest ilością użytej dla doświadczenia trucizny w gramach, a P wagą ciała w kilogramach. O ile najściślejsze nawet określenie liczby d nie przedstawia zazwyczaj żadnych trudności, jeżeli idzie tylko o ilości wprowadzonej do ustroju trucizny, niezależnie od dalszych jej losów, o tyle określenie liczby P jest zawsze bardzo niepewne. Żywa waga ciała składa się z istotnie czynnych żywych tkanek o wyraźnej przemianie materji (mięśnie, gruczoły, system nerwowy), tkanek biernych (szkieletu, tkanki łącznej, skóry, tłuszczu), płynnych części krwi, limfy i płynu tkankowego, zawartości pęcherza moczowego i jelit. Stosunki ilościowe tych składników różnią się ogromnie indywidualnie i zależą od całego szeregu warunków, np. od stopnia utuczenia i od okresu trawienia.
Zawartość żołądka i jelit grubych królika może stanowić więcej niż 20% żywej wagi. Z czego wynika że wzór d/P niezupełnie odpowiada rzeczywistości i może być wzięty w rachubę tylko w przybliżeniu. Jesteśmy wszakże zmuszeni posługiwać się nim w braku innych lepszych danych. Omyłka wreszcie, z wyjątkiem skrajnych odchyleń od normy, nie jest zbyt znaczna, jeżeli poddajemy doświadczeniu zwierzęta w jednakowym stanie żywienia i trawienia, najlepiej po 1 — 2-ch dobach głodu — usuwając mocz zapomocą kateteryzacji. W tych warunkach P pozostaje mniej więcej jednostajne w całym szeregu doświadczeń, a tem samem wyniki obliczeń nadają się do porównania.
Co do ilości d — dawki trucizny, to trzeba też zwrócić uwagę, że ściśle określona jest tylko ilość substancji użytej w danem doświadczeniu, nie ta, która istotnie działa na żywe komórki w ustroju. Nawet w bezpośredniem dożylnem wprowadzeniu trucizny do krwi, można być pewnym wielkości dawki tylko w tych wypadkach, gdy trucizna nie zmienia swoich właściwości natychmiast, działając bezpośrednio na krew. Tak np. w doświadczeniach z solami ciężkich metali natychmiastowe tworzenie się albuminatów uniemożliwia używanie przeważających ilości tych związków. Użytecznemi pozostają jedynie związki nie działające na białko.
W większości doświadczeń mamy do czynienia ze stosunkowem stężeniem trucizny w ustroju. Jako rozpuszczalnik służy zwykle krew, której ilość ogólna jest równa 1/13 P, wskutek czego znaczenie d/P pozostaje mniej więcej niezmienne. Częściej jednak trucizny zostają wprowadzone nie bezpośrednio do krwi, lecz do przewodu pokarmowego lub do płuc razem z powietrzem oraz przez skórę, wogóle przez zewnętrzne martwe środowiska otaczające żywe tkanki.
Objętość tych środowisk nie zawsze może być określona z dostateczną ścisłością, szczególniej jeżeli chodzi o zawartość przewodu pokarmowego lub żołądka. Dlatego zalecając lekarstwa zawsze musimy zwracać uwagę, czy ma być ono użyte przed czy po jedzeniu. Nie jest również obojętne, czy dana substancja będzie użyta jako taka, czy też w mniej więcej znacznem rozcieńczeniu. Tak np. mineralne kwasy i ługi, dość bierne w stanie rozcieńczonym, w stanie stężonym stają się silnemi truciznami miejscowemi.
Wskutek tego wszędzie, gdzie tylko określenie ilości płynu rozpuszczającego, albo bezpośrednie określenie zawartości danej substancji w otoczeniu jest możliwe, o wiele wygodniejsze niż zastosowanie dość niepewnego wzoru d/P, będzie oznaczenie stężenia jako stałej wartości, charakteryzującej warunki danego doświadczenia.
Stężenie może być ustalone we krwi, środowisku otaczającem żywą komórkę, w wodzie, w razie doświadczeń nad zwierzętami wodnemi i w powietrzu, gdy mamy do czynienia ze zwierzętami oddychającemi zapomocą płuc. W pracach naukowych, o ile nie stają na przeszkodzie zbyt małe ilości trucizn używano zawsze określenia stężenia w środowisku. Przedewszystkiem wskazane jest ścisłe określanie stężenia w płynach używanych do doświadczeń. Płyny te, zwłaszcza jeżeli zostają wprowadzone do ustroju w wiekszych ilościach, powinny być izotonicznemi, (czyli mieć to samo stężenie cząsteczkowe) w stosunku do krwi danej istoty, w przeciwnym razie powstać mogą zjawiska patologiczne zupełnie niezależne od właściwości trucizny. Aby zapobiec działaniom miejscowym i ułatwić resorpcję wskazane jest używanie możliwie rozcieńczonych roztworów trucizny.
Zależność sposobu działania trucizny od stężenia niezawsze bywa jednakowo wyraźna. Wogóle stężenia podzielić można w ten sam sposób jak wielkości dawek, t. j. na stężenia nieczynne, stężenia słabe, mocne i bezwzględnie zabójcze. Dalsze powiększenie stężenia nie zmienia już wyników.
Nieczynne są takie stężenia, do których organizm może w zupełności przystosować się, bądź drogą szybkiego wydalania trucizny bądź przez zniszczenie lub przetworzenie jej w substancje obojętne. Czynnemi stężeniami są takie, wobec których wskazane procesy odtrucia niewystarczają. W tych warunkach niezniszczona lub nie wydalona część trucizny dopóty nagromadza się w ustroju, dopóki stężenie jej we krwi nie stanie się dostateczne dla wywołania pewnych objawów zatrucia. Zależnie od czasu niezbędnego do takiego nagromadzenia, stężenie nazwiemy słabem lub mocnem. Nieodwracalne uszkodzenia narządów życiowych następują zwykle wskutek działania mocniejszego stężenia. Stężenia te nazywamy śmiertelnemi (raczej względnie śmiertelnemi). Działanie trucizny wzrasta aż do stopnia, do którego organizm nie jest przystosowany i nie może nawet chwilowo się przystosować. Jest to stężenie bezwzględnie śmiertelne.
Z powyższego wynika, że wpływ odpowiedniego stężenia na ustrój zależy narówni ze stopniem stężenia od czasu działania, o ile idzie o stężenia czynne, lecz nie wywołujące natychmiastowej śmierci. Wpływ czasu znika stopniowo w użyciu nieczynnych stężeń, lub stężeń bezwzględnie śmiertelnych. Celem porównania wyników doświadczeń w warunkach różnej trwałości działania trucizn użytych w niejednakowych stężeniach, badacz niemiecki Haber zaproponował (specjalnie w dziedzinie badania środków bojowych), używanie wzoru ct, czyli iloczynu czasu działania przez odpowiednie stężenie. Tego wzoru do określania ilościowych stosunków działania trucizn używano następnie prawie wszędzie, choć w istocie rzeczy nie jest on pewniejszy od samego stężenia określonego jako zawartość trucizny w gramach na metr sześcienny powietrza, albo odpowiednio w miligramach na litr, a tem bardziej, że czas działania w danym szeregu doświadczeń łatwo jest ujednostajnić.
Jako przykład liczb Habera przytaczamy ustaloną przez niego liczbę dla pewnych środków bojowych. C w danym razie oznacza stężenie w miligramach na sześcienny metr, t czas w minutach.
Dla |
Iloczyn ct.
|
| Chloru Cl2 | 6000 |
| Bromku ksylyłu C6H5CH3CH2B2 | 7500 |
| Chloracetonu CH3COCH2Cl | 3000 |
| Kwasu pruskiego HCN (w razie słabych stężeń więcej) |
1000 |
| Superpalitu ClCO2CCl3 | 500 |
| Fosgenu COCl2 | 450 |
Trucizna jest oczywiście tem mocniejsza im mniejsza jest liczba ct.
W każdym razie do pewnego stopnia wskazane jest nieco dokładniejsze rozpatrzenie tego wzoru w stosunku do zatruć przez powietrze.
Przedewszystkiem zwróćmy uwagę, że zawartość trucizny w powietrzu otaczającem zwierzę (w komorze gazowej) i w pęcherzykach jego płuc, nie jest bynajmniej jednakowa. Stężenie w pęcherzykach jest wynikiem współdziałania dwóch czynników — wentylacji płuc i oddziaływania na skład powietrza górnych dróg oddechowych, t. j. jamy nosowej, jamy ustnej, gardzieli, tchawicy i oskrzeli. Co do wentylacji, to jest ona znowu dość złożonym wynikiem: 1) objętości życiowej płuc, czyli tej ilości powietrza, która przenika do płuc po każdym wdechu, 2) przestrzeni szkodliwej, czyli objętości samych dróg oddechowych, 3) raty oddechowej, to jest liczby ruchów oddechowych w ciągu jednej minuty. Ilość powietrza, które istotnie dosięga pęcherzyków przy wdechu, składa się z zawartości dróg oddechowych, napełnionych powietrzem pozostałem od ostatniego wydechu i z powietrza dostarczanego przez następny wdech. Stężenie trucizny w powietrzu wydychanem musi być oczywiście wskutek resorpcji w płucach mniejsze od stężenia w otoczeniu, czyli od pewnej ilości c. Jeżeli, dajmy na to, c będzie stężeniem w g/M3 w powietrzu, r współczynnikiem pochłaniania w płucach (ilość pochłaniana podczas każdego ruchu oddechowego), z objętość życiowa i s przestrzeń szkodliwa, wszystko wyrażone w ułamkach M3, to dla stężenia w powietrzu pozostałem w drogach oddechowych będziemy mieli wzór a więc dla stężenia w powietrzu, które może dosięgnąć pęcherzyków płucnych przy każdym wdechu
Wzór ten trzeba jeszcze pomnożyć przez R, czyli ratę ruchów oddechowych (ilość ich w ciągu 1 minuty) i przez t, minuty trwania zatrucia. Zatem wkońcu wzór Habera ct: stanie się wzorem
We wzorze tym z, r i R są liczbami zmiennemi, t, zależną poniekąd od woli badacza, jak również i c — zatem jedyną stałą niezależną od innych warunków pomimo wartości przedmiotu doświadczenia pozostaje s. Z stoi w odpowiednich stosunkach do R, ponieważ im częstsze ruchy oddechowe, tem mniejsza ilość powietrza przenika do narządów oddechowych przy każdym ruchu i tem gorszą jest wentylacja płuc. Liczby te podlegają łatwo zmianom już w ciągu tegoż samego doświadczenia, ponieważ podrażnienie górnych dróg oddechowych wywołuje zatrzymanie, a podrażnienie ich dolnej części przyspieszenie ruchów oddechowych.
W końcu fazy wdechu powietrze zawarte w przestrzeni szkodliwej (u człowieka około 150 cm3) zostanie całkowicie usunięte przez zazwyczaj znacznie większą ilość powietrza oddechowego (około 500 cm3). Wskutek tego drogi oddechowe napełniają się powietrzem posiadającem właściwości powietrza otaczającego, o ile właściwości te nie podlegają już zmianom przechodząc przez drogi oddechowe. Przedewszystkiem jama nosowa i gardziel uwilgotniają przechodzące powietrze, usuwając też zeń nietylko pył, lecz i niektóre trucizny. Podobne zadanie wykonywają również dolne drogi oddechowe, t. j. oskrzela i oskrzeliki. Wskutek tego współczynnik c staje się nader zmienny, a stężenie w dolnych drogach oddechowych w każdym razie mniejsze od stężenia w otoczeniu.
Takie zmniejszenie stężenia, w czasie przechodzenia powietrza zawierającego truciznę przez drogi oddechowe, tłumaczy często spostrzegany i godny uwagi fakt powstawania wyraźnych uszkodzeń tych dróg wobec bardzo nieznacznych zmian w samych właściwie płucach jak również ten szczegół, że pewne trucizny wywołują podrażnienie oczu i jamy nosowej wpierw, niż następują objawy podrażnienia krtani i oskrzeli (skurcz głośni i kaszel). Z drugiej strony nieczynność tych błon śluzowych, wynikająca z braku odpowiednich zmian anatomicznych, tłumaczy powstanie uszkodzeń samych płuc pomimo braku jakichkolwiek poważniejszych zmian dróg oddechowych jak to mamy naprzykład w razie zatrucia fosgenem.
Dla oceny wzoru ct trzeba jeszcze podkreślić, że szybko powstające zmiany anatomiczne oskrzeli i płuc — błony rzekome, ogniska niedodmy, obrzęk płuc, zapalenie i wysięki zapalne zmieniają w ciągu doświadczenia warunki w takim stopniu, że czynnik ct dla każdego mniej więcej długotrwałego doświadczenia staje się zupełnie wątpliwym.
To też nic dziwnego, że jedna i ta sama ilość ct może dać bardzo niejednakowe wyniki. Wśród pewnej liczby psów jednocześnie zatrutych w jednej komorze część ginie wkrótce po doświadczeniu, druga ciężko choruje i ginie w ciągu pierwszej albo następnej doby wskutek uszkodzeń spowodowanych zatruciem, trzecia wreszcie powraca do zdrowia. (Patrz niżej dane Underhill’a dla chloru, fosgenu i chloropikryny). Nie mamy jednak podstawy do twierdzenia, że np. liczba wyników śmiertelnych albo szybkość powstawania tych lub innych objawów będzie ściśle proporcjonalna do ct.
Na podstawie powyższego wzór ct w żadnym razie nie może być uznany nawet dla celów praktycznych za lepszy od wzoru g/M3.
Do porównania działania małych stężeń czynnik t (czas) jest wyjątkowo ważny. Określenie czasu wylęgania jest jedynym sposobem utrzymywania ścisłych danych tego rodzaju. Lecz o tych metodach badania pomówimy później. Z tego wszystkiego wnioskujemy, że bardzo dokładne określenie dawki jest zadaniem wyjątkowo trudnem, a skutki zatruć są bardzo niestałe, zmienne i zależne od całego szeregu warunków ubocznych.
Zmuszeni więc jesteśmy albo ograniczyć się określeniem doświadczalnie ustalonych granic działania pewnych dawek, lub stężeń, albo też zwrócić się do metod statystycznych, których podstawą jest teorja prawdopodobieństwa. Powszechnie znany jest fakt, że metody te stosowano już szeroko w dziedzinie biologji, mianowicie we wszystkich prawie badaniach zjawisk zmienności.
Używając do doświadczeń szeregu możliwie jednakowych zwierząt zatrutych trucizną dawaną w coraz większych dawkach, zawsze zauważymy, że staje się ona czynną i wywołuje pewne objawy chorobowe, poczynając dopiero od pewnej, ściśle określonej dawki lub stężenia, o ile bierzemy pod uwagę zmiany miejscowe. Poniżej tej granicy przez jednorazowe, krótkotrwałe użycie trucizny nie powstają żadne zmiany.
Granicę taką nazywamy progiem czynności. Ilości nieczynne w warunkach zatrucia ostrego, mogą jednakże wywołać szereg zmian zazwyczaj odmiennych od objawów swoistych dla ostrego zatrucia, jeżeli czas działania będzie bardzo długi, albo jeżeli takie nieczynne zatrucia będą powtarzane wielokrotnie jedno za drugiem. Ilość trucizny niezbędna do wywołania zmian ostrych jest zwykle bardzo nieznaczna, lecz należy pamiętać, że jest ona zawsze o wiele znaczniejsza od tych ilości pewnych obcych substancyj, które nie będąc nawet mocnemi truciznami, mogą jednak działać na komórkę żywą. Tego rodzaju działanie znikomo małych ilości trucizn w warunkach stałej ich obecności otrzymało specjalną nazwę działania oligodynamicznego. Można je zauważyć przedewszystkiem w doświadczeniach z niższemi roślinami: wodorostami, pleśniakami, bakterjami. Tak np. według danych Naegele’go woda wodociągowa, której 12 litrów pozostawiono w ciągu czterech dób z tuzinem miedzianych dwufenigówek, czyli woda z zawartością miedzi 1/77.000000 zabijała wodorost Spirogirę w ciągu jednej minuty. Według Raulina rozczyn azotanu srebra 1/1.600000, a zatem zawierający srebra 1/2500000 już jest w stanie zapobiec kiełkowaniu zarodników pleśni Aspergillus. U człowieka i wogóle u ssaków zjawiska oligodynamiczne łączą się zwykle ze zjawiskami anafilaksji lub idjosynkrazji. Tak np. zapach niektórych kwiatów jest nie do zniesienia dla wrażliwych jednostek, przeważnie dla kobiet w ciąży, wywołując nawet ataki sercowe lub długotrwałą utratę przytomności. Ilość pachnących związków w powietrzu jest w takich wypadkach znikomo mała. Odwrotnie takież same znikome ilości innych substancyj są niewątpliwie niezbędnemi dla normalnej czynności pewnych komórek. Tak np. izotoniczny rozczyn chlorku sodu nie jest w stanie przez czas dłuższy podtrzymać czynności serca żaby, lecz uzyskuje tę właściwość po dodaniu znikomych ilości soli potasu i wapnia. Skład takich obojętnych dla żywych komórek płynów zwanych fizjologicznemi, nie jest też jednakowy dla wszystkich zwierząt. Dla poszczególnych gatunków ma on skład następujący:
| I. | II. | III. | |
| NaCl | 0,65 | 0,9 | 0,8 |
| KCl | 0,045 | 0,042 | 0,02 |
| CaCl2 | 0,012 | 0,024 | 0,02 |
| NaH2PO4 | 0,02 | 0,01 | 0,05 |
| Na2HPO4 | 0,001 | — | — |
| Cukier gronowy | 0,2 | 0,25 | 0,1 |
| MgCl2 | — | — | 0,001 |
| Na2CO3 | — | — | 0,1 |
Płyn pierwszy (Ringera) jest najlepszem środowiskiem dla serca żaby, drugi (płyn Locke) — dla serca ssaków, trzeci (płyn Tyrode’a) — dla jelit królika. Czysty rozczyn soli kuchennej w stężeniu 0,75% wywołuje już po upływie 10’ prawie zupełny zanik ruchów serca. Dodanie 5 cm3 — 0, 25% rozczynu CaCl2 do 100 cm3 rozczynu NaCl wywołuje odrazu podniesienie ciśnienia krwi i bardzo powolne i silne bicie serca. Dodanie śladów KCl (1 cm3 0,1% rozczynu na 100 cm3 płynu) powoduje powrót do normalnych stosunków. Podobne oligodynamiczne stosunki są też aktualne przy działaniu już wyżej omówionych witaminów, czynnych w znikomych ilościach.
W pewnych przypadkach działanie trucizn mało różni się od omówionego działania oligodynamicznego. Tak np. kwas pruski zabija w stężeniu 0,1 na m3 powietrza. Alkaloidy protoweratryna i pseudoaconityna wywołują u człowieka niebezpieczne zjawiska i nawet śmierć, w dawkach około 0,001 t. j. w rozcieńczeniu 1/5000000, licząc, że przeciętna ilość krwi wynosi 5 litrów.
Zwykle jednak trucizny nie są tak czynne i próg ich działania stanowią dawki znacznie większe.
W warunkach stopniowego podnoszenia dawki, nie dosięgającego wszakże stopnia, w którym trucizna mogłaby się stać niebezpieczna dla życia, prędko wzrasta ilość i doniosłość zmian w ustroju. Jest to okres działania terapeutycznego, stosowanego w leczeniu niektórych chorób i dlatego dawki takie nazywają się małemi, zwykłemi, lub dużemi dawkami terapeutycznemi. Dawki, które mogą już wywołać niebezpieczne dla życia zjawiska, a w niektórych wypadkach nawet śmierć, nazywami dawkami toksycznemi. Takie zaś, po których śmierć staje się nieunikniona — dawkami śmiertelnemi czyli dosis letalis, a wreszcie bezwzględnie śmiertelnemi, jeżeli zabijają każdy ustrój. Dawka zaś toksyczna, zabijająca tylko znaczną część ofiar jest dawką względnie śmiertelną, a pierwsze skutki śmiertelne są dowodem osiągnięcia granicy wytrzymałości danego gatunku zwierząt w stosunku do trucizny. Określenie dawek leczniczych i toksycznych aż do granicy wytrzymałości stanowi treść nauki o dawkowaniu środków lekarskich. Aptekarz nie ma prawa przekraczać tak zwanej najwyższej dawki, o ile przepis lekarza nie wymaga tego stanowczo. Najwyższe dawki farmaceutyczne są bezwzględne, t. j. nie uwzględniają wagi pacjentów. Tylko dla dzieci, stosownie do wieku obowiązuje pewne zmniejszenie dawek.
W określaniu działania trucizn bojowych, zawartych w powietrzu (mg: Lt) albo: (g:M3) używamy następujących oznaczeń: 1) próg wrażliwości jest to najmniejsze stężenie dającej się zauważyć przez wyładowywanie pewnych typowych objawów, np. łzawienia albo kichania, 2) granica wytrzymałości — stężenie, które badany człowiek może wytrzymać przez pewien czas bez szkodliwych następstw, 3) stężenie toksyczne w którem występują już pewne postacie zachorowań i wreszcie 4) stężenie względnie albo bezwzględnie śmiertelne, powodujące pojedyńcze lub nagminne przypadki śmierci.
W zatruciach śmierć może nastąpić nagle, lub być skutkiem wywołanych przez truciznę zmian i nastąpić w ciągu 48 godzin po zatruciu (śmierć odległa) i wreszcie śmierć mogą spowodować powikłania powstałe po zatruciu, zwykle po upływie kilku dni a nawet tygodni (śmierć następowa). W razie stopniowego podniesienia dawki względnie śmiertelnej mamy zawsze stopniowy wzrost liczby zgonów opóźnionych.
Badanie statystyczne jadowitości polega zawsze na wykonywaniu większej ilości doświadczeń. Najprostrzy sposób polega na procentowem wyliczeniu wyników użycia określonej dawki w dostatecznej ilości przypadków. Naprzykład w badaniach amerykańskich autorów Underhill’a i Winternitz’a, psy zatruwane były środkami bojowemi (chlorem, fosgenem i chloropikryną) w różnych (słabych, średnich i mocnych) stężeniach, w ciągu jednego we wszystkich doświadczeniach czasu (30 minut) przyczem oznaczano czas, który zwierzęta przeżyły po zatruciu. Czas ten zaznaczano na osi odciętych, a liczbę zabitych psów (w procentach ogólnej ilości użytych do doświadczenia) na osi rzędnych. Jako wynik otrzymano pewne krzywe, które można nazwać krzywemi „wytrzymałości psów”.
Zasadnicze wyniki tych doświadczeń dają się streścić w sposób następujący (rys. 2):
chlor w mocnych, względnie śmiertelnych stężeniach:
zginęło
| ||
| 1-sza doba | 40% | śmierć nagła |
| 2-ga ” | 8% | ” opóźniona |
| 3-cia ” | 2% | ” ” |
| 4-ta ” | 5% | ” następowa (zapalenie płuc) |
| 5-ta ” | 2% | ” ” |
| 7-ma ” | 1% | ” ” |
| 11-sta ” | 1% | ” ” |
| 14-sta ” | 1% | ” ” |
wyżyło 40%.
| ||
Fosgen w mocnych, względnie śmiertelnych dawkach:
zginęło
| ||
| 1-sza doba | 52% | śmierć nagła |
| 2-ga ” | 10% | ” opóźniona |
| 3-cia doba | 5% | śmierć opóźniona |
| 4-ta ” | 3% | ” ” |
| 5-ta ” | 2% | ” ” |
| 6-ta ” | 1% | ” ” |
| 7-ma ” | 1% | ” wskutek powikłań |
| 8-ma ” | 1% | ” ” ” |
| 9-ta ” | 1% | ” ” ” |
| 10-ta ” | 1% | ” ” ” |
| 11-ta ” | 1% | ” ” ” |
wyżyło 22%.
| ||
Chloropikryna w stężeniu względnie śmiertelnem:
zginęło
| ||
| 1-sza doba (1-12 godzin) | 43% | śmierć nagła |
| 2-ga ” (12-24 godzin) | 21% | ” opóźniona |
| 3-cia ” | 8% | ” ” |
| 4-ta ” | 1% | ” ” |
| 11-ta ” | 1% | ” wskutek zapalenia płuc. |
| 17-ta ” | 2% | ” ” ” ” |
| 19-ta ” | 3% | ” ” ” ” |
| 22-ga ” | 1% | ” ” ” ” |
wyżyło 15%.
| ||
Krzywe tego typu dają mało danych, szczególnie gdy nie zwrócono uwagi na ścisłe określenie dawki albo stopnia stężenia. Czas przeżycia zatrutych zwierząt jest raczej miarą ich względnej odporności niż działania trucizny i w żadnym razie nie może służyć za podstawę do badań porównawczych nad truciznami. Śmierć opóźniona może być skutkiem najrozmaitszych uszkodzeń, w niektórych przypadkach przedstawiających tylko powikłania tych zatruć.
O wiele użyteczniejszem jest ustalenie dawki wywołującej pewien łatwy do określenia typowy objaw zatrucia, wykazujący osiągnięcie jednej z już wymienionych granic. Najdogodniejszemi pod tym względem są: śmierć natychmiastowa i śmierć w ciągu zatrucia oraz próg czynności.
Celem otrzymania prawdziwej krzywej jadowitości należy zatruć większą ilość zwierząt jednego gatunku wzrastającemi dawkami badanej trucizny, zaczynając od dawek, które zabijają tylko wrażliwsze jednostki (więc od progu wrażliwości). Dawki takie rozdzielamy na stopnie od pewnej najmniejszej wielkości a, do następnej różniącej się o jakąś ilość, powiedzmy 0,01. Następne stopnie będą a+0,01; a+0,02; a+0,03; a+0,04 i t. d. Stopnie te zaznaczamy na osi odciętych. Wyliczenia w odsetkach śmiertelnych wypadków odpowiadających każdej dawce, (a, (a+1) (a+2)... zaznaczamy na osi rzędnych. Wyniki tych badań można przedstawić w postaci szeregu cyfr, odpowiadających rzędnym, np. 0, 2, 3, 3, 7, 11, 29, 19, 12, 5, 3 %. Odcięte wzrastają równomiernie, jak: 1, 2, 3, 4... a odpowiednia ich wielkość jest obojętną.
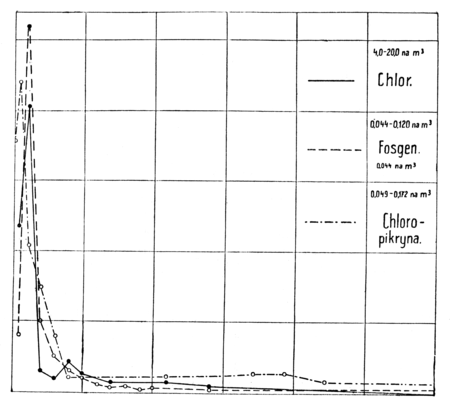
Rys. 2.
Krzywe śmiertelności psów przy zatruciach chlorem, fosgenem i chloropikryną. Razem zatruto w ciągu 30′ mocnemi stężeniami omówionych trucizn 326 psów chlorem, 260 fosgenem i 120 chloropikryną. Rzędne oznaczają % zwierząt zdechłych po upływie odpowiedniego czasu. Odcięte oznaczają czas — każda podziałka siatki równa 5 dniom. Największa ilość ginie w ciągu pierwszej doby. Późniejsze wypadki śmierci zależą przeważnie od powikłań. Krzywe wykreślono na podstawie doświadczeń Winternitz’a.

Rys. 3.
Krzywa wytrzymałości według wzoru Quetelet’a. Przy zatruciu wzrastającemi dawkami z danej ilości zwierząt ginie z początku tylko niewielka ilość najwrażliwszych, aż do pewnej średniej dawki, która jest prawdopodobną śmiertelną dawką dla danego gatunku zwierząt. Liczba zwierząt, dla zatrucia których potrzebne są większe dawki, zmniejsza się stopniowo dalej, aż do osiągnięcia bezwzględnej śmiertelnej dawki, która zabija już wszystkie zwierzęta. Odcięte oznaczają wzrastającą dawkę (okres nieśmiertelnych dawek oznaczono szerszym paskiem). Rzędne oznaczają %% ogólnej ilości użytych zwierząt zabitych odpowiednią dawką, które wytrzymały mniejsze dawki.
Z badań tak wykonanych wynika zawsze, że liczba zwierząt ginących wskutek dawek małych jest stosunkowo nieznaczna. Z podniesieniem dawki liczba wzrasta szybko do pewnego maksymum. Równolegle liczba zwierząt przeżywających spada do zera — jest to dawka bezwzględnie śmiertelna.
W takim sposobie zestawiania wyników, stopień odpowiadający najwyższej rzędnej będzie stanowił prawdopodobną dawkę śmiertelną dla danego gatunku zwierząt. Długość krzywej, czyli liczba stopni na osi odciętych, jest wyrazem wahań granic wytrzymałości na truciznę, albo też zmienności w odporności danego gatunku zwierząt.
Nieprawidłowa, mająca kilka wierzchołków krzywa wskazuje zawsze na braki doświadczenia, najczęściej na niewystarczającą ilość danych, albo na nie jednostajność materjału wziętego do doświadczeń, Krzywa wykreślona w sposób tu omówiony odpowiada krzywej prawdopodobieństwa i stanowi najlepszą i najpewniejszą metodę badań statystycznych.
Podobne dane mogą być wykorzystane do wykreślenia jeszcze innej krzywej, dogodniejszej w niektórych razach. W tym celu trzeba wyliczyć jaki procent zwierząt ginie, a jaki pozostaje przy życiu po zastosowaniu dawki odpowiadającej dajmy na to 1/100, albo 10/100 ogólnej długości osi odciętych, która wyraża dawkę bezwzględnie śmiertelną. W myśl powyższego na obydwu osiach zaznaczamy: na osi odciętych — % dawki śmiertelnej, zaś na osi rzędnych % zwierząt zabitych, wskutek czego obie osie są jednakowej długości. Otrzymujemy krzywą, która z początku idzie stromo do góry, potem staje się mniej więcej równoległa do osi odciętych, a wkońcu znów szybko podnosi się. Prawidłowa krzywa jest zazwyczaj zupełnie symetryczna i przechodzi przez środek kwadratu utworzonego przez osie odcięte i rzędne. Krzywe różnią się tylko odległością pomiędzy środkiem każdej ich połowy a linją idącą przez środek, równolegle do osi odciętych, czyli względną wielkością odcinków rzędnych; odcinki te, jak to zaznaczono wyżej, są zazwyczaj jednakowe. Stosunek pomiędzy tym odcinkiem a odległością jego podstawy do środka kwadratu (równy tgx, który tworzy z linją średnią linja idąca przez środki obu połówek rozpatrywanej krzywej) jest miarą stopnia zmienności i nazywa się wskaźnikiem odchylenia. Krzywa taka nazywa się krzywą Galton’a.
Krzywa Galton’a może być także przedstawiona w postaci szeregu cyfr dla których otrzymania potrzeba tylko dodać wielkości rzędnych krzywej Quetelet’a jedne do drugich; a mianowicie w sposób, że z szeregu 0, 2, 3, 3, 7, 17, 29, 19, 12, 5, 3, powstanie szereg: 2, 5, 8, 15, 32, 61, 80, 92, 97, 100.
Uzyskanie wystarczającej ilości danych do wykreślania podobnych krzywych jest jednak tak trudne i tak kosztowne, że dotychczas metoda ta nie wchodzi prawie w użycie, przynajmniej w badaniach toksykologicznych wykonanych na ssakach, i dlatego nie mamy dotąd zupełnie ustalonego dawkowania dla żadnej trucizny a więc i dla trucizn bojowych. Istniejące dane są raczej wynikami nielicznych doświadczeń i dlatego dawki, na które wskazują poszczególni autorowie są bardzo niejednakowe. Przedewszystkiem podkreślamy brak ścisłych danych do ustalenia dawek śmiertelnych dla człowieka. Te, które istnieją, stanowią wyniki pojedyńczych obserwacyj klinicznych, dlatego też wahają się w dużych granicach. W określeniu stopnia jadowitości środków bojowych — duszących zwykle opierano się na wynikach otrzymywanych w doświadczeniach z ssakami, jak również na obserwacjach zatruć powstałych w warunkach bojowych, określając prawdopodobne stężenie trucizny w powietrzu.

Nieco lepiej zbadane jest działanie trucizn drażniących, trucizn ośrodków odruchowych i trucizn skórnych. Dla niektórych jest już ustalony próg czynności jak również wahania wrażliwości wśród ludzi.
Zasadniczą cechą tych trucizn jest wyraźny okres wylęgania i istnienie pewnej łączności pomiędzy stopniem podrażnienia a odczynem. Podstawą jest tu znane prawo Weber-Fechnera, według którego stopień odczynu jest proporcjonalny do logarytmu stopnia podrażnienia r = algi, gdzie r jest stopniem odczynu, a i stopniem podrażnienia.
W warunkach szczególnych, gdy chodzi o określenie stopnia napastliwości trucizny przez ustalenie czasu wylęgania, wzór ten przybiera postać , gdzie x jest czasem wylęgania, Iga progiem napastliwości (najmniejsza dawka wywołująca pewne zmiany) i y stężeniem trucizny w danym wypadku (m jest współczynnikiem dowolnym).
Czas wylegania może się wahać od zera przy nieskończenie wielkiem stężeniu do nieskończoności, w razie braku trucizny w środowisku, t. j. przy stężeniu równem 0. Stężenie więc określone z formuły będzie się wahać od które już wywołuje natychmiastowy odczyn, i , gdzie x może być dowolnie wielką liczbą.
Analizę tego rodzaju doświadczeń przeprowadza się zwykle w sposób graficzny, przez wykreślenie odpowiedniej krzywej.
Krzywę tego rodzaju, zwaną logarytmiką, otrzymuje się w sposób następujący: określamy zapomocą pewnych przyrządów czas ubiegły pomiędzy chwilą dostarczania powietrza z pewną domieszką trucizny a chwilą ukazania się pierwszego objawu np.
podrażnienia oka. Zaznaczając czas wylęgania x na osi odciętych, a odpowiednie stężenie na osi rzędnych otrzymujemy pierwszy punkt naszej krzywej.
W razie innego stężenia będziemy mieli inną odciętą i inną rzędną. Dostateczne ilości doświadczeń umożliwią wykreślenie całej doświadczalnej krzywej podrażnienia.
W wypadku stopniowo spadającego stężenia krzywa ta spada dość stromo w kierunku osi odciętych, dążąc w dalszym przebiegu asymptotycznie do tej osi, również jak w początku dąży w taki sam sposób do osi rzędnych. Zastosowując liczby z wzoru y = mlg(a + x) otrzymamy możność wykreślenia krzywej teoretycznej dla każdego punktu naszej krzywej doświadczalnej i w taki sposób mamy możliwość sprawdzenia dokładności doświadczeń.

W pomiarach tego rodzaju okazało się, że każdy prawie człowiek ma swoją własną krzywą wrażliwości, czyli że w ten sposób nie możemy otrzymać jakichkolwiek stałych danych. Wszakże spotykamy dość często zarówno niezwykłą wrażliwość, wyrażającą się graficznie w tem, że krzywa rozpoczyna się bardzo blisko osi rzędnych, przedstawiając bardzo mały czas wylęgania, lub powstanie podrażnienia już w znikomych stężeniach, jak i wyjątkową niewrażliwość, wyrażającą się w odwrotnym położeniu krzywej.
Jako przykład, niech nam tu posłużą wyniki badań nad chloropikryną jako lakrymatorem według danych Fries & West’a.
Stężenie mg/m3
|
Czas wylęgania w sekundach |
||||
20 |
4; | 5; | 5; | 0,5 | Doświadczenia wykonano nad czterema osobami, z nich trzy o wrażliwości normalnej, jedna (IV) o wrażliwości zwiększonej.
|
15 |
6; | 6; | 6; | 0,75 | |
10 |
8; | 8; | 9; | 3 | |
7,5 |
9; | 10; | 17; | 4,5 | |
4 |
13; | 15; | — | 9 | |
2,5 |
18; | 30; | — | 12 | |
| I | II | III | IV | ||
Z tego wynika, że dawka, stanowiąca zasadniczą podstawę pojęcia trucizny, jest wielkością bardzo względną, zależną od całego szeregu ogromnie powikłanych warunków. Dlatego też cała nauka o dawkowaniu, czyli dozologja, w zastosowaniu tak do dawek leczniczych jak i do trujących, jest raczej zbiorowiskiem wniosków doświadczalnych, niż prawdziwą dziedziną wiedzy naukowej; zwłaszcza w stosunku do chemicznych środków bojowych, których badanie, że tak się wyrazimy, rozpoczęte zostało od wczoraj. Nawet dla takiego oddawna znanego środka jak chlor, mamy następujące wskazówki u rozmaitych autorów.
Wdychanie chloru jest niebezpieczne dla ludzi:
1. według danych przedwojennych Lehman’a i Pettenkofer’a w stężeniu 0,01—0,015 na M3. Dane te dotyczą warunków pracy fabrycznej, a więc takichch gdy robotnicy znajdują się w przestrzeni zamkniętej;
2. według Fries & West’a w warunkach wojennych w stężeniu 2,5/M3;
3. według Hilla niebezpieczne skutki są możliwe w stężeniu 10/1000000 (Vol. %) co równa się 4/M3. Bezwzględnie śmiertelne stężenie wynosi 100/M3 (1/4000 V);
4. według Mayer’a stężenie śmiertelne = 4—6M3.
Tylko badania statystyczne zakrojone na bardzo szeroką skalę są w stanie ustalić podstawy dozometrji wogóle, a w szczególności chemicznych środków bojowych.
Do celów praktycznych dane doświadczalne są zupełnie wystarczające. Próg wrażliwości i stężenia bezwzględnie śmiertelnego mogą być ustalone podług doświadczeń robionych na zwierzętach, ponieważ ludzie naogół są znacznie wrażliwsi od zwierząt.
Niemożliwą jest obecnie ogólna teorja zatrucia, któraby dawała mniej więcej dokładne pojęcie, dlaczego jedne substancje wprowadzone do ustroju mogą wywoływać niebezpieczne dla życia zjawiska, podczas gdy inne nie posiadają zupełnie takich właściwości. Cechy zatrucia są zależne nie od jakiejkolwiek jednej właściwości trucizny, ale stanowią wynik całego szeregu dodanych zjawisk, z których jedne posiadają charakter fizycznych, a drugie chemicznych odczynów. Dlatego też jakikolwiek podział naukowy trucizn jest prawie niewykonalny.
Narazie musimy zadowolnić się wyżej podanym podziałem trucizn na czynne wyłącznie w charakterze czynników fizycznych, nie ulegające żadnym zasadniczym zmianom w organizmie i takie, które podlegają tym lub innym zmianom chemicznym.
Jest to w zasadzie podstawa teorji Loewa (Natürliches System der Giftwirkungen), który jeszcze w r. 1883 zaproponował podział trucizn na katalityczne i substytucyjne — co mniej więcej odpowiada naszemu podziałowi na trucizny o
działaniu cząsteczkowem i trucizny rozkładające się w ciele chemicznie (§ 26).
Celem wytłumaczenia istoty działania tego rodzaju trucizn, a przedewszystkiem tego szczegółu, że wśród nich pewne związki, stanowiące mocne trucizny ogólne o działaniu protoplazmatycznem, są zupełnie bierne w stosunku do tkanek martwych, jak np. hydroxylamina NH2OH lub hydrazyna H2N.NH2 — O. Loew zaproponował następującą hypotezę. W skład żywej protoplazmy wchodzą liczne ugrupowania karbonilowe, C = OH’; CO’’— których w martwych tkankach nie dostrzegamy, i dlatego czynnemi w znaczeniu trucizn substytucyjnych są przeważnie związki zdolne do łączenia się z temi ugrupowaniami.
Loew podaje następujące wskazówki zależności działania związków trujących od rodzaju ich substytucji.
1. Dołączenie karboxylu (CO. OH) lub resztki kwasu siarczanego — (SO2OH) obniża toksyczność związku.
2. Zastąpienie wodoru chlorowcami podnosi ją.
3. Zastąpienie H przez grupę wodorotlenową OH obniża trujące właściwości trucizn katalitycznych — podnosi je u trucizn substytucyjnych.
4. Nitrowanie podnosi toksyczność, jeżeli temu nie przeszkodzi obecność karboxylu lub jego powstanie podczas dalszych zmian danej substancji w ustroju.
5. Każda zmiana w budowie cząsteczki trucizny, która potęguje jej zdolność do łączenia się z aldehydami i ketonami, a więc przedewszystkiem amidacja, podnosi jej właściwości trujące.
6. Wszystkie związki nienasycone są jadowitsze od odpowiednich związków nasyconych. Etylamina CH. CH. NH₂ jest trucizną bardzo słabą, wtedy gdy winylamina CH3. CH2. NH2 jest wyjątkowo czynną. Wyjątkowo wysoce trujące właściwości winylaminy tłumaczono później jako skutek wytwarzania się z niej połączenia cyklicznego:
| H2C | |
| ǁ❭ | NH. |
| H2C |
Uogólnienia teorji Loewa stały się podstawą całego szeregu dalszych badań, jak również podstawą teraźniejszego sposobu tłumaczenia działania pewnych związków, przyjmując istnienie t. zw. „ugrupowań toksofornych“ Erlicha, o których będzie jeszcze mowa później. Z tych prawideł jednakże mamy liczny szereg wyjątków i stosunki te są znacznie bardziej złożone niż wydaje się na pierwszy rzut oka. Wogóle znaczenie ugrupowań substytujących zmienia się prawie dla każdego szeregu związków, jak i w każdym poszczególnym odczynie fizjologicznym.
Teorja ta może znaleźć zastosowanie, i to tylko częściowo, jedynie w wytłumaczeniu działania pewnych związków organicznych, pozostawiając niewytłumaczonem działanie trucizn nieorganicznych i całego szeregu mocnych trucizn organicznych, nie stojących w żadnym stosunku do ugrupowania karbonylowego CO’’.
Bardziej odpowiednia jest teorja ogólnego przystosowania się ustroju, oparta na zasadach biologicznych doby obecnej. Zasadniczą ideą tej teorji jest, że każda obca substancja, nie należąca do stałych składników ustroju, każdy niezwykły dla organizmu czynnik, muszą zawsze stwarzać warunki patologiczne niebezpieczne dla życia, o ile organizm nie potrafi się do nich przystosować.
Dlatego wszystkie pierwiastki nie będące stałemi składnikami ciała (p. § 29) są mniej więcej trującemi. Stwierdzamy to, badając działanie rzadkich, lub mało rozpowszechnionych pierwiastków.
Ustrój żywy w pierwszych okresach swego istnienia przystosował się do pewnych składników, najprawdopodobniej zupełnie przypadkowo, ponieważ były one obecne w miejscu pierwszego powstania życia, i dlatego w niem uczestniczyły. Dziś ustrój żywy już nie jest w stanie wytrzymać żadnej zamiany jednych pierwiastków na drugie, nawet najbardziej do nich zbliżonych chemicznie. Tak np. brom nie może zastąpić chloru lub innych chlorowców, pomimo faktu dobrze znanego, że organizm może wydzielać w soku żołądkowym HBr zamiast HCl. Stront, który nie jest bardziej jadowitszym od wapnia, nie może zastąpić go jako składnik tkanki kostnej. Potas odgrywa w ustroju całkiem inną rolę niż sód i t. d.
Ilościowy skład organizmu jest zatem wynikiem pewnych przystosowań i, zależnie od warunków, wogóle podlega zmianom. Mamy tu również urzeczywistnienie znanych praw Virchow’a o zjawiskach chorobowych. Każde takie zjawisko posiada pewien stopień heterotopji, heterometrji i heterochronji, to znaczy, że różni się ono od normalnych stosunków obecnością pewnych związków jakościowo takich samych jak w stanie normalnym, lecz umieszczonych w innem miejscu, bądź nagromadzonych w odmiennej ilości, lub wreszcie pojawiających się w innym czasie. W istocie nawet taki zwykły składnik organizmu jak woda, staje się oznaką stanu chorobowego, jeżeli nagromadza się jako wysięk w jamach surowiczych, lub jeżeli zawartość jej we krwi ulegnie zbyt wyraźnej zmianie, albo jeżeli tkanki dorosłego człowieka staną się podobne pod względem zawartości wody do tkanek zarodka, zawierającego powyżej 90% wody. Trujące pierwiastki, jak jod i żelazo, mogą być w nieznacznych ilościach niezbędnemi składnikami organizmu; sam organizm może zawierać w odpowiedniem miejscu i odpowiedniej postaci ilość trucizn zupełnie wystarczającą dla jego otrucia w innych warunkach. Tak np. czerwone krwinki zawierają duże ilości potasu, zazwyczaj prawie całkiem nieobecnego w osoczu krwi. Jony potasu są bardzo mocną trucizną nasercową i dlatego każda znaczniejsza hemoliza, t. j. rozpuszczenie krwinek w osoczu, wywołuje zawsze niebezpieczne zjawiska w sercu i może nawet spowodować porażenie serca. Pewne hormony ustroju, jak np. adrenalina, są najmocniejszemi ze znanych trucizn.
Z punktu widzenia tej teorji podstawą zatrucia bywa: 1) obecność zupełnie obcych pierwiastków, czyli jakościowe zmiany w środowisku otaczającem komórki, albo nawet micelle; 2) ilościowe zmiany stężenia normalnych składników i 3) powstawanie w ustroju odczynów, do których dany ustrój nie jest przystosowany. Wynik śmiertelny lub ostra choroba, która może skończyć się wyzdrowieniem, lub długotrwałą kacheksją — wszystkie te zjawiska zależą raczej od rodzaju odczynów ustroju i jego zdolności do zrównoważenia zmian wynikłych podczas zatrucia, niż od bezpośrednich właściwości trucizny.
Biologiczne właściwości substancyj obcych przedstawiają się w zarysach następujących:
1. każda substancja obca pozostaje nieczynna, jeżeli jest bezwzględnie nierozpuszczalna w płynach ustroju. Najmniejsza rozpuszczalność jak np. ciężkich metali w wodzie, może się stać przyczyną ich jadowitości, dzięki istnieniu wpływów oligodynamicznych.
2) Każda substancja rozpuszczalna może stać się niebezpieczną dla organizmu tyko przez prostą zmianę warunków fizykochemicznych organizmu. Dlatego ustalenie grupy trucizn katalitycznych nie ma wartości.
3) Działanie chemiczne każdej substancji zależy od właściwości składników organizmu, z któremi substancja ta może wstępować w związki, 4) Każdy z takich odczynów jest mniej więcej niezależny od innych odczynów organizmu i dlatego substancje czynne w jednym kierunku mogą być zupełnie bierne w innem, prócz tego i sam szereg wzrastającej czynności substancyj obcych musi być bezwzględnie inny dla każdego takiego odczynu.
Dlatego właśnie wszelkie próby podziału trucizn stosownie do jadowitości na podstawie dawki śmiertelnej chybiłyby celu. Nie może być żadnego ugrupowania trucizn w tem znaczeniu nawet dla zwierząt tego samego gatunku. Dane o dawkowaniu mają zaledwie przybliżoną wartość praktyczną.
5) Odczyny chemiczne w zatruciu mogą mieć znaczenie ogólne, gdy wywołują jednakowe skutki w każdym wypadku, mogą też być mniej więcej swoistemi, działając tylko na część substancyj, lub nawet na jedyną w swoim rodzaju substancję obecną w organizmie. Dlatego stopień jadowitości ustalony w stosunku do jednego odczynnika, np. jakiegoś zaczynu, nie jest bynajmniej miarodajny dla drugiego.
Ogólna analiza naukowa działania pewnej substancji na organizm składa się z ustalenia jej stosunku do następujących odczynów fizjologicznych:
a) podtrzymania stanu fizycznego tkanek i płynów ustroju (ciśnienia osmotycznego, stopnia adsorpcji wody, napięcia powierzchniowego, lepkości i t. d.).
b) Podtrzymania stałości odczynu środowiska. Organizm łatwo może zrównoważyć nadmiar jonów OH’, lecz jest bardzo czuły na nadmiar jonów H’. Dlatego każda substancja zawierająca te jony, lub wytwarzająca je pod wpływem utleniania, wywołuje zjawiska acidozy, zwykle odrazu zrównoważane przez organizm.
c) Działania na białka. Działanie to może być odwracalne i zależne od zmian warunków rozprószenia białek jako koloidów (szereg Hofmeistr’a) albo nieodwracalne, polegające na głębszych zmianach chemicznych powodujących przedewszystkiem skrzepnięcie białek, jak np. działanie wszystkich ciężkich metali w stanie jonów.
d) Działanie na zaczyny, które może być zarówno dodatniem (aktywacja fermentów), jak i ujemnem (trzucizny zaczynów). Każdy zaczyn ma swoje własne środki uczynniające (aktywatory) jak również i trucizny.
e) Działania na lipoidy. Są one dotychczas bardzo mało zbadane, chociaż posiadają bez wątpienia poważne znaczenie w szeregu odczynów najbardziej złożonych. Jako przykład można przytoczyć współdziałanie pomiędzy lecytyną a saponinami, trucizną żmii i toksynami bakteryjnemi, jak również rolę odgrywaną w organizmie w procesach odtrucia przez cholesterynę.
f) Działania na ustroje jednokomórkowe, chwilowe porażenie (zanik ruchów wymoczków) lub śmierć.
Każdy rodzaj drobnoustrojów posiada odporność i wrażliwość swoistą. Dla pasorzytów wyżej stojących, należących do pierwotniaków, jak np. pasorzyty zimnicy, kiły, pewnych chorób podzwrotnikowych (trypanosomiazy), mamy wyraźny etiotropizm, czyli drobnoustroje te są wrażliwsze na działanie niektórych środków, niż komórki chorego organizmu, wskutek czego można je zabić w żywym ustroju. Takiemi zabójczemi dla nich środkami są: chinina, pewne organiczne pochodne arsenu i niektóre barwniki anilinowe. Jednakże dla większości drobnoustrojów mamy stosunek odwrotny, niektóre ustroje są wogóle najbardziej odporne wśród żywych komórek, szczególnie gdy znajdują się w stanie zarodników, np. zarodniki wąglika (Baccillus anthracis). Takich najodporniejszych tworów używamy zazwyczaj do sprawdzania działania tego rodzaju trucizn, noszących nazwę antyseptycznych. Istnieje szereg trucizn o wzrastającem znaczeniu antyseptycznem swoistem dla danego gatunku drobnoustrojów (bakteryj) niezależnie od innych właściwości tych trucizn. Wogóle środki antyseptyczne prócz bakteryj zabijają też inne komórki, naodwrót większość najmocniejszych trucizn, jak np. trucizny układu nerwowego, jest bezwzględnie nieczynna w stosunku do bakteryj.
g) Działanie na izolowane komórki organizmów wyższych, jak np. nabłonek migawkowy, plemniki, leukocyty, których zatrucie łatwo daje się zauważyć w postaci zaniku ruchów i zwłaszcza na krwinki czerwone, których uszkodzenie wywołuje hemolizę. Chwilowe osłabienie lub zanik ruchów (paraliż odwracalny) jest cechą działania trucizn narkotycznych, a stały zanik przejawów życiowych — cechą tak zw. trucizn protoplazmatycznych, czyli komórkowych; rozpuszczenie się w otaczającym płynie jest oznaką przejaw cytolitycznych, a w stosunku do krwinek — hemolitycznych.
h) Działania na izolowane narządy; bardzo dogodnemi przedmiotami dla doświadczeń porównawczych są:
1. tak zw. nerwowo-mięśniowy preparat żaby;
2. izolowane serce żaby lub żółwia, używane bez specjalnych przyrządów lub z zastosowaniem pewnych przyrządów zwanych hematizatorami;
3. izolowane serce, płuca, jelita, nerki, macica i inne narządy ssaków, których użycie w tym celu stało się możliwe dzięki udoskonaleniu wspomnianych hematizatorów. Na izolowanych narządach zauważyć można nietylko zwykłe i dające się łatwo wymierzyć przejawy życiowe, lecz także i jakościowy ich charakter.
Ponieważ porażenie serca jest najczęstszą przyczyną śmierci, badania nad działaniem trucizn na serce izolowane dają w wielu wypadkach obraz istotny zatrucia zwierząt. Badania te są prócz tego pewniejsze i dogodniejsze do przeprowadzenia porównań niż wszystkie inne.
i) Działania na ośrodkowy układ nerwowy, co da się zbadać tylko w warunkach doświadczeń na całym ustroju. Często jesteśmy zmuszeni używać do tego celu nawet ludzi. Tylko w ten sposób bowiem można zbadać środki działające na wrażliwość psychiczną, wywołujące sen, znieczulenie miejscowe i t. d. Doświadczenia czynione na zwierzętach są jednak niezbędne, już chociażby dlatego, że porażenie ośrodka oddechowego, druga zasadnicza przyczyna śmierci, może być zbadana tylko w ten sposób. Ilość kierunków, w jakich da się przeprowadzić podobne doświadczenia, jest niemal nieograniczona.
k) Działania na wytwarzanie i oddawanie ciepła. Są to również bardzo złożone zjawiska, związane ze zmianami układu nerwowego, jak również ze stanem ogólnej przemiany materji. Znanym jest cały szereg trucizn wywołujących obniżenie ciepłoty zwierząt ciepłokrwistych (środki antypyretyczne), w przeciwstawieniu do szeregu środków podnoszących ciepłotę ciała, np. tetrahydronaftylamina.
l) Działania na ogólną przemianę materji, które może spowodować wzmożenie tej przemiany, czyli natężony rozkład materji lub też zatrzymanie całego rozkładu. Działanie to jest charakterystyczne dla wielu trucizn; niektóre z nich mogą działać też w innych kierunkach, ale są i takie, dla których ten objaw jest zasadniczy.
Stąd wynika, że ogólnego działania trucizny nie możemy zdefinjować, możemy jedynie ustalić jej wpływ na poszczególne odczyny życiowe, lub właściwości ustroju.
Do badań porównawczych niezbędne jest ustalenie siły działania, dla której miarodajną jest nie bezwzględna lub względna dawka, lecz wyłącznie tylko odpowiednie stężenie. Żeby uniezależnić stężenie od właściwości chemicznych i składu badanych ciał, mając na względzie, że niezależność taka jest podstawą badań porównawczych, przy ustalaniu roli zmian budowy chemicznej przyjęto zamiast zwykłego oznaczenia dawki, używać oznaczenia stężenia w grammolekułach na litr rozczynnika (wody, powietrza) lub kilogram wagi ciała. Stężenie rozczynu zawierającego jedną grammolekułę na litr przyjmujemy za 1, każdy inny rozczyn będzie miał stężenie n/m, gdzie n jest ilością gramów w litrze rozczynu, (więc stężenia w zwykłym oznaczeniu) a m — ciężar cząsteczkowy.
Dla porównania działania badanej substancji najwłaściwiej jest przyjąć za jednostkę stężenie cząsteczkowe jakiejkolwiek trucizny danego szeregu i podzielić przez tę liczbę odpowiednie stężenie innych trucizn. Im prostszy i mniej zależny od warunków jest obserwowany odczyn, tem pewniejsze będą wyniki takiego porównania. To samo można powiedzieć o znaczeniu składu chemicznego. Najskuteczniejsze jest porównywanie wpływów zmian nieznacznych w budowie molekuły, ponieważ w takich warunkach jesteśmy uprawnieni do oczekiwania, że treść działania pozostanie niezmieniona.
Z pośród olbrzymiej ilości istniejących prób porównania działania poszczególnych trucizn tylko bardzo nieliczne odpowiadają wskazanym wyżej warunkom. Tem niemniej użyteczność wyłuszczonych podstaw z najzupełniejszą wyrazistością wynika z ich zestawienia.
Jako przykład przytoczymy ciekawe wyniki badań Reid-Hunt’a nad jadowitością nitrylów, pochodnych kwasu pruskiego, wywołującego jako objaw zasadniczy porażenie ośrodka oddechowego. Doświadczenia były dokonane na myszach.
Nazwa |
Wzór |
Ciężar mol. |
m/gm
|
Szereg jadowitości=G/L (mol. HCN=I) |
| Kwas pruski | H CN
|
27 | 0,005 | I
|
| Acetonitryl | CH3CN
|
41 | 0,700 | 92,2
|
| Benzonitryl | C6H5CN
|
103 | 0,18 | 9,5
|
| Tolunitryl | C7H7CN
|
117 | 0,032 | 1,47
|
| Nitryl migdałowy | C7H7O. CN
|
133 | 0,023 | 0,93
|
| Chlorowodorek dwuetyloaminoacetonitrylu | CH2 ⟨ | CN N(C2H5)2H.Cl |
148,5 | 0,031 | 1,09 |
| Dwuetyloaminofeniloacetonitryl | C6H5.CH ⟨ | CN N(CH) |
188 | 0,025 | 0,73 |
Z zestawienia wnioskujemy, iż jadowitość tych związków nie jest zależna od ich ciężaru cząsteczkowego i budowy cząsteczki, lecz od jakiejś innej przyczyny, która według Reid-Hunt’a tkwi w łatwości rozszczepiania się w ustroju lub odwrotnie w stałości związku. Możemy podkreślić również, że pochodne aromatyczne są czynniejsze niż tłuszczowe.
Inny przykład daje działanie lakrymatorów, t. j. chemicznych środków bojowych wywołujących łzawienie.
Środki te można według ich budowy chemicznej podzielić na następujące grupy:
1. pochodne acetonu,
2. pochodne benzolowe (aromatyczne),
3. grupa chloropikryny.
Do pierwszej grupy należą: akroleina CH2=CH−CO−H; chloroaceton CH3. CO. CH2Cl; bromaceton CH3CO. CH2Br i chloroacetofenon CH2ClCO C6H5,
do drugiej: chlorowane i bromowane pochodne benzylu i ksylylu,
do trzeciej: jedna tylko chloropikryna.
Chloroacetofenon jest jednocześnie pochodnym aromatycznym i acetonowym. Cedenit NO2C6H4CH2 Cl zawiera, jak i chloropikryna, grupę nitro NO2.
Przeliczone zgodnie z omówionemi zasadami współczynniki napastliwości tych środków w stosunku do napastliwości kamitu są następujące.
Czynne stężenie cząsteczkowe
|
Stopień napastliwości
| |||
| Kamit C6H5.CH(CN)Br | 14.10-10 | 1
| ||
| Bromek ksylilu C6H5.CH3CH2Br | 90.10-10 | 6,6
| ||
| Bromek benzylu C6H5CH2Br | 230.10-10 | 16,4
| ||
| Chloraceton | CO ⟨ | CH3 CH2Cl |
2100.10-10 | 1,50
|
| Bromaceton | CO ⟨ | CH3 CH2Br |
700.10-10 | 50,0
|
| Akroleina H. CO. C2H2. | 2142.10-8 | 153,0
| ||
| Chloropikryna CCl3NO2 | 1230.10-10 | 87,8
| ||
| Cedenit C6H4NO2CH2 Cl | 100-10 | 7,14
| ||
| Chloroacetofenon | CO ⟨ | C6H5 CH2Cl |
33.10-10 | 2,7
|
Musimy podkreślić, że i ten sposób porównania stopnia czynności stosownie do stężenia cząsteczkowego, jest tylko przybliżony. Zupełnie niewiadomemi pozostają zarówno losy dostarczonej trucizny, jak i treść wywoływanych przez nią zmian chemicznych, więc przedewszystkiem ilość powstałych w danym wypadku czynnych równoważników. Rozczyn substancji zawierający jedną grammolekułę na litr nie jest obowiązkowo równoważnikiem drugiego takiego rozczynu, jak to wiemy z chemji analitycznej. Dlatego uzależnienie siły działania od stopnia stężenia może się okazać bardziej powikłane niż można byłoby się spodziewać na pierwszy rzut oka.
Zupełnie pewne dane można otrzymać tylko w wypadkach, kiedy chemiczne losy danej substancji w ustroju są ściśle ustalone.
Na tych zasadach toksykologji porównawczej powstanie w przyszłości prawdopodobnie prawdziwe dawkowanie naukowe, obecnie prawie nie istniejące, pomimo olbrzymiej ilości surowego materjału oraz pewnych bardzo ciekawych uogólnień doświadczalnych. Tylko prawdziwa chemja toksykologiczna mogłaby dostarczyć podstaw zarówno do ściśle naukowego podziału trucizn, jak i do celowej syntezy związków posiadających potrzebne do pewnych celów właściwości.
Jednakże w chwili obecnej możemy już dać pewne wskazówki istnienia stałej zależności właściwości trujących, chemicznie czynnych, substancyj od:
1. jakościowego ich składu, obecności tych czy innych pierwiastków,
2. obecności w składzie cząsteczki pewnych ugrupowań, 3. wartościowości pierwiastków tworzących związek,
4. rodzaju połączeń pomiędzy atomami, przeważnie wśród związków organicznych,
5. budowy stereochemicznej związku.
Celem ustalenia zależności działania toksycznego od składu jakościowego, musimy przedewszystkiem zaznajomić się z działaniem na organizm samych pierwiastków, w stanie zarówno cząsteczkowym jak i zjonizowanym.
Trujące właściwości pierwiastków zależą przedewszystkiem od ich zdolności do reagowania z płynami organizmu i tworzenia związków rozpuszczalnych w jego składnikach. Pierwiastki nierozpuszczalne są zupełnie nieczynne. Jako rozpuszczalniki występują jednak nietylko sama woda lecz też lipoidy i inne składniki komórek ustroju, co może w znacznym stopniu zmienić warunki. Następnie działanie każdej nierozpuszczalnej substancji zależne jest od stopnia jej dyspersji. Koloidalne rozczyny niektórych pierwiastków, np. srebra i rtęci, posiadają właściwości, których brak ich suspensjom, a działanie tych rozczynów jest zbliżone do działania jonów.
Co do czynności, stosownie do rozpuszczalności pierwiastków w płynach lub innych składnikach organizmu, posiadamy następujące dane.
Gazy szlachetne, grupy 0 systemu perjodycznego — hel, argon, neon, krypton i xenon, jako bezwzględnie bierne chemicznie, pozostają też w ustroju nieczynne. Z innych pierwiastków mających w zwykłych warunkach postać gazu zupełnie biernemi i nierozpuszczającemi się we krwi stosownie do prawa Henry Dalton’a są wodór i azot. Tlen jest ciałem bardzo czynnem już w stanie wolnym (odczyny utleniania); również bardzo czynnemi są wszystkie chlorowce, które reagują z wodą i tworzą odrazu czynne jony. Inne metaloidy, mające postać ciał stałych, prócz nielicznych wyjątków, są nierozpuszczalne i dlatego zachowują się biernie. Można podzielić je, stosownie do ich umieszczenia w systemie perjodycznym, na trzy grupy: pierwiastki czterowartościowe: węgiel, krzem, tytan; pierwiastki trój- lub pięciowartościowe: (azot, fosfor, vanad, arsen, antymon, bismut), i pierwiastki dwu, cztero lub sześciowartościowe (tlen siarka, selen i telur). Z tych pierwiastków jeden tylko fosfor, i to wyłącznie w postaci białego krystalicznego fosforu, stanowi już w stanie cząsteczkowym mocną truciznę, o niewiadomem co do treści działaniu katalitycznem. Fosfor nie jest bezwzględnie nierozpuszczalny w wodzie, a tem bardziej w żółci. Rozpuszczalność jego jest 0,000127, stosownie 0,02411%. Dzięki temu może on przeniknąć do lipoidów wewnątrz-komórkowych. Trująca właściwość jego jest zależna od stopnia dyspersji. Gdy 0,1 fosforu w stanie emulsji (pasta fosforowa) zabija napewno dużego psa, kilka gramów tegoż fosforu w kawałkach przechodzi przez przewód pokarmowy bez żadnych złych następstw.
Zdolnemi do powolnego reagowania w ustroju — są siarka, selen i tellur, z których siarka, szczególnie w stanie delikatnego proszku, tak zw. mleka siarkowego (lac sulfuris) łączy się w jelitach z wodorem i zasadami, tworząc siarczki, podlegające następnie utlenieniu, a selen i tellur, w stanie rozczynów koloidalnych wstępują w połączenie z rodnikami alkoholowemi, tworząc dwumetyloselen i dwumetylotelur Te(CH3)2, i Se(CH3)2. Selen i tellur posiadają pewne właściwości trujące. Koloidalne ich rozczyny znajdują zastosowanie jako środki przeciw nowotworom, ponieważ przypuszczalnie mogą one hamować wzrost tkanek.
Inne pierwiastki nie mogą istnieć w ustroju jako takie, gdyż w obecności wody tworzą natychmiast zjonizowane związki, wobec tego zawarte są w ustroju tylko w stanie jonów i tworzą związki rozpuszczalne.
Takie właściwości wśród elektroujemnych pierwiastków, zawartych w ustroju, w postaci anionów posiadają przedewszystkiem chlorowce F, Cl, Br, J. Inne aniony, pochodne metaloidów, są zwykle mniej więcej złożonemi połączeniami z innemi pierwiastkami, przeważnie z tlenem i działanie ich już nie jest działaniem pierwiastków jako takich. Wogóle wpływ anionów na czynność odpowiedniego związku jest niewyraźny. W tych wypadkach, gdzie z porównania czynności można ustalić istnienie takiej zależności, nie zawsze odpowiada ona zasadniczemu uogólnieniu, że jadowitość pierwiastku wzrasta równolegle do jego ciężaru atomowego. Uogólnienie to sprawdza się dość wyraźnie w szeregu: S; Se; Te; lub N; P; V; As; Sb; Bi; lecz dla chlorowców F; Cl; Br; J istnieją stosunki odwrotne.
Pierwiastki, mające właściwości metali, występują w organizmie w charakterze katjonów. Środowiska naszego ciała składają się z płynów zawierających zawsze pewien nadmiar jonów wodoru, wskutek powstających ciągle pod wpływem utlenienia kwasu węglowego i innych kwasów organicznych. Płyny ustrojowe występują w roli kwasów i dlatego wszystkie pierwiastki metaliczne serji elektrochemicznej, znajdujące się poniżej wodoru muszą być rozpuszczalne w organizmie i mogą istnieć w nim w małych stężeniach prawie wyłącznie tylko stanie jonów, albo związków nierozpuszczalnych. Pewna część metali reaguje bezpośrednio z wodą już w temperaturze ciała, są to: Cs, Rb, K, Na, Li, Ca, Sr, Ba. Łatwo rozpuszczalnemi w organizmie są też Mg, Zn, Cd — znacznie odporniejszemi są chrom, żelazo i jeszcze bardziej odpornemi — kobalt, nikiel, cyna i ołów.
Pierwiastki niezdolne do wytworzenia wodoru pod wpływem działania słabych kwasów są prawie nierozpuszczalnemi. Są to: miedź, rtęć, srebro, palad, platyna, złoto. Dlatego są one czynne tylko w razie gdy zostały użyte w stanie związków zjonizowanych.
Gdy jesteśmy zmuszeni wydać sąd o działaniu pierwiastka, mamy do czynienia nie z cząsteczkami, lecz z atomami, które tworzą proste, złożone lub zespolone jony, albo wreszcie występują jako składniki związków niezjonizowanych (nieelektrolity, w niektórych razach wodór, wszystkie metale, a z metaloidów chlorowce). Jony te są prostemi atomami pierwiastków, które albo straciły swój elektron (ujemny nabój elektryczny) albo też dołączyły go. Pierwsze są katjonami mającemi nabój dodatni, drugie anjonami, mającemi nabój ujemny.
W innych wypadkach w roli anjonów występują połączenia kilku pierwiastków jednocześnie, jak np. ClO4, SO4, NO3, HS, CNS i t. p. Jeżeli w skład takiego anjonu wchodzi pierwiastek, który zwykle wchodzi w skład katjonów, lub jeżeli budowa chemiczna takiego anjonu nie układa się w ramy zwykłej wartościowości związków typowych, jak wymienione wyżej, mówimy o jonach zespolonych. Przykładem takich jonów są jony żelaza i żelazocjanków (FeCy6)IV i (FeCy6.)III, w których nie można zosobna ustalić ani żelaza ani cjanu. Złożone i zespolone jony mają swoje właściwości, w których trudno jest zauważyć właściwości pierwiastków, z których są złożone. Okoliczność ta wywiera rozstrzygający wpływ na ich oddziaływanie na organizm. A więc znane żelazocjanki nie posiadają ani właściwości trujących cjanków, ani właściwości jonów żelaza, które w postaci jonów zarówno Fe’’ jak i Fe’’’ jest dość silną trucizną.
Wogóle stosunek jonów do odczynów w organizmie jest nieco inny, niż cząsteczek ciał prostych lub związków niezjonizowanych. Jak już wspomniano stosunek ten niezupełnie wyraźny dla anjonów jest bardziej określony dla katjonów. Jeszcze w połowie zeszłego stulecia Black i Rabuteau ustalili ogólne prawo, według którego trujące właściwości metali wzrastają równolegle z ich ciężarem cząsteczkowym. Ponadto zauważono już wtedy że istnieją mniej więcej prawidłowe stosunki pomiędzy członkami grup podobnych, dających pochodne o charakterze izomorficznym (formy krystaliczne, mogące pobudzać roztwory swych analogów do krystalizacji). W dalszym ciągu, po ustaleniu systemu perjodycznego, okazało się, że tego rodzaju ugrupowanie trucizn odpowiada mniej więcej grupom tablicy Mendelejewa. Jakościowe szczegóły, typowe dla działania przedstawicieli danej izomorficznej grupy lub dla klasy systemu perjodycznego, okazują się zasadniczo jednakowemi. Dla pierwiastków ze zmienną wartościowością (żelazo, cer) zauważono, że jadowitość wzrasta razem z wartościowością. Jon Fe’’’ jest według Balck’a 80 razy jadowitszym od Fe’’, Ce’’’ 12 razy od Ce’’.
Można przyjąć, że najjadowitsze metale należą do pierwiastków o największym ciężarze atomowym. Są to bar (137), rtęć (200,6), tal (204), ołów (207) i uran (238). Nieczynność pewnych pierwiastków ze znacznym ciężarem atomowym, jak np. toru, tantalu i bizmutu, zależy od małej rozpuszczalności związków powstających w organizmie. Srebro (107), złoto (197) i grupa metali platynowych, należą do działu wyraźnych trucizn.
Dane Black’a są bardzo ciekawe jako pierwsza próba ustalenia pewnej łączności pomiędzy właściwościami pierwiastków a ich względną jadowitością. Przytaczamy je poniżej wraz z obliczeniem względnej dawki Black’a w stężeniu cząsteczkowem.
| Nazwa pierwiastka | ciężar at. | dawka śmiertelna g/kg | stężenie cząsteczkowe. | |
| I | Lit | 7 | 1,2 | 0,17 |
| Rubid | 85 | 0,12 | 0,0014 | |
| Cez | 133 | 0,12 | 0,0009 | |
| Srebro | 108 | 0,12 | 0,00026 | |
| Złoto | 196 | 0,028 | 0,000015 | |
| II | Beryl | 9 | 0,023 | 0,0025 |
| Glin | 27 | 0,007 | 0,00026 | |
| Żelazo (Fe’’’) | 56 | 0,004 | 0,00007 | |
| Ytr | 90 | 0,004 | 0,000036 | |
| Cer (Ce’’’) | 140 | 0,005 | 0,000036 | |
| III | Bar | 136 | 0,08 | 0,0006 |
| Cer (Ce’’) | 140 | 0,062 | 0,0004 | |
| Tor | 231 | 0,034 | 0,00014 | |
| Magnez | 24 | 0,97 | 0,04 | |
| Żelazo (Fe’’) | 56 | 0,32 | 0,0057 | |
| Nikiel | 58 | 0,18 | 0,003 | |
| Kobalt | 58 | 0,17 | 0,003 | |
| Miedź | 63 | 0,17 | 0,0027 | |
| IV | Cynk | 65 | 0,18 | 0,0024 |
| Kadm | 112 | 0,085 | 0,00075 | |
| V | Wapień | 40 | 0,50 | 0,125 |
| Stront | 87 | 0,37 | 0,004 | |
| VI | Palad | 106 | 0,008 | 0,125 |
| Platyna | 195 | 0,027 | 0,00013 |
Dane zostały otrzymane przy bardzo nielicznych doświadczeniach z królikami w warunkach dość prymitywnych (wstrzykiwanie dożylne rozpuszczalnych soli), nie można ich przeto uważać za rozstrzygające. Są w nich oczywiste błędy, jak np. zbytnia jadowitość żelaza, większa od baru, za duża jadowitość strontu, większa od magnezu i t. p. lecz zasadę Black’a stwierdziły dalsze doświadczenia.
Następne ściślejsze doświadczenia wykazały, że do ustalenia działania ciężkich metalów jonizowane ich sole zupełnie są nieużyteczne, ponieważ tworzą z białkiem krwi i tkanek nierozpuszczalne albuminaty; niezjonizowanych zaś ich związków nie można porównywać ze zjonizowanemi, jak np. z solami metali alkalicznych lub ziem alkalicznych.
Dlatego w studjach nad działaniem jonów, prace naukowe doby ostatniej ograniczają się do badania wpływu jonów na czynność pewnych narządów odosobnionych (przeważnie serca żaby), lub na przebieg rozwoju poczwarek i jajek rozmaitych zwierząt wodnych. Z doświadczeń tych wynika, że sprawa jest bardziej zawiła niż narazie przypuszczano i że każdy prawie jon posiada swoiste właściwości stanowiące o znacznych różnicach jakościowych w ich działaniu. Najbierniejszym z jonów metali zasadowych jest sód, najbardziej rozpowszechniony w otoczeniu, z pośród ziem alkalicznych — stront. Potas i wapień są wyraźnemi truciznami nasercowemi — magnez jest trucizną narządu nerwowego (wywołuje porażenie ośrodków). Potas tworzy mniej więcej jedną grupę z rubidem, cezem i litem, a wapień ze znacznie mocniejszym barem. Działanie litu na serce różni się nieco od działania grupy złożonej z ceru, rubidu i potasu. Dla serca żaby lit jest mocniejszą trucizną od potasu, a dla ssaków odwrotnie. Stosunki te wikłają się w większym stopniu wskutek pewnego antagonizmu w działaniu potasu i wapnia, jak również porażającego wpływu na mięśnie serca jonów sodu, usuwających jony wapnia. Należy również zauważyć, że w grupie potasu właściwość trująca dla odosobnionego serca żaby wzrasta odwrotnie do zwiększenia się ciężaru atomowego, więc najmocniejszą trucizną jest potas, najsłabszą cez. Zależy to prawdopodobnie od stopnia radjoaktywności tych pierwiastków, spadającego w kierunku K, Rb, Cs (pierwiastki te są źródłem promieni β), ponieważ zastępują się one nawzajem stosownie do tej właściwości. Charakterystycznym jest fakt że toksyczną ich wartość może zastąpić każdy inny pierwiastek radjoaktywny, niezależnie od gatunku promieni (a więc i inne pierwiastki dające promienie α, tak np. uran, tor, rad lub niton).
Wogóle co do jadowitości pierwiastków chemicznych obecnych we krwi w stanie jonów, to według danych Binet’a dla serca żaby mamy szereg następujący: sód — 0; stront — 1; wapień — 3; bar — 5; potas — 7; lit — 10. Po dodaniu chlorków tych metali do wody, w której znajdowały się drobne rybki, Richet ustalił dla w nich taki mniej więcej szereg: amon NH1’ — 64; potas — 100; lit — 300; bar — 780; magnez — 1500; stront — 2200; wapień — 2400; sód — 2417 mg pierwiastku na 1 litr wody. Po przeliczeniu na stężenie cząsteczkowe, wykazujące odpowiednią ilość jonów, będziemy mieli potas 0,0025; amon 0,0036; bar 0,0053; stront 0,0262; lit 0,0429; magnez 0,0613; wapień 0,0600; sód 0,1500.s
Trzeba wszakże zauważyć, że działanie tych pierwiastków nietylko na organizm w całości, ale nawet na serce żaby są jakościowo niejednakowe. Tak np. podczas gdy lit, potas, (rubid, cez) i sód wywołują zatrzymanie się serca w rozkurczu (diastola), wapień, stront i bar w skurczu (systola).
Wszystkie inne metale zaliczamy z punktu widzenia toksykologicznego do szeregu metali ciężkich. W stanie jonów tworzą one z białkiem krwi lub tkanek nierozpuszczalne albuminaty i dlatego działają w postaci tak zwanych adstringentia, czyli środków przyżegających. Jest to działanie wyraźnie miejscowe. Działanie ogólne, nawet bardzo wyraźne, wywołują one tylko wtedy, gdy wchodzą do ustroju w składzie innych ugrupowań złożonych; również działają one też w sposób niewyjaśniony jeszcze całkowicie, prawdopodobnie w drodze wpływów oligodynamicznych.
Za przykład może służyć stały składnik ustroju — żelazo. Zawarte jest ono w ustroju niemal wyłącznie w stanie nierozpuszczalnych związków organicznych (ferratyny i hemosyderyny) i tylko częściowo nieorganicznych (siarczek żelaza), w których jon Fe’’’ może być jeszcze wykryty przez zwykłe odczyny chemiczne, albo też tworzy połączenie metaloorganiczne i w tym stanie (jak np. w stanie hemochromogenu) wymyka się z pod normalnych metod analizy. Resorpcja żelaza po wprowadzeniu do przewodu pokarmowego jest bardzo nieznaczna; niemal cała ilość żelaza przechodzi do kału. Żelazo wprowadzone dożylnie lub podskórnie, o ile nie tworzy natychmiast nierozpuszczalnych osadów, (wstrzyknięte np. w postaci albuminatów, cukrzanów lub soli podwójnych kwasów organicznych, jak np. kwasu winnego lub w połączeniu z aminokwasami) w znacznej części zostaje też wydzielone przez jelita. Zawartość Fe w moczu pozostaje niezmienna. W tych warunkach jednak występują też mniej więcej wyraźnie trujące właściwości pierwiastka. Związki żelaza, które nie są ani zespolonemi jonami w rodzaju żelaza, żelazocjanków, ani połączeniami organicznemi, jak zasadniczo bierne barwniki krwi, lecz połączedniami zawierającemi jony Fe’’ lub Fe’’’, wywołują ogólne porażenie układu nerwowego w dawkach 0,04 — 0,06 na kg (licząc tylko i zawartość Fe), co odpowiada stężeniu cząsteczkowemu 0,0007 — 0,0010.
Mniej więcej podobnie działają inne metale ciężkie, z tą różnicą, że pewna ich część, pomimo wyraźnego enterotropizmu, poosiada niemniej wyraźny nephrotropizm, przez co wywołują one anatomiczne uszkodzenia nietylko jelit, lecz również nerek. W zatruciu związkami metali ciężkich prócz uszkodzeń miejscowych dróg wprowadzenia i wydzielenia, zasługuje na uwagę ciekawe zjawisko długotrwałego nagromadzenia ich w ciele. Miejscem nagromadzania bywa zazwyczaj wątroba, a w rzadszych wypadkach szpik kostny, gruczoły chłonne, śródbłonek naczyniowy, skóra, jak również tkanka kostna.
Wśród metali do trucizn nerkowych zaliczamy przedewszystkiem uran i chrom, następnie rtęć, ołów, tal i mangan. Pewne podrażnienie nerek wywołują także cynk, kadm, glin i metale ziem rzadkich, z których najlepiej zbadanym jest cer. Do tych pierwiastków należy dołączyć jeszcze, jako osobną grupę wanad i bizmut i inne pierwiastki tej grupy — P, As, Sb — tworzące anjony.
Ogólne działanie metali ciężkich występujące, prócz zatruć przewlekłych rtęcią i ołowiem, tylko w warunkach doświadczalnych, polega na uszkodzeniu układu nerwowego, czego skutkiem bywa porażenie ośrodkowe. Bezpośrednie działanie paraliżujące na mięśnie, łącznie z mięśniem sercowym, jest mniej wyraźne.
Wyraźnie bakterjobójcze, antyseptyczne działanie soli metali ciężkich polega na zdolności łączenia się jonów z białkiem; najwyraźniej występuje ono dla soli rtęci i srebra, a już w znacznie słabszym stopniu dla ołowiu, miedzi, cynku i bizmutu. Stąd wnioskujemy, że metale ciężkie są też truciznami komórkowemi.
Jak wynika z działania metali ciężkich, w przeważającej większości przypadków substancjami czynnemi w ustroju są nie same pierwiastki, lecz ich pochodne chemiczne. Pochodne takie mogą mieć właściwości jonów, posiadających naboje elektryczne i podlegających prawom dysocjacji — mogą one również być cząsteczkami, lub odłamkami cząsteczek, niezdolnemi do samodzielnego istnienia, wszakże wywierającemi wpływ na właściwości zawierającego je związku.
Przy objaśnianiu właściwości trujących związków złożonych może wchodzić w rachubę przedewszystkiem istnienie pewnej zależności ich od jakościowego składu. Objaśnienie takie okazuje się mniej więcej użyteczne dopóty, dopóki mamy do czynienia z łatwo rozkładającemi się związkami, jak naprzykład niezjonizowane pochodne metali ciężkich. Jony zespolone zawierające żelazo, rtęć, ołów, arsen, związki organiczne tych pierwiastków lub ich jonów posiadają odmienne właściwości. Ołów trójetylowy jest trucizną nasenną. Trójfeniloarsen wydziela się bez żadnego rozkładu z moczem i jest dlatego ciałem obojętnem. Istnieje liczny szereg związków organicznych arsenu kilkaset razy mniej trujących niż kwas arsenawy i posiadających specjalny tropizm wobec pewnych pasorzytów. Tak np. dawka śmiertelna As2O3, dla człowieka jest 0,002 na kg lecz człowiek wytrzymuję łatwo 0,06 atoksylu, 0,1 arsacetyny, i 0,2 salwarsanu, co w przeliczeniu na odpowiednią zawartość arsenu odpowiada 15 mg; 18,6 mg; 26 mg i 80 mg As2O3 na kg.
Z drugiej strony połączenie trzech zasadniczych składników ciała: węgla, wodoru i tlenu, może posiadać najstraszniejsze właściwości trujące, jak np. pikrotoksyna C30H34O13, albo kantarydyna (C5H6O2)n. Nawet najprostszy związek węgla i tlenu — czad CO jest typową trucizną.
Można wszakże powiedzieć: 1) że pochodne obcych dla organizmu pierwiastków są wogóle trującemi, 2) że pewne pierwiastki nadają zwykle właściwości trujące zawierającym je związkom, jak to np. daje się bardzo wyraźnie stwierdzić dla 3 — 5 wartościowych pierwiastków azotu, fosforu, arsenu, antymonu, wanadu i bizmutu — wśród ich pochodnych mamy cały szereg niebezpiecznych trucizn.
Łącznie z zasadniczemi właściwościami pierwiastków, trzeba zwrócić uwagę na ich wartościowość. Wskutek wielkiej różnorodności w działaniu poszczególnych pierwiastków, wpływ tego czynnika może być wykrytym tylko w tych wypadkach, gdzie chodzi o zmienne właściwości tego samego pierwiastka. Jeszcze Black podkreślił różnicę jadowitości Ce’’ i Fe’’ w porównaniu z Ce’’’ i Fe’’’, ostatnie są znacznie czynniejsze; Fe’’’ jest trucizną 80 razy silniejszą od Fe’’. Prócz tego zauważono, że wraz ze zmianą wartościowości zmienia się też i jakość działania. Tak np. Fe’’ jest nieczynnem w stosunku do naczyń płucnych, a wywołuje paraliż mięśnia sercowego i zatrzymuje krzepnięcie krwi, wówczas, gdy F’’’ wywołuje skurcz naczyń płucnych, podrażnienie serca i wzmożenie krzepliwości krwi. Dla anjonów zauważono stosunek odwrotny, albo brak jakiegokolwiek wpływu wartościowości. Tak np. trójwartościowe związki arsenu, fosforu lub azotu, są zwykle bardziej jadowite niż odpowiednie związki pięciowartościowe. (Dla świdrowców — Trypanosoma — As2O3 jest 200 razy jadowitszem od As2O5).
Mniej więcej podobne stosunki istnieją dla siarki. Siarczki R2S’’ przewyższają jadowitością siarczyny R2S’’’’O, a siarczyny — siarczany R2SVIO2.
Według tych wskazówek rozpatrywać możemy ciekawą hypotezę zmiennej wartościowości węgla, który w olbrzymiej ilości swoich pochodnych występuje zawsze jako związek czterowartościowy. Są jednak związki, których budowy nie można wytłumauczyć ani przypuszczeniem wiązania podwójnego =C=C= ani też potrójnego −C≡C−, ani przez powstawanie pierścieni zamkniętych polimetylowych, (CH2)n, pierścienia benzolowego, lub innych. Dla związków tego rodzaju przyjęta jest hypoteza, popierana głównie przez Neff’a, o istnieniu dwuwartościowej modyfikacji węgla. Wszystkie związki tego rodzaju posiadają właściwości wyjątkowo trujące. Do tych należy przedewszystkiem czad — CO, kwas piorunujący H−O−N=C a dalej być może chloropikryna — C(NO2)Cl3, która w takim wypadku mogłaby posiadać dwie formy tautomeryczne
| Cl−C−N | / O Cl \ O Cl |
i | CCl3−N | // O \\ O |
z wielką łatwością przechodzące jedna w drugą i dlatego nie dające się rozdzielić w drodze zwykłej destylacji frakcyjnej. Prawdopodobnem jest, że i w rodniku cjanu CN węgiel też jest dwuwartościowym, przynajmniej w tak zw. izonitrylach R−N=C.
Oprócz tego należy zauważyć, że w zatruciach pochodnemi pierwiastkami rozmaitej wartościowości, liczba odczynów, umiejscowienie ich i możliwe zmiany tych pochodnych w ustroju wzrastają wraz ze zmiennością wartościowości i dlatego objawy zatrucia wywoływane przez te ciała są niezmiernie złożone.
Na podstawie tych nielicznych i sprzecznych danych nie można było oprzeć teorji ogólnej, tem bardziej, że objawy zatrucia są zwykle w sposób niezwykle zawiły ze sobą powiązane. Powstało więc przekonanie, że działanie trujące zależy w gruncie rzeczy od charakteru połączeń międzycząsteczkowych czyli od budowy cząsteczkowej. Stanowi to jedyne możliwe wytłumaczenie faktu, że związki złożone z jednakowych ilości i jakości pierwiastków, mogą się jednak ogromnie różnić pod względem toksyczności.
W istocie właściwości toksyczne są niemniej chwiejne niż właściwości chemiczne i fizyczne i najmniejsze różnice budowy wywołują bardzo poważne różnice tych właściwości. Znamy bardzo liczne związki czynne optycznie, skręcające płaszczyznę polaryzacji światła, różnica pomiędzy niemi polega wyłącznie na przestrzennym układzie zupełnie tych samych zresztą ugrupowań dookoła niesymetrycznego atomu węgla. Bywają trzy rodzaje takich ciał — skręcające na lewo, skręcające w takim samym stopniu na prawo i optycznie nieczynne, stanowiące równodrobinowe mieszaniny dwóch poprzednich antypodów. Otóż kiedy w grę wchodzą substancje trujące, np. adrenalina, okazuje się zazwyczaj, że najmocniejsze działanie posiada związek, skręcający płaszczyznę polaryzacji na lewo i najsłabsze skręcający na prawo, zaś obojętny znajduje się pośrodku. Również nikotyna, skręcająca płaszczyznę na lewo, jest dwa razy mocniejszą trucizną od skręcającej na prawo.
Bardziej jeszcze wyraźny jest wpływ izometrji strukturalnej związków aromatycznych. Pochodne orto- meta- i para- mają zawsze nietylko inne właściwości chemiczne i fizyczne, ale także niejednakowe właściwości toksyczne. Tak np. dla metylofenolów (krezolów) mamy najmocniejsze działanie związku para, za tem idzie orto, a najsłabszym jest związek meta. Dla innych związków stosunki te są nieco odmienne. Np. wśród dwufelonów C5H4(OH)2 mamy szereg o>p>m.
Również nie ulega wątpliwości, że na toksyczność związków duży wpływ wywiera obecność w ich cząsteczce podwójnych i potrójnych wiązań węgla.
Prawo, w zeszłem jeszcze stuleciu ustalone przez Loewa, zgodnie z którem związki nienasycone, posiadające takie wiązanie, są wielokrotnie czynniejsze od związków nasyconych, t. j. posiadających o H2 (lub o 2H2 więcej) możemy uważać za aktualne i w chwili obecnej. Tak np. wszystkie pochodne zawierające rodnik winylowy, C2H3 są znacznie czynniejsze od związków zawierających rodnik etylowy C2H5. Etylamina C2H5NH jest substancją nie wiele czynniejszą od amoniaku, podczas gdy winylamina C2H3NH2 jest jedną z najsilniejszych trucizn nerkowych. Winylamina zabija królika w dawce 0,025 na kg w ciągu 4—6 godzin. Siarczek dwuetylu (C2H5).2.S nie posiada żadnych właściwości drażniących, wówczas gdy dwuwinylosulfid może wywoływać podrażnienie nawet skóry.
Aldehyd propjonowy C2H5COH, nie jest wcale trucizną oddechową, zaś akroleina C2H3.COH lub aldehyd krotonowy C3H5COH posiadają wybitne właściwości duszące. To samo widzimy w grupie bardziej złożonych związków. Tak np. z mentolu, składnika zwykłego olejku miętowego, otrzymano keton menton
| (CH3)2 CH.CH. < | CH2−CH2 CH2−CO |
> CH. CH3 |
z którego przez zamianę grupy (CH3)2 CH.CH. na (CH3)2CC wytwarza się pulegon, zawarty w amerykańskim olejku trującym Pooleyoil, działający na a przemianę materji nie gorzej od fosforu. Karwon mający dwa podwójne wiązania:
| CH2 \\ CH3 / |
C. CH | / CH2−CH2 \\ \ CH2−CO / |
CH3 |
z których jedno w jądrze sześciometylenowem jest również dość mocną trucizną.
Dwujodek acetylenu IC⋮CI jest najmocnieszą ze znanych trucizn komórkowych i działa na drobnoustroje w znikomo małych stężeniach 1/107, domieszka zaś jego pary do powietrza zabija nawet ssaki.
Słabo trującej cholinie
| (CH3)3⋮ N | / C2H4OH \ OH |
odpowiadają: bardzo trująca neuryna
| (CH3)3⋮ N | / C2H3OH \ OH |
i jeszcze czynniejszy związek
| (CH3)3⋮ N | / C ⋮ CH \ OH. |
Nie można wszakże twierdzić, że każdy związek nienasycony jest koniecznie trujący. Tak np. allylamina jest trucizną bardzo słabą, dwumetyloallyloamina zupełnie obojętną substancją, wówczas czas gdy izoallylamina jest trującą (allylamina ma wzór CH2:CH.CH2NH2, izoallylamina: CH3.CH:CH.NH2). Pochodne allylowe mocznika są nieczynne. Zawierające podwójne wiązania kwasy tłuszczowe są zwykłemi składnikami olejków roślinnych (oliwnego, sezamowego, słonecznikowego, lnianego, konopianego, makowego i t. p.) i są używane jako środki spożywcze bez żadnych złych skutków.
Już z tych danych możemy wywnioskować, że szczegóły budowy cząsteczkowej mają zasadniczy wpływ na jej naturę chemiczną, łącznie z właściwościami toksycznemi. Jednak jak to już mieliśmy sposobność zauważyć w innych wyżej omawianych uogólnieniach wyjątki są tu niemniej liczne niż prawidłowe zachowanie się a bardzo często skutki zmiany budowy przybierają charakter całkiem odmienny od oczekiwanego.
Dzieje się to przedewszystkiem dlatego, że dotychczas mówi się o zatruciu w taki sposób, jakbyśmy tu mieli do czynienia z najprostszym odczynem chemicznym lub fizycznem zjawiskiem. W istocie jednak nawet takie proste działania jak bakterjobójcze — czyli dezynfekujące, są skutkiem końcowym całego szeregu bardzo złożonych odczynów, z których każdy musielibyśmy poddać bardzo szczegółowej analizie, zanim moglibyśmy go zdefinjować.
Całkiem błędne jest traktowanie ugrupowań jadonośnych (toksofornych) w znaczeniu ogólnem; należy raczej przyznać, że ugrupowania przyjmowane jako trujące, są prawdopodobnie inne i wywierają zgoła odmienny wpływ w każdym prawie przez zatrucie wywołanym odczynie ustroju.
W chwili obecnej nie mamy jeszcze możności powiedzieć dlaczego ten lub inny związek jest trucizną, ani świadomie zmienić jego właściwości w kierunku pożądanym, jak to już jest do pewnego stopnia możliwe w syntezie sztucznych barwników.
Budowa cząsteczki środków nieorganicznych nie jest jeszcze tak dokładnie zbadana i ustalona, jak w dziedzinie związków organicznych zawierających węgiel. Dlatego też z nielicznemi wyjątkami, wszystkie prawie teorje działania toksycznego polegają na szczegółach budowy cząsteczek związków organicznych. Z tego punktu widzenia należy także rozpatrywać samą micellę żywą, na którą działa trucizna. Według teraźniejszych poglądów micella musi posiadać wśród swych bocznych łańcuchów ugrupowania zdolne do związania obcej dla ustroju cząsteczki trucizny, która ze swej strony powinna również posiadać odpowiednie grupy łącznikowe. Trucizna nie posiadająca takich łączników, albo ich pozbawiona, może działać tylko fizycznie albo katalitycznie, nie odgrywając roli odczynnika chemicznego (jak każda trucizna we właściwem tego słowa znaczeniu). W takich razach mamy do czynienia z pochłanianiem dostarczonej trucizny przez lepsze rozczynniki według teorji Owerton Mayer’a, albo też ze zjawiskami adsorpcji, czyli powstawania rozczynów stałych. W niektórych wypadkach powstają niestałe połączenia chemiczne, w rodzaju doparków, lub soli, które łatwo rozkładają się, wytwarzając na nowo niezmienioną truciznę. Nagromadzoną w ten sposób truciznę możemy ilościowo otrzymać zpowrotem przez wydobywanie z odpowiednich tkanek zapomocą tych lub innych odczynników. Zjawiska te są bardzo podobne do zjawisk barwienia, t. zw. substancjonalnego. Musimy zaznaczyć, że rzeczywiście ustrój zatrzymuje tylko nieznaczną część trucizny, nawet w tych razach gdy mamy do czynienia z bardzo małemi dawkami. Tak np. bardzo czynne atropina i strychnina — bywają najczęściej wydzielane w stanie niezmienionym wraz z moczem. Jednak niektóre doświadczenia wykazują, że niewielka nawet zmiana w budowie cząsteczki tych trucizn może zmienić całkowicie ich czynność. Tak np. przez przyłączenie do morfiny rodnika HOSO2 otrzymamy pozbawiony zupełnie właściwości nasennej i prawie niejadowity kwas sulfo-morfinowy — przez usunięcie jednej grupy metylowej z bardzo czynnej kokainy wytwarza się mało czynna i pozbawiona właściwości znieczulającej benzoilo-ekgonina i t. d. Z tego wnioskujemy, że ilość micelli reagujących z trucizną, jak również ilość zmian cząsteczkowych, możliwych do wywołania w niej, jest znikomo mała, wskutek czego ilość trucizny czynnej w ustroju jest znacznie mniejsza od dawki rzeczywistej. Należy przypuścić, że liczba łączników dla trucizn jest też wyjątkowo mała i ogranicza się do niewielkiej ilości zróżniczkowanych komórek układu nerwowego. Jedna i ta sama trucizna może posiadać szereg zarówno różnych łączników, jak również i najrozmaitszych ugrupowań toksofornych i dlatego, po pierwsze działanie jej może być niezmiernie złożone, a po drugie zasadnicze przetworzenie jej działania staje się możliwe przez usunięcie pewnych ugrupowań, co można uskutecznić drogą bardzo nieznacznych zmian budowy cząsteczki. Tak np. usunięcie dwóch atomów wodoru w jądrze hydrofenantrenowem morfiny (powstawanie tetrahydrofenantrenu) zamiast heksahydrofenantrenu przetwarza nasenną truciznę (grupa morfiny) w truciznę wywołującą skurcze (grupa tebainy). Podobny skutek osiągamy też przez dołączenie grupy metylowej. Kodeina ma wyraźne właściwości trucizny skurczowej. W pewnych wypadkach jedno i to samo ugrupowanie odgrywa rolę łącznika i toksofornej czyli jadonośnej grupy zarazem.
Z tych danych zasadniczych wnioskujemy, że celem zbadania trucizn należy: 1) zamknąć analizę w ramach jakiegokolwiek właściwego jej działania, 2) ustalić stosunek tego działania do zmian chemicznych budowy substancji w ustroju, wyjaśnić zdolność organizmu do częściowego chociażby tylko jej niszczenia i po 3) zmieniać przez dołączanie różnych pierwiastków i ugrupowań skład chemiczny trucizny, notując powstające przytem zmiany działania.
W podanych warunkach staje się możliwem ustalenie zależności właściwości toksycznych od składu chemicznego i budowy cząsteczki. O ile nie będziemy zwracali uwagi na liczne wyjątki, wymagające hypotez dopełniających, otrzymamy takie uogólnienia:
1. naogół biorąc, czynność związku wzrasta jednocześnie z powiększeniem ciężaru cząsteczkowego, o ile temu nie stają na przeszkodzie warunki rozpuszczalności w wodzie. Tak np. działanie narkotyczne węglowodorów, alkoholów, aldehydów, ketonów i t. d. wzrasta równolegle do liczby atomów C w ich cząsteczkach, natomiast polimeryzacja wręcz przeciwnie, zawsze zmniejsza stopień toksyczności.
2. Połączenia z prostym szeregiem atomów C działają silniej od swych izomerów z rozgałęzionym szkieletem węglowym. Połączenia cykliczne mają inne działanie od połączeń szeregu tłuszczowego.
3. Zmiana wodorów na chlorowce podnosi czynność rodników szeregu tłuszczowego i prawie nie działa na węglowodory cykliczne. Brom i jod są wogóle czynniejszemi od chloru.
4. Zamiana wodoru na wodorotlenek nie zmienia istoty działania, lecz czyni substancję bardziej zdolną do połączeń z micellami organizmu. Wodorotlenek jest prawdopodobnie najpospolitszym łącznikiem.
5. Alkylowanie i przedewszystkiem acylowanie (połączenie z rodnikami kwasów) w wielu wypadkach zmniejsza lub nawet niszczy czynność związków.
6. Czynność pochodnych, zawierających azot, zależy przedewszystkiem od właściwości zasadniczego związku azotowego, od wartościowości azotu i od sposobu jego połączenia w cząsteczce. Pochodne pięciowartościowego azotu (zasady amonowe R’’’’. NOH) mają właściwości kurare i paraliżują kończyny nerwów ruchowych w mięśniach. Amoniak NH3 ma znaczenie trucizny skurczowej, również wyraźne działanie tego rodzaju wykazuje N3H (kwas azotowodorowy).
| N \ ∥ N / |
NH. |
Hydrazyna (NH2−NH2) i hydroksylamina (NH2OH) są truciznami paraliżującemi, działają one na ośrodek oddechowy podobnie do kwasu pruskiego. Pochodne tych związków mają niejednakowe właściwości. Aminy, szeregu tłuszczowego, zawierające rodniki nasycone należą wogóle do trucizn skurczowych słabszych od amoniaku. W połączeniach z czynnemi rodnikami (nienasyconemi) występują właściwości tych ostatnich. Aminy szeregu aromatycznego, jak również zawierające azot ugrupowania heterokliczne wszystkie niemal bez wyjątku są truciznami. Ugrupowanie NH jest wogóle czynniejsze od NH2, chociaż istnieją tu interesujące wyjątki. Tak np. dwufenyloamina (C6N5)2 NH jest ciałem zupełnie obojętnem, wówczas gdy anilina C6H5.NH2 jest mocną trucizną. Jeszcze bardziej jadowite są fenilendwuaminy, a mianowicie parafenilendwuaminy.
Złożone pochodne pirydyny i chinoliny stanowią jądra najczynniejszych trucizn alkaloidów.
7. Dołączenie ugrupowań NO i NO2 podnosi właściwości trujące związku. Połączenie zapomocą tlenu wodorotlenka (powstanie estrów kwasów azotowego i azotawego) wywołuje porażenie naczyń, nie obserwowane w innych połączeniach.
8. Zmiana wodoru na rodnik cjanowy daje stosunki powikłane, zależnie od powstawania związków cjanowych lub izocjanowych. Izocjanki R−N=C wywołują porażenie ośrodka oddechowego, wówczas gdy prawdziwe cjanki R−C≡N głęboką zapaść (porażenie kory mózgowej). Wogóle pochodne te są mniej trujące niż kwas pruski. Jedynie tylko cjanhydryny aldehydowe, stanowiące przetwory połączenia HCN i aldehydów według ogólnego wzoru
| R− | C | / OH \ C=N |
| ∣ H |
najmocniejszemi truciznami. Tak np. cjanhydryna chloralu CCl3.CH(CN)OH jest trzydzieści razy bardziej jadowita od kwasu pruskiego.
9. Połączenia siarki można rozpatrywać albo jako pochodne siarkowodoru, związku wyraźnie toksycznego, albo też siarczku węgla CS2, trucizny niemniej niebezpiecznej, lub wreszcie kwasu siarkowego i siarczkowego SO4’’ i SO3’’. Pochodne siarkowodoru, tak zw. merkaptany i siarkoetery, są mniej czynne od substancji pierwotnej. Pochodne CS2 (kwas ksantogenowy COS) są także jadowite. Wśród pochodnych kwasu siarkowego mamy takie mocne trucizny jak estry kwasu siarkowego i przetwory ich chlorowania, używane jako chemiczne środki bojowe (vaillantite SO2OCH3Cl — sulvinite SO2O.C2H5Cl i siarczan dwumetylowy SO2(OCH3)2). Zwykle jednak resztki kwasów, a mianowicie kwasu siarkowego HO.SO2O’ działają w sposób odtruwający. Tak np. przez połączenie z resztką kwasu siarkowego, z bardzo trujących fenolów lub morfiny wytwarzają się związki zupełnie obojętne.
Z powyższych danych zasadniczych wynika, że analiza składu chemicznego trucizn stała się zadaniem możliwem do wykonania tylko pod warunkiem połączenia pracy doświadczonych chemików z pracą fizjologów. Tylko na podstawie licznych doświadczeń ze związkami stopniowo odmienianemi, można będzie ustalić rodzaj łączności pomiędzy pewnem ugrupowaniem w cząsteczce, a jej toksycznością. Ugrupowania takie nie zawsze odgrywają jednakową rolę. Mogą one być:
1. łącznikami, których obecność umożliwia oddziaływanie na micellę. Usunięcie tych łączników lub związanie ich przez dołączenia alkylów lub acylów powinno pozbawić truciznę jej czynności albo odkryć inne właściwości, których nie udało się zauważyć przedtem wskutek przewagi działania łączników. Zupełnie jest możliwa obecność całego szeregu łączników nowej siły w jednej i tej samej cząsteczce.
2. Ugrupowaniami toksycznemi można nazwać te, którym dany związek zawdzięcza swe właściwości toksyczne w stanie niezmienionym i niezależnym od zmiany drugorzędnych ugrupowań. Takiem ugrupowaniem jest np. tropina, ugrupowanie zasadnicze licznych alkaloidów szeregu kokainy i atropiny.
Wzór jego jest:
Pośród chemicznych środków bojowych ugrupowaniem tego rodzaju jest prawdopodobnie mustardyl — S(CH2CH2)2’’, grupa toksoforowa trucizn grupy iperytu.
3. Ugrupowaniami dołączonemi, lub ubocznemi, których znaczenie nie zawsze jest jednakowe. Tak np. metyl, wytwarza z dość biernego kwasu siarkowego mocną truciznę — siarczan metylu i przetwarza czynny amoniak w obojętną trójmetylaminę. Wśród tych bocznych ugrupowań zdarzają się takie, których działanie jest mniej więcej stałe; dlatego też używano je w celu otrzymania odpowiednich zmian właściwości związku. Tak np. ustalono, że obecność bocznego ugrupowania CH.Cl2, lub CH2Cl — wywołuje powstawanie właściwości drażniących u rodników, które ich nie posiadają. Również nitro i nitrozo — grupy w pewnych warunkach nadają związkowi właściwości trucizny naczyniowej, jak też zdolność do wywołania methemoglobinemji, a chlorowanie lub bromowanie podnosi właściwości nasenne i t. d.
Streszczając dane o działaniu trucizn, ich losy w ustroju, ich właściwości fizyko-chemiczne jak również budowę ich cząsteczek i zdolność do odczynów chemicznych, wnioskujemy, że trujące działanie na ustrój może posiadać tylko substancja o właściwościach niżej wyliczonych.
A. — Trucizny o działaniu miejscowem.
1. — Wyraźna zdolność do reagowania, lub chociażby połączenia się z białkiem albo z lipoidami komórek.
2. — Obecność łączników swoistych dla kończyn nerwowych
3. — Obecność swoistych do każdego poszczególnego działania ugrupowań toksycznych lub odpowiednich połączeń ubocznych.
4. — Właściwości chemotropiczne w razie powstawania ropieni aseptycznych.
B. — Dla trucizn o działaniu ogólnem.
1. — Pewien stopień stałości w ustroju. Rozkładające się łatwo substancje bywają zwykle bierne.
2. — Dostateczna zdolność do nagromadzania się w ustroju celem osiągnięcia odpowiedniego minimalnego stężenia.
3. — Obecność w składzie cząsteczki odpowiednich ugrupowań czynnych jak również łączników.
4. — Właściwości swoiste tych łączników jako podstawa cytotropizmu i czynności oligodynamicznej.
5. — Pewna zdolność do zmian chemicznych w warunkach istniejących w komórkach żywych. Zupełnie bierne substancje mogą posiadać tylko właściwości odczynników fizyko-chemicznych i nie należą do rzędu trucizn mocnych.
Stąd wysnuwa się wniosek, że działanie właściwe trucizn należy do szeregu zjawisk najbardziej złożonych, dzięki czemu toksykologja ogólna stanowi jeden z najciekawszych, ale również najtrudniejszych działów medycyny teoretycznej. Istniejące dane są jeszcze zupełnie niewystarczające.
Dokonano jednak już licznych badań w celu sztucznego otrzymania rozmaitych środków leczniczych i jesteśmy już w posiadaniu dość wartościowego materjału, który w przyszłości może być zużytkowany w chemji toksykologicznej.
Co się tyczy wszakże szczególnych zadań chemji środków bojowych, to dotychczas systematycznych zasadniczych badań jeszcze nie posiadamy. To co zostało zrobione w tym kierunku będzie dokładniej omawiane w rozdziale szczegółowej toksykologji chemicznych środków bojowych.
Na tem miejscu należy podkreślić, że z wyjątkiem nielicznych i mało nadających się do celów wojennych chemicznych środków o działaniu ogólnem, wszystkie inne środki bojowe są truciznami o wyraźnem działaniu miejscowem. Są to środki wywołujące zapalenie (flogogenne) t. j. trucizny komórkowe lub, ściślej mówiąc, działające na śródbłonek naczyń krwionośnych, albo środki drażniące kończyny swoistych nerwów czuciowych i w ten sposób powodujące pewne odruchy, jako to: łzawienie, kichanie, skurcz mięśni głośni i oskrzelików, i t. p.
Odruchy te są dość proste i dlatego badanie skuteczności chemicznych środków bojowych w stosunku do tego działania, które jest ich przeznaczeniem, będzie w porównaniu z innemi zadaniami toksykologji naukowej rzeczą stosunkowo dość łatwą.
W takim krótkim zarysie toksykologji chemicznych środków bojowych jak obecny, niepodobna jest rozpatrywać wszystkich szczegółów metodyki badań toksykologicznych. Musimy zwrócić uwagę wyłącznie na badanie właściwości chemicznych środków bojowych, ograniczając się w traktowaniu innych zagadnień do wskazówek najogólniejszych. Z punktu widzenia toksykologicznego zasadniczemi pytaniami przy badaniu każdej nowej substancji są następujące:
1. czy dana substancja jest istotnie trucizną,
2. na czem polega jej działanie,
3. jaki jest stopień jej jadowitości?
Podstawę do rozwiązania pytania pierwszego dają przypadki zatruć ludzi wskutek używania substancyj do jakichkolwiek celów życiowych, np. jako barwników, jako perfum, jako materjału do wyrobu przedmiotów użytku codziennego i t. p. albo specjalnie dokonywane doświadczenia t. zw. orjentacyjne. Polegają one zwykle na wprowadzeniu badanej substancji do ustroju zwierząt laboratoryjnych (psów, królików, szczurów, żab) najczęściej drogą wstrzykiwań podskórnych lub dożylnych. Substancja jest jadowita, jeżeli już stosunkowo nieznaczne ilości jej wywołują objawy chorobowe albo nawet śmierć. Substancja uznana za jadowitą podlega w dalszym ciągu analizie toksykologicznej. Należy ustalić, czy ma wyraźne działanie miejscowe, czy też jest ono drugorzędne w porównaniu z działaniem ogólnem. Wśród objawów miejscowych mamy przekrwienie, zapalenie i martwicę, które dają się zauważyć również i po śmierci na preparatach mikroskopowych. Za życia dołączają się do nich objawy miejscowego znieczulenia lub podrażnienia kończyn nerwów czuciowych, jak np. swędzenie i ból. Ogólnemi objawami są: nieprawidłowy oddech, napady sercowe, wymioty, biegunka, skurcze i porażenia i t. d. W razie zajścia śmiertelnego należy wyjaśnić powód śmierci, rozstrzygnąć czy mamy tu do czynienia z porażeniem serca, czy ośrodka oddechowego. Należy też odrazu zwrócić uwagę na zmiany swoiste krwi (najczęściej hemolizę). Bardzo ważnemi są działania na przemianę materji. W prostych doświadczeniach na podstawie danych sekcyj działanie to można tylko podejrzewać.
Do doświadczeń należy używać jak najwięcej zwierząt, możliwie rozmaitych gatunków, narządów izolowanych, najczęściej serca żaby, lub izolowanych komórek (np. nabłonka migawkowego) oraz hodowli drobnoustrojów (celem ustalenia właściwości dezynfekcyjnych).
Zarówno obserwacje na ludziach, jak doświadczenia ze zwierzętami muszą być obowiązkowo połączone z dokładnemi badaniami anatomo-patologicznemi. Przy pomocy tych badań zawsze można ustalić cały szereg szczegółów posiadających znaczenie zasadnicze. Najważniejszemi są:
1. zmiany miejscowe w przewodzie pokarmowym, na skórze, w nerkach i w płucach, wskazujące na drogę wprowadzenia i wydzielenia trucizny;
2. zmiany anatomiczne w narządach miąższowych (zwyrodnienie komórkowe) wskazujące na nienormalną przemianę materji;
3. nienormalne zabarwienie: żółtaczka, bronzowe zabarwienie kwaśną hematyną i hemosideryną, czekoladowe methemoglobiną, jaskrawo-czerwone karboksyhemoglobiną, lub sztuczne zabarwienia, jak np. zabarwienia srebrem, farbami anilinowemi i t. p.;
4. nienormalny podział krwi i przekrwienie żylne, w połączeniu z sinicą, przepełnienie serca krwią, zwłaszcza prawej jego połowy, wskutek porażenia serca;
5. obrzęk płuc;
6. obecność płynu surowicznego w jamach ciała, zwykle w połączeniu z porażeniem serca;
7. przekrwienie mózgu i wybroczyny kory mózgowej;
8. zmiany krwi: brak krzepnięcia (krew płynna), zawały (infarkty), hemoliza;
9. obecność drobnych wybroczyn na opłucnej (plamek Tardieu) — objaw zaduszenia.
Brak pospolitych zmian mikroskopowych nie roztrzyga o działaniu wyłącznie czynnościowem. W układzie nerwowym, w mózgu i rdzeniu badanie mikroskopowe może wykryć bardzo nieznaczne zmiany (np. zmiany ziarnek Nissl’a) nawet w działaniu takich trucizn jak pewne alkaloidy.
Na podstawie wyników tych doświadczeń możemy zwrócić uwagę na szczegóły działania trucizny i wybrać pewien kierunek do dalszych badań.
W ten sposób wyjaśnia się istota działania trucizny i staje się możliwe ułożenie tymczasowej teorji tego działania. Co się tyczy chemicznych środków bojowych, to przedewszystkiem należy zwrócić uwagę na to, że źródłem zatrucia najczęściej bywa wdychanie lub pochłanianie przez skórę powietrza zawierającego truciznę. Dlatego przebieg badań staje się nieco odmienny. Do orjentacyjnego doświadczenia używamy tak zw. komór gazowych, zawierających powietrze obciążone gazem, albo parą lotnego płynu, albo też delikatnym pyłem tej substancji.
Działanie chemicznych środków bojowych może się składać: 1) z oczywistych odruchów aparatu oddechowego i wyraźnych jego podrażnień, 2) z dołączającego się do tych podrażnień zapalenia spojówki i dostępnych śluzówek, 3) ze zmian zachodzących na powierzchni skóry, występujących zwykle równocześnie ze zmianami w drogach oddechowych i wreszcie 4) z objawów zatrucia ogólnego, które może towarzyszyć objawom miejscowym lub występować zupełnie niezależnie. Wyniki tych orjentacyjnych doświadczeń na początku powstania toksykologji bojowej służyły za podstawę do podziału odpowiednich trucizn na: duszące, drażniące, żrące i trujące. Rozróżnianie trzech pierwszych kategoryj jest bardzo niełatwem zadaniem, zwłaszcza jeżeli doświadczenia mają charakter wyłącznie jakościowy.
Celem wyjaśnienia istoty działania i opracowania zasadniczych teoryj toksyczności badania takie są niewystarczające. Badania dokładniejsze polegają przede wszystkiem na ściśle ilościowem ustaleniu losów odpowiednich substancyj w ustroju. Nie należy zapominać, że zależnie od warunków doświadczenia jedna i ta sama trucizna może działać jako środek rozkładający się w ustroju całkowicie, lub tylko częściowo, może okazać się trucizną o wyłącznie miejscowem lub również i ogólnem działaniu, jadem śmiertelnym albo tylko przyczyną chwilowych, prędko znikających objawów. Dlatego każda teorja toksykologiczna musi być z natury rzeczy bardzo powikłaną i niema mowy, nietylko o jakiejkolwiek ogólnej teorji zatrucia, ale nawet w badaniu każdej poszczególnej trucizny, jesteśmy dotychczas zmuszeni opracowywać specjalne teorje dla każdego prawie zjawiska. Z zestawienia całego szeregu takich wyjaśnień wyłania się stopniowo ogólny pogląd na przynależność badanej trucizny do pewnej kategorji ogólnej. Ponieważ jednak działanie każdej trucizny nie ogranicza się do jednego układu narządów, ani tem bardziej do jednego narządu, niezależnie od innych, to zwykle zaliczenie trucizny do pewnego szeregu, bywa sprawą raczej upodobania lub poglądów. Tak np. chloroform można rozpatrywać jako środek dezynfekcyjny, narkotyczny, albo jako środek o działaniu miejscowem, ponieważ rzeczywiście wyjaławia on łatwo rozkładające się pod wpływem drobnoustrojów płyny, działa porażająco na korę mózgu i jednocześnie wywołuje podrażnienia miejscowe i uszkodzenia komórek aż do natychmiastowej martwicy. Azotyn amylowy jest najmocniejszym środkiem porażającym naczynia i równocześnie typowym jadem krwi powodującym methemoglobinemję. Dlatego wyjaśnienie działania i zaliczenie do pewnej grupy w żadnym razie nie wyczerpuje wszystkich właściwości badanego środka, nie usuwa jednocześnie możliwości innych przejawów zatrucia, uwidoczniających się w dalszych badaniach. Tak np. wśród trucizn bojowych każdy prawie środek może jednocześnie wywoływać podrażnienie dróg oddechowych wraz ze śluzówką nosa i spojówki i powodować zatrucie ogólne.
Przeważna część chemicznych środków bojowych należy do starych, oddawna znanych trucizn, badanych w ciągu dziesiątków lat. Z wyjątkiem bardzo nielicznych środków o działaniu ogólnem, jak np. kwas pruski i czad, wszystkie prawie chemiczne środki bojowe wywołują zmiany miejscowe. Zależne od stężenia i zasadniczych właściwości trucizny takiego rodzaju zmiany anatomiczne mogą być bardzo rozmaite co do swego charakteru i stopnia rozwoju. Środki posiadające wyraźny neurotropizm, mianowicie specjalne trucizny działające na zakończenia nerwów czuciowych mogą wywoływać zmiany czynnościowe, powstawanie odruchów znacznie wcześniej niż najlżejszych uszkodzeń anatomicznych. Takie zatrucia będą więc wyłącznie czynnościowemi. W działaniu innych środków, lub w razie stężenia mocniejszego tych samych środków drażniących, będziemy mieli przekrwienie i zapalenie odległych narządów zależnie od cytotropizmu trucizny; zwykle mamy do czynienia z całym szeregiem takich tropizmów.
Treść zatrucia komórek żywych może polegać na działaniu samej trucizny, albo zależeć od jej rozkładu. Tak np. według poglądu wielu badaczy, wszystkie środki drażniące, podlegające hydrolizie z odszczepieniem kwasu solnego działają tym kwasem na komórkę. Niezbędne więc jest ustalenie charakteru rozkładu i badanie powstałych w ten sposób związków nowych.
Nowe, mało jeszcze znane chemiczne środki badano zwykle w porównaniu z innemi środkami o podobnem działaniu lub podobnym składzie chemicznym.
Najważniejszem zadaniem, zarówno dla badania trucizn wogóle, jak szczególnie dla badania środków bojowych, jest ustalenie stopnia jadowitości czyli napastliwości. Ogólne podstawy takiego rodzaju określeń, już dostatecznie omówiliśmy wyżej w ocenie danych dawkowania. Tutaj musimy zastanowić się nad samemi metodami ustalenia napastliwości czyli siły działania chemicznych środków bojowych.
Warunki towarzyszące używaniu trucizn tego rodzaju wysuwają na czoło badań sprawy specjalne, podlegające rozwiązaniu bądź to bezpośrednio na polu bitwy, bądź też przez doświadczenia wykonane w warunkach prób artyleryjskich na poligonie, bądź wkońcu w ścisłych granicach doświadczeń laboratoryjnych. Warunki powstające podczas wybuchu pocisków, albo wogóle w próbach zatrucia na wolnem powietrzu są bardzo niestałe i złożone, a możność kontrolowania ich jest o tyle niepewna, że nie można na ich podstawie rozstrzygać o użyteczności środka bojowego. Doświadczenia te są jednak niezbędne do celów wojennych. Nie należy wszakże zapominać, że wyniki otrzymane podczas prawdziwej walki gazowej, jako doświadczenia wykonanego na wielkiej ilości ludzi, mogą dać dokładne wyobrażenie o istotnej użyteczności badanej trucizny. Wiele trucizn, które zdawały się być najdoskonalszemi środkami zniszczenia, okazały się nieużytecznemi w warunkach ich stosowania bojowego.
Zadaniem dokładnego badania jest umiejętne połączenie tych dwóch rodzajów doświadczeń w system uzgodniony.
Wszystkie teraźniejsze środki bojowe muszą działać przez zatrucie powietrza, dlatego w badaniu nie jest ważną dawka bezwzględna lecz stężenie w powietrzu.
Ustalenie dawki bezwzględnej w warunkach zatrucia przez powietrze jest, jak już powiedziano, rzeczą niewykonalną, jak również i zupełnie niepotrzebną, ponieważ w tym wypadku chodzi tylko o przeciętnie najniższe granice działania, a nie o możliwości zatrucia pojedyńczych jednostek, jak to bywa w ustaleniu dawkowania lekarskiego.
Zasadniczym warunkiem prawidłowych badań jest ustalenie odpowiedniego stałego stężenia trucizny w powietrzu; stężenie nie powinno się zmieniać w ciągu doświadczenia i musi być jednakowe we wszystkich warstwach przestrzeni, służącej jako komora doświadczalna. Następnie komora musi być szczelnie zamknięta, dobrze przewietrzona, żeby wyniki działania trucizny nie były zaćmione przez zatrucie kwasem węglowym albo brakiem tlenu. Wreszcie należy ciągle kontrolować istotne stężenie, nie polegając na danych objętości komory i ilości użytej trucizny.
Bardzo ważnem źródłem omyłek, głównie w określaniu stężenia o natychmiastowem działaniu zabójczem, gdzie zatrucie jest krótkotrwałe, jest wprowadzanie zwierzęcia do komory doświadczalnej. Zwykle zwierzę znajduje się od początku w dobrze przewietrzanej komorze małych rozmiarów. Do prądu powietrza przepływającego przez tę komorę w odpowiedniej chwili dodajemy drugi prąd powietrza ze znaną zawartością trucizny. Dodatkowy ten prąd stanowi znaną część powietrza wentylacyjnego, czyli powietrza przepływającego przez komorę w przeciągu jednostki czasu z obu źródeł razem. Jeżeli, jak to bywa w dobrze zbudowanej komorze, powietrze jest stale poruszane obrotem specjalnego mieszadła, czas potrzebny do ustalenia pożądanego stężenia jest bardzo krótki, a omyłka wypływająca z utożsamienia chwili puszczenia prądu zatrutego powietrza z początkiem działania danego stężenia jest znikoma. Drugim, pewniejszym, ale nie zawsze wygodnym sposobem, jest wprowadzanie zwierzęcia do komory już zawierającej powietrze o określonej zawartości trucizny. W tym celu wprowadzano zwierzę z początku do komory mniejszej tak połączonej z większą, ażeby w odpowiedniej chwili można było zwierzę wprowadzić do zatrutej atmosfery. Razem ze zwierzęciem dostarczamy oczywiście i pewną ilość powietrza nie zawierającego trucizny, ale w odpowiednim stosunku pomiędzy objętościami tych dwu komór omyłka, która stąd wynika, jest bardzo mała i może być zresztą uwzględniona w obliczeniach. Zamiast małej komory można używać również worka z nieprzenikalnej dla powietrza tkaniny, do którego sadza się zwierzę na chwilę przed wprowadzeniem do komory.
Komory gazowe mogą mieć rozmaite zadania i dlatego, zależnie od przeznaczenia bywają różnej budowy. Najważniejszym typem komory do badań nad zwierzętami jest komora do określania granic czynnych stężeń i ogólnego obrazu zatrucia. Drugim typem jest komora służąca do określania na ludziach dolnych granic czynnego stężenia. Zależnie od istnienia dwóch zasadniczych grup trucizn, dla których znajomość najmniejszych stężeń czynnych jest ważna z punktu widzenia taktyki wojennej, mamy też specjalne przyrządy badania wrażliwości oczu i wrażliwości skóry. Trzeci typ komór wynika z potrzeby badania pochłaniaczy, lub masek ochronnych. Ponieważ wszystkie te przyrządy mają wielkie znaczenie w badaniu chemicznych środków bojowych, musimy omówić tę sprawę nieco dokładniej.
Wszystkie komory do badań nad zwierzętami są zbudowane według dwóch zasadniczych podstaw, których trzymano się również przy budowie t. z. aparatów respiracyjnych, używanych do badania przemiany materji przez określanie ilościowych stosunków wydzielania kwasu węglowego i pochłaniania tlenu. Cel ten może być osiągnięty w dwojaki sposób. Według Raignaut i Reiset’a, zwierzę należy umieszczać w szczelnie zamkniętej przestrzeni, przyczem powietrze w niej jest w ciągłym ruchu dzięki działaniu pompy składającej się z dwóch dużych naczyń napełnionych ługiem (mocnym rozczynem KOH albo NaOH). Pochłaniany przez zwierzę tlen odnawia się zapomocą gazometrów ustawionych tak, że każde zmniejszenie ciśnienia powietrza w komorze wywołuje samorzutny przypływ pewnej ilości tlenu. W taki sposób w ciągu całego doświadczenia zwierzę zużywa tę samą ilość powietrza.

Rys. 6.
Mały aparat Lehman’a do badań z bardzo niebezpiecznemi truciznami. Aparat składa się ze 1) szklanej komory (A) dla zwierzęcia, złożonej z dwóch przyszlifowanych kloszów, 2) naczynia (B) do rozcieńczania danej ilości gazu w określonej objętości powietrza, którą odliczono na zegarze gazowym (C). Trujący gaz odmierzono w biuretce gazowej (E), do której przechodzi on z małego gazomierza (F). W celu równomiernego zmieszania powietrza z trującym gazem w komorze dla zwierzęcia znajduje się elektryczny wentylator zabezpieczony ścianką z siatki drucianej. Przez aparat pędzono ciągle prąd powietrza przy pomocy pompy ssącej przez pochłaniacze D, które służą tak do unieszkodliwienia trucizny jak również do kontrolnej analizy.
W doświadczeniach toksykologicznych sposób ten stosuje się tylko wobec małych zwierząt, jako mało zdatny do użycia, ponieważ przeważna ilość chemicznych środków bojowych podlega rozkładowi, lub pochłanianiu w ługu, co zmienia stężenie. Sposób ten jest jednak podstawą działania pewnych przyrządów ochronnych, których przeznaczeniem jest izolacja żołnierzy od zatrutej atmosfery w celach ratowniczych. W aparatach tego rodzaju jako źródło tlenu służy bomba ze zgęszczonym tlenem lub oksylit (nadtlenek sodu Na2O2) rozkładający się w obecności wody na tlen i wodorotlenek sodu. W pierwszym wypadku kwas węglowy jest pochłaniany przez specjalne pochłaniacze zawierające suchy wodorotlenek sodu, a w drugim przez sam oksylit.
Aparaty respiracyjne drugiego typu są zbudowane dla warunków ciągłej wentylacji, t. j. ciągłego dostarczania nowych ilości świeżego powietrza i usuwania zużytego. Wszystkie teraźniejsze komory gazowe są tej budowy. Mają one dwie odmiany: w pierwszej powietrze wstępuje pod pewnem ciśnieniem, większem od atmosferycznego, zaś w drugiej powietrze bywa wyciągane z komory przy pomocy pompy ssącej i dlatego ciśnienie w nich jest zawsze mniejsze od atmosferycznego. Komory pierwszego rodzaju są bardzo użyteczne w badaniu silnych trucizn dla krótkotrwałych doświadczeń nad małemi zwierzętami. Drugiego rodzaju komory są zwykłemi aparatami do zasadniczych badań zarówno przemiany materji (znana komora Petenkofera i Foitego) jak też do badań toksykologicznych. Ponieważ ilości powietrza przechodzącego przez komorę tego typu są dość znaczne, w celach oszczędności urządza się rozgałęzienie prądu powietrza na dwa strumienie z których jeden, większy, idzie przez licznik (zegar gazowy) i zostaje wyrzucany nazewnątrz budynku laboratoryjnego, a drugi mniejszy podąża przez system pochłaniaczy i również podlega ilościowemu określeniu, co umożliwia dokładne ustalenie zawartości trucizny. Na tej podstawie są zbudowane zarówno stare aparaty Lehman’a, używane w czasach przedwojennych, jak i najnowsze przyrządy do badania chemicznych środków bojowych w Arsenale Edgewood i innych specjalnych zakładach. Należy zwrócić uwagę na określania ilości powietrza przechodzącego przez aparat zamiast zapomocą zwykłych gazomierzy, (zwłaszcza w aparatach z powiększonem ciśnieniem) przy pomocy zegarów gazowych odpowiedniej wielkości, lub wreszcie tak zw. flowmetrów, przyrządów tanich i prostych, bardzo użytecznych głównie do kontrolowania czynności aparatu. Flowmetr jest to wodny manometr, którego gałęzie w części górnej są połączone rurką ze środkiem o pewnem zwężeniu. Zależnie od oporu tej zwężonej rurki dla prądu powietrza, poziom wody staje się niejednakowym; a z róż nicy tej można wnioskować o ilości powietrza przechodzącego przez aparat w ciągu jednostki czasu. W tym celu trzeba tylko kalibrować flowmetr przy pomocy zegara gazowego, albo aspiratora.

Rys. 7.
Duży aparat Lehman’a do długotrwałych doświadczeń. Aparat składa się z dużej, nieszczelnej komory A, posiadającej specjalny otwór (m) do dostarczania powietrza, generatora B połączonego z zabezpieczającą płuczką C z kwasem siarkowym, przez które przedmuchiwano prąd powietrza z gazomierza lub dmuchawki wodnej; aspiratora E połączonego przez płuczkę z komorą i zegaru gazowego D do określania ogólnej ilości powietrza, które przeszło przez aparat. W komorze znajduje się mieszadło F (elektryczny wentylator).
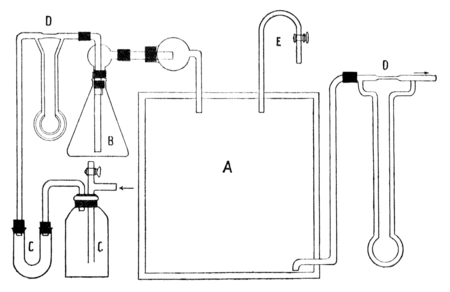
Rys. 8.
Komora do badań trucizn bojowych według Fries’a i West’a. A — komora, B — generator, C — przyrządy do suszenia powietrza, D — flowmetry do określania ilości wdmuchanego i wyciągniętego powietrza, E — rurka do brania próbek.
Stosownie do powyższego, komora gazowa posiada następujące części składowe:
1. przyrządy do oczyszczania powietrza z kurzu (specjalne filtry z odpowiedniego materjału — z merli albo muślinu, albo odpylacze glicerynowe).
2. Liczniki do określania ilości powietrza przechodzącego przez komorę, zwykle duże zegary gazowe. W małych aparatach wystarczają flowmetry.
3. Przyrządy do pochłaniania CO2 i suszenia powietrza. W określeniu przemiany materji wystarcza określenie zawartości CO2 i H2O w pewnej części powietrza, według sposobu omówionego wyżej (rozgałęzienie prądu); w badaniach toksykologicznych ten zabieg nie jest dostateczny, ponieważ wilgotne powietrze wywołać może rozkład niektórych trucizn (np. fosgenu) zanim one przenikną do płuc zwierzęcia. Dlatego należy usuwać wodę i kwas węglowy z całej ilości powietrza wchodzącego do komory.
4. Tak zwane generatory — przyrządy, w których jest źródło trucizny. Zależnie od badanego środka bywają one bardzo rozmaite. Dla prawdziwych gazów są to bomby ze sprężonym gazem albo zwykłe aparaty chemiczne (np. aparat Kipp’a) służące do otrzymywania gazów, albo wreszcie pipety gazowe napełnione gazem i gazometry. Dla płynów lotnych służą jako generatory naczynia napełnione kawałeczkami pumeksu, zwyczajne kali-aparaty, albo pewne specjalne przyrządy. W niektórych wypadkach parowanie odbywa się w temperaturze wyższej od temperatury otoczenia, wówczas są używane specjalne ogrzewacze czyli termostaty. Mało lotne płyny i proszki muszą być rozpylane zapomocą odpowiednich przyrządów, najlepiej w samej komorze, albo jak można najbliżej, w celu zapobieżenia osiadaniu trucizny w rurach doprowadzających powietrze. W pewnych wypadkach używa się świec dymowych, lub nawet pocisków do wytwarzania dymów bojowych. Doświadczenia tego rodzaju, rozumie się, nie są ścisłe.
5. Komora, zaopatrzona w mieszadło mechaniczne, powinna być bezwzględnie szczelna, wykonana z materjału odpornego na działanie środków bojowych (w żadnym razie nie z metalu) i posiadać musi urządzenia przystosowane do doskonałego i prędkiego czyszczenia i mycia.
6. Przyrządy do badania powietrza wychodzącego z komory. Jeżeli tylko część powietrza podlega badaniu, ilość jego musi być ściśle określona. Przyrządy służące do takiego badania powietrza są najczęściej zwykłemi pochłaniaczami używanemi do prac laboratoryjnych, jak płuczki, rurki U, kali-aparaty rozmaitego kształtu i t. p. Najwygodniejsze są, przystosowane również do badania zawartego w nich płynu, rurki Petenkofera, używane do pochłaniania CO2 zapomocą wodorotlenku baru. Skład płynów pochłaniających zależy oczywiście od zadania i bywa bardzo rozmaity.
Rozróżniamy dwie zasadnicze podstawy działania płynów pochłaniających: nagromadzenie trucizny w najlepszych rozpuszczalnikach, np. fosgenu w toluolu lub jeszcze lepiej cymolu, albo niektóre odczyny chemiczne, jak np. rozkład tegoż fosgenu wodą i zobojętnienie powstałego HCl ługiem. Tego rodzaju środkami chłonnemi są dla chloru miareczkowany rozczyn tiosiarczanu sodowego, dla fosgenu miareczkowany ług, dla chloropikryny siarczyn sodowy, dla arsenowodoru rozczyn siarczanu miedzi, lub azotanu srebra i t. p.
7. Przyrządy do ssania powietrza. W małych aparatach zadanie to wykonywa gazometr albo aspirator, lub pompka wodna aspiracyjna. W dużych aparatach niezbędne są specjalne mocne pompy ssące, mogące usuwać po 100 i 200 m3 na godzinę.
8. W niektórych wypadkach trucizna zawarta w powietrzu, o ile nie jest pochłonięta przez przyrządy analityczne, musi być zniszczona. Zniszczenie to najłatwiej jest osiągnąć przez wpuszczanie powietrza do jakiegokolwiek pieca; przeważna część istotnie niebezpieczných trucizn bojowych składa się ze związków organicznych i łatwo spala się. Zwykła objętość komory doświadczalnej, jak również potrzebnej do doświadczenia ilości trucizny jest tak niewielka, że tego rodzaju urządzenia zabezpieczające stają się zbyteczne.
Prócz tego, komora doświadczalna musi być przystosowana do łatwej zmiany warunków doświadczenia, a mianowicie: szybkości prądu wentylacyjnego, stężenia trucizny, ilości powietrza podlegającego badaniu i t. d. Wentylacja musi być o tyle silna, aby zarówno zasycanie jak i usuwanie zatrutego powietrza z komory trwało przez przeciąg czasu nieznaczny w porównaniu z czasem samego doświadczenia.
W początkowym okresie badania chemicznych środków bojowych używano znacznie prostszych urządzeń — mniej więcej szczelnych pokoików znanej objętości, do których wpuszczano w ten lub inny sposób pewną ilość trującej substancji. Stężenia otrzymywane w ten prosty sposób są zwykle za duże.
Komory do badań nad ludźmi bywają dwojakiego rodzaju: w komorach używanych zarówno do badania skuteczności środków ochronnych i ustalania progu czynności odpowiedniej trucizny dla ludzi, jak również i do prób użyteczności pochłaniaczy, mamy zwykle do czynienia z dość obszernemi pokojami, o ile można najdokładniej uszczelnionemi. Do powietrza bywa dodana przez specjalny otwór (rurkę przepuszczoną przez ścianę) pewna, zwykle bardzo nieznaczna ilość badanej trucizny. Potrzebną ilość takiej trucizny oblicza się według objętości pokoju. Ponieważ stężenie w różnych miejscach tej izby może stać się bardzo niejednakowe wskutek różnego ciężaru gatunkowego par trucizny i powietrza, jak też wskutek powolnej dyfuzji i konwekcji gazów przenikających do pokoju tylko w jednym punkcie, zawsze są stosowane mieszadła w postaci wentylatorów pokojowych, umieszczonych około źródła powstawania gazów trujących. Zawartość trucizny w różnych punktach komory musi być kontrolowana przez badanie odpowiednich próbek, pobranych do dużych butli, z których uprzednio zostało wypompowane powietrze. Wyniki takich doświadczeń nie są ścisłe, jednak wystarczające do celów praktycznych. Przeważająca większość posiadanych obecnie danych co do jadowitości dla ludzi małych stężeń chemicznych środków bojowych, jak również użyteczności środków ochrony, została otrzymana istotnie w taki właśnie sposób
Bardziej dokładnemi, choć dotychczas prawie nie używanemi są komory typu amerykańskiego, istniejące w laboratorjach Arsenału Edgewood. W komorach tych ludzie badani znajdują się nazewnątrz przestrzeni zawierającej zatrute powietrze, które dosięga ich aparatu oddechowego, oczu lub skóry przez rurki połączone z odpowiedniemi przyrządami. Sposób taki daje możność wytwarzania istotnie jednostajnej mieszaniny trucizny z powietrzem oraz działania jej w ciągu dość długiego ściśle określonego czasu obok gwarancji zupełnego bezpieczeństwa.
Zależnie od tego czy badane są środki duszące, czy pochłaniacze przeciwko nim, czy też środki drażniące (sternity i lakrymatory), czy wreszcie trucizny skórne — używamy przyrządów trzech rodzajów. Zasadniczą część wszystkich tych przyrządów stanowi szczelna komora, taka sama jak do doświadczeń ze zwierzętami, przez którą przechodzi prąd powietrza. Jedna część tego powietrza przechodzi przez generatory — przyrządy do wyrabiania pary odpowiedniej trucizny — druga, większa służy do rozcieńczania jej. Zawartość trucizny w powietrzu określa się zapomocą badania płynów w specjalnych pochłaniaczach, przez które przechodzi cała ilość powietrza przepływającego przez komorę w czasie doświadczenia. Przy dość szybkim prądzie powietrza w komorze i odpowiednim stosunku średnicy rurek dających czyste i zatrute powietrze, zmieszanie trucizny z powietrzem odbywa się bez pomocy specjalnych mieszadeł; również zbyteczne są w tym wypadku gazomierze.
Przyrządy używane do trzech rodzajów badań, o których mówiliśmy, nie są złożone. Do badania gazów duszących i użyteczności pochłaniaczy służą maski ochronne, do których doprowadza się zatrute powietrze albo bez pochłaniacza — celem określenia najmniejszej zawartości możliwej do zauważenia powonieniem, albo przez pochłaniacz — celem ustalenia stopnia jego wytrzymałości i sprawności. Wskutek niebezpieczeństwa wdychania środków duszących nie posiadamy zupełnie pomiarów ich napastliwości na ludziach z wyjątkiem niektórych w Niemczech dokonanych określeń dolnej granicy wytrzymałości w stosunku do niektórych związków arsenowych organicznych.

Rys. 9.
Aparat do badania napastliwości lakrymatorów. A — komora do otrzymania powietrza z określoną zawartością trucizny, B — przyrząd do nasycenia powietrza trucizną, C — flowmetr do określania ilości powietrza przepędzonego przez aparat, D — maska gazowa połączona z aparatem.
Do badania lakrymatorów używamy maski, przez którą człowiek badany, zależnie od obrócenia odpowiedniego kraniku może oddychać czystem powietrzem otoczenia lub zatrutem z komory. Jako generator służy płuczka napełniona środkiem parującym, albo odpowiedni rozpylacz. W wypadkach używania rozczynów, parowanie nie bywa nigdy równomierne. Tego samego aparatu można używać do badania czynności sternitów. Przyrządem do badania czynności lakrymatorów jeszcze prostszym od maski, ale lepszym, jest szklany lejek odpowiedniego kształtu jak najszczelniej przystawiony do oczodołu, przez który przepędza się następnie zatrute powietrze z komory.
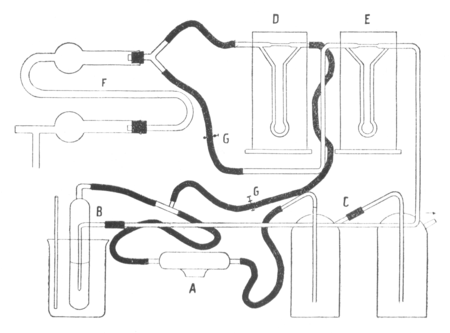
Rys. 10.
Aparat do badania napastliwości trucizn skórnych. A — aparat do oparzania skóry, B — generator, C — płuczki do pochłaniania par trucizny, D — flowmetr do określania ilości niezatrutego powietrza, E — flowmetr do określania ilości zatrutego powietrza, F — filtry do powietrza. G — regulacyjne krany ze śrubkami.
Celem zbadania działania na skórę pary niektórych trucizn, służy specjalny przyrząd ze szkła, składający się z rurki dość szerokiej z bocznym otworem szczelnie przytkniętym do skóry przedramienia przy pomocy trzymacza, przylutowanego do tejże rurki w celu zapobieżenia nagrzewaniu rurki ręką. Powietrze wchodzące do rurki musi być koniecznie przefiltrowane, aby usunąć z niego pył, który może wchłaniać środek badany i przyczynić się do powstania mocniejszego stężenia. Do doświadczeń tego rodzaju, z powodu bardzo małej prężności pary środków skórnych, w rodzaju iperytu, duża komora nie jest wygodna, a zatrute powietrze rozcieńcza się zazwyczaj nie w komorze, a bezpośrednio w rurce wychodzącej z generatora w sposób wyżej wymieniony, prócz tego sam generator bywa ogrzewany. W badaniach z napastliwością trucizn skórnych doświadczenia ograniczają się do prostego smarowania skóry rozczynem danej trucizny w benzynie lub alkoholu, albo maściami zawierającemi truciznę w pewnem stężeniu.
W badaniu zdolności skóry do wchłaniania trucizn i powstających w ten sposób zjawisk zatrucia ogólnego (doświadczenia możliwe tylko na zwierzętach) używamy zazwyczaj aparatu Lehman’a, maleńkiej komory drewnianej, z której wystaje nazewnątrz głowa zwierzęcia (kota lub królika) albo też umieszczamy zwierzę w zwykłej komorze, po uprzednio dokonanej operacji tracheotomji i połączeniu rurki tracheotomicznej z powietrzem zewnętrznem. Tego rodzaju badania są dotychczas bardzo nieliczne.
Z powyższego wnioskujemy:
1. że sposoby przeciwdziałania ustroju zarówno zwierzęcego jak i ludzkiego są w zasadzie bardzo jednostajne, wobec czego każdy środek może być zawsze zaliczony do jednej z niewielu zasadniczych grup trucizn;
2. że działanie trucizn jest w znacznym stopniu uzależnione od dawki czyli od stężenia w otoczeniu;
3. że dla trucizny o wyraźnem działaniu ogólnem miejsce i sposób wprowadzenia do ustroju jest rzeczą mniej więcej obojętną, skutki zatrucia zależą przeważnie od zjawisk organotropizmu, wówczas gdy dla trucizn o działaniu miejscowem sposób wprowadzenia rozstrzyga również o charakterze przebiegu zatrucia.
Wyżej przytoczone trzy zasadnicze prawa ogólnej toksykologji muszą być zastosowane też i do analizy chemicznych środków bojowych.
CHEMICZNYCH ŚRODKÓW BOJOWYCH.
W ciągu wielu lat badanie trucizn miało za danie albo ustalenie takich ich właściwości, dzięki którym mogłyby one odgrywać rolę lekarstw albo wynalezienie takich sposobów ich wykrycia, które byłyby w stanie zapobiec szerzeniu się trucicielstwa jako zawsze bardzo pospolitej postaci zbrodni. Dopiero w ostatnich czasach, w okresie wojny światowej, powstało nowe zadanie — konieczność dokładnego badania trucizn jako chemicznych środków bojowych. Takie badanie składa się: 1) z oceny danej substancji z punktu widzenia wojskowego, jak również określenia podstaw użycia do walki chemicznej, 2) z ustalenia jej właściwości toksykologicznych i 3) z wynalezienia sposobów jej zwalczania bądź to w postaci zabiegów leczniczych w razie powstania zatrucia, bądź sposobów zapobiegania takim zatruciom.
Zadaniem szczegółowej toksykologji środków bojowych jest toksykologiczne badanie ich.
Chemicznemi środkami bojowemi nazywamy wszystkie przetwory przemysłu chemicznego używane w walce chemicznej. We wszystkich wojnach poprzednich takiemi środkami były prawie wyłącznie materiały wybuchowe. Nie podlegająca zresztą wątpliwości jadowitość tych związków, jeszcze w większym stopniu produktów ich spalania, nie miała żadnego praktycznego zastosowania. Pomimo tego, już w czasie wojny rosyjsko-japońskiej zwrócono uwagę na trującą właściwość dymów tak zwanej szimozy, a haska konferencja zabroniła użycie tego rodzaju pocisków, których jedynym celem jest powstanie trujących gazów. Haska konferencja w r. 1899 zabroniła używania pocisków, zawierających trujące i duszące gazy, a konferencja z r. 1907 jakiegokolwiek zatrutego oręża. Zresztą podobne przepisy istniały nawet jeszcze wcześniej, a mianowicie w r. 1868 (Petersburg), 1878 (Bruksella).
Te piękne przepisy nie przeszkodziły jednak dalszemu rozwojowi prac w celu wynalezienia odpowiednich środków trujących, i dlatego w dziejach ostatniej wojny światowej, już rozpoczynając od r. 1915, mamy ciągle do czynienia z nowem źródłem zatruć w postaci nowych chemicznych środków bojowych.
Nie każda trucizna może być użyła, jako trucizna bojowa. Temu celowi odpowiadają tylko substancje o następujących właściwościach:
1) musi ona być prawdziwą trucizną z dość prędko następującem działaniem, przy użyciu o ile można małego stężenia;
2) działanie jej musi być takiego rodzaju, żeby zrobić wroga natychmiast niezdolnym do walki, nawet nie zabijając go, ale z pewnością usuwając go na możliwie dłuższy czas z pola walki;
3) musi ona być łatwo dostępna w nieograniczonych ilościach i wytwarzana z materjału, w który dane państwo obficie jest zaopatrzone, albo który może łatwo zdobyć.
Liczba użytecznych chemicznych środków bojowych jest bardzo niewielka, pomimo, że setki różnych przetworów zbadano pod tym względem.
Użycie trucizn jako oręża do zwalczania wroga jest rzeczą bardzo starą. Prawdopodobnie powstało ono wówczas, gdy człowiek nauczył się wyrobu trucizn.
Już z pewnych szczegółów budowy strzał z kamienia (krzemienia) okresu neolitycznego możemy wnioskować, że nawet w tych odległych epokach do zatrucia ich używano trucizn. Nawet i teraz liczne narodowości krajów podzwrotnikowych używają jeszcze tego starego oręża. Liczne legendy średniowiecza, znakomite utwory literackie, jak np. Hamlet Szekspira, wskazują, że ten sposób użycia trucizn przez zatrucie broni przetrwał całe stulecia, aż do obecnej doby. Jeżeli nie odgrywa on teraz poważnej roli to tylko dlatego, że teraźniejsza kula karabinowa jest mniej odpowidnia do tego celu niż wiotka strzała łuku lub dmuchawki. Tam, gdzie orężem pozostały strzały, utrzymało się również używanie trucizn celem ich zatrucia.
Stosowane w starożytnych czasach zatruwanie dostarczonych wrogowi środków żywności w czasach nowszych wyszło z użycia, nawet w wojnie niekulturalnych narodów, z powodu wielkiej trudności wykonania takiego zadania, a przedewszystkiem wskutek braku w odpowiedniej chwili potrzebnych ilości trucizny. W starożytności przykładów takich zatruć mamy cały szereg, aż do czasów wojen krzyżowych (zatrucie krzyżaków przez Michała Komnena). Czy ten sposób nie zostanie użyty w przyszłości, teraz jeszcze trudno powiedzieć. Prawdopodobnie będzie on zastosowany, jeżeli do tego celu okaże się zdatnym jakiś łatwo dostępny środek bojowy. Możliwe jest, że do tego celu nadadzą się organiczne związki arsenowe, których dokładne badanie jest jednem z najaktualniejszych zadań teraźniejszej chemji środków bojowych.
Musimy pamiętać, że ani Hannibal, ani Filip Macedończyk, ani Juljusz Cezar ani Belizarjusz, ani Fryderyk Barbarossa, nie mówiąc już o mniej sławnych wodzach, nie wstydzili się używania trucizn.
Większe znaczenie ma zatrucie wody. Jest bardzo prawdopodobne, że podczas ostatniej wojny czyniono próby dostarczania do źródeł wodnych obszaru zajętego przez wroga zarazków chorób zakaźnych, mianowicie tyfusu i cholery. Z czasów wojen prowadzonych przeciw tubylcom Afryki i Australji mamy cały szereg ścisłych danych tyczących się zatruwania bardzo nielicznych źródeł w bezwodnej pustyni. Psucie wody wszelkiemi możliwemi sposobami podczas oblężenia wroga było stale używane aż do ostatnich czasów. Mamy na to jaskrawe przykłady z czasów anglo-burskiej wojny.
Czy okaże się możliwe zatrucie pokarmu i wody na obszarze zajętym przez wroga zapomocą odpowiednich sposobów zatruwania powietrza, pokaże przyszłość; narazie takich środków nie znamy.
W każdym razie zatrucie powietrza jest najużyteczniejszym ze sposobów zastosowania trucizn bojowych. Rozpoczynając od zwykłego dymu, używanego celem zmuszenia wroga do ucieczki z pewnego schroniska i kończąc na najbardziej złożonych środkach doby najnowszej, mamy w dziejach ludzkości cały szereg danych, wskazujących na stosowanie takiego rodzaju środka walki. Tak np. jeszcze w 1850 r. Pelissier zadusił dymem całe plemię Kabylów, którzy schowali się do jaskini. Ciekawe jest, że już w czasach wojny krymskiej w r. 1856 była zrobiona propozycja rządowi angielskiemu, by do zdobycia Sewastopola użyć zatrucia powietrza przez spalanie siarki; według innych źródeł, w czasie tej wojny proponowano także użycie pocisków, napełnionych kakodylem CH3As:AsCH3, jadowitą substancją palącą się w powietrzu i posiadającą wyjątkowo wstrętny zapach.
Znane są również więcej legendarne dane z dawniejszych czasów historji Rzymu i Grecji. Tak np. istnieją wskazówki, że Spartanie w czasie wojny peloponeskiej przy oblężeniu Platei i Belja stosowali spalanie siarki u murów tych miast. Jednakże w dużych rozmiarach, jako zwykłego środka walki z wrogiem, używali zatrucia powietrza Niemcy wbrew wszystkim przepisom konferencyi pokojowych, poczynając od 1915 r. Od tej chwili mamy prędko postępujący rozwój nowego rodzaju walki. Jeden trujący środek prędko zostaje zamieniony przez drugi czynniejszy, wskutek czego nasz teraźniejszy arsenał trucizn bojowych jest bardzo różnorodny, a ilość proponowanych i zbadanych w tym kierunku substancyj trzeba liczyć, jak już mówiono, setkami. Prawie wszystkie państwa mają teraz nietylko całe zakłady wyrobu trucizn bojowych i niezbędnych do ich użycia przysposobień, ale, co jest najważniejsze, cały szereg laboratorjów naukowych celem dalszego badania tego oręża, który dziś powszechnie jest uważany za oręż przyszłości. Losy następnych wojen zależeć będą od tego, jakie środki będą użyte przez walczących i o ile skuteczną będzie przed niemi odpowiednia obrona.
Wojna chemiczna jest właściwie walką pomiędzy wynalazcą czynnych środków napadu — trucizn bojowych, a twórcą masek przeciwgazowych i innych środków obrony przeciw tym truciznom.
Jak już zauważono, teraźniejszy sposób walki chemicznej polega przedewszytkiem na zatruciu powietrza jadowitemi gazami albo parami. Osiąga się to zatrucie zapomocą puszczania olbrzymich ilości gazów dostarczonych na pole walki w stanie zgęszczonym w dużych stalowych naczyniach, albo przez bombardowanie wroga z armat, miotaczy bomb, lub z płatowców, pociskami zawierającemi prócz środków trujących również ładunki materjałów wybuchowych. Najnowszy sposób zatruwania powietrza polega na spalaniu specjalnych świec dymowych. Ponieważ do bombardowania używano przeważnie nie prawdziwych gazów lub płynów wrzących niżej temperatury ciała, lecz małolotnych substancyj, których punkt wrzenia może być wyższy od 100°, a nawet ciał stałych w stanie drobnego pyłu, to wraz z zatruciem powietrza powstaje zatrucie terenu, w pewnych wypadkach bardzo długotrwałe. Teren taki staje się nietylko niezdatny do dalszych działań taktycznych, lecz może się okazać zupełnie niedostępny na dłuższy czas, wskutek ciągłego parowania trucizny, a także wskutek możliwości bezpośredniego zetknięcia się trucizny ze skórą i następnych oparzeń.
Znaczna ilość używanych obecnie środków bojowych wymaga pewnego podziału celem lepszego zorjentowania się w sposobach ich zastosowania. Za podstawę takiego podziału mogą służyć: 1) punkt widzenia taktyczny, 2) właściwości chemiczne używanych środków, 3) ich działanie na ustrój — więc punkt widzenia toksykologiczny.
Co do podziału z punktu widzenia taktycznego, to po pierwsze: można podzielić środki bojowe na takie, których zwalczanie osiąga się zapomocą dobrej maski i na takie, dla których ten sposób obrony nie wystarcza. Oprócz tego mamy środki: a) lotne i trwałe i b) działające natychmiast i z opóźnieniem. Tyczy się to raczej podziału toksykologicznego niż taktycznego. Po drugie: z punktu widzenia taktycznego bardzo ważną rzeczą jest chwila powstawania pierwszych objawów zatrucia i trwałość tych objawów. Na tej podstawie można podzielić chemiczne środki bojowe: 1) na działające natychmiast, ale nie zatruwające na dłuższy okres czasu miejsca, gdzie były użyte, 2) na działające po mniej więcej znacznym okresie wylęgania czyli po upływie pewnego czasu. Wśród tych środków znowu trzeba rozróżnić nietrwałe od trwałych środków, działanie których pozostaje mniej więcej stałe przez dość długi okres czasu. Po trzecie o ile zadaniem walki chemicznej jest usunięcie wroga z pola walki, środki bojowe można podzielić na: 1) zabójcze, skutkiem działania których jest śmierć natychmiastowa, albo następująca w ciągu pierwszych dni po zatruciu, 2) trujące t. j. wywołujące mniej więcej długotrwałą ale zwykle nie powodującą śmierci chorobę, 3) drażniące, których skutkiem jest wywołanie natychmiastowej niezdolności do walki bez stałych uszkodzeń ustroju.
Środki należące do drugiej grupy mogą w znacznym stopniu wstrzymać ruchliwość wroga, ponieważ duża ilość chorych wymaga umieszczenia w licznych szpitalach polowych i zorganizowanej ewakuacji. Środki należące do trzeciej grupy są najużyteczniejsze wskutek natychmiastowego działania i możności osiągnięcia dodatnich wyników przez użycie bardzo małej ilości materjału. Są więc one najtańsze i najwygodniejsze z punktu widzenia ruchliwości oddziałów wojskowych. Również, ponieważ żaden z tych środków, w stężeniach zwykle używanych, nie jest w stanie wywołać uszkodzenia stałego i niebezpiecznego dla życia, to środki drażniące są najwięcej humanitarne.
Prócz tych zasadniczych grup, warto zwrócić uwagę na połączenie kilku celów razem, jak np. używanie trujących i drażniących dymów bojowych, których zasadniczem zadaniem jest maskowanie, lub dodawanie pewnej ilości środków drażniących, łatwo przenikających przez maski, do innych trucizn mocniejszych, żeby zmusić wroga do zrzucenia masek i niebezpiecznego zatrucia.
Zasada podziału chemicznego jest bardzo prosta. Rozdzielamy odpowiednie środki, zależnie od zawartych w nich pierwiastków na związki nieorganiczne i związki organiczne, te zaś dzielimy na środki szeregu tłuszczowego i aromatycznego, a w dalszych szczegółach przestrzegamy też podziału chemji organicznej.
Taki podział jest niewygodny dlatego, że łączność pomiędzy strukturą chemiczną a własnościami toksykologicznemi nie zawsze bywa łatwa do ustalenia. Zwykle używano tej zasady, jako uzupełniającej przy zastosowaniu podziału toksykologicznego.
Toksykologiczny podział w swojej zasadniczej formie składa się z podziału środków bojowych na cztery grupy: 1) środków duszących, 2) środków drażniących, 3) środków żrących i 4) środków trujących. Taki podział, napozór dość wygodny i narazie powszechnie przyjęty, ma jednak pewne wady, ponieważ właściwości toksykologiczne zależą nietylko od jakości, ale też i od stężenia użytej trucizny. Prócz tego i sam wyraz „trująca trucizna“ zastosowany dla ostatniej grupy nie może nie być uznany za tautologię. Dlatego w tym podziale trzeba przeprowadzić pewne zmiany, zgodne z danemi teraźniejszego stanu naszej wiedzy.
Przedewszystkiem wśród trucizn bojowych, jak wśród trucizn wogóle, rozróżniamy trucizny o działaniu miejscowem i takie u których właściwość ta albo zupełnie zanika albo występuje tylko przy bardzo wielkich stężeniach i w odpowiednich warunkach. Do tych ostatnich trucizn należą te, które dotychczas nazywano środkami trującemi. Nadamy im nazwę środków o działaniu ogólnem. Olbrzymia ilość środków, zdolnych do wywołania zmian miejscowych ma, zależnie od dawki, właściwości środków żrących, t. j. wywołujących miejscowe oparzenia, w mniejszych stężeniach, nie działając na skórę, zachowują one jednak zdolność wywołania podrażnienia śluzówek, posiadają więc właściwości środka drażniącego, a przenikając do dróg oddechowych wywołują objawy duszności, wskutek czego występują jako środek duszący. Tak np. jeden z dość często stosowanych środków bojowych — chloropikryna — w małych stężeniach, poczynając od 0,06/M3 jest niezłym lakrymatorem, t. j. wywołuje łzawienie, w stężeniu około 0,2/M3, prócz tego wyraźne objawy odruchowe w narządach oddechowych — kaszel i nawet wymioty; w stężeniu wyżej 2/M3 chloropikryna wywołuje już ciężkie zmiany anatomiczne w narządach oddechowych i zabija około 5% zatrutych zwierząt a w stężeniu 20/M3 czyni powietrze bezwzględnie niewdychalnem i zabija prawie wszystkie zwierzęta doświadczalne. Nareszcie działając „in substantia“ bezpośrednio na skórę wywołuje ona znaczny obrzęk i zapalenie. W użyciu przeważnej ilości tych trucizn, celem wywołania uszkodzeń skóry, są potrzebne najwyższe stężenia. Zdolność nagromadzenia się trucizny w skórze, przy nieznacznych stężeniach jej w powietrzu, jest cechą bardzo nielicznych trucizn. Takie trucizny wywołują zmiany skórne, jako jeden z zasadniczych objawów zatrucia, co jednak nie wyklucza możności jednoczesnego powstania innych uszkodzeń, mianowicie uszkodzeń oczu i dróg oddechowych. Najlepszym przykładem takich trucizn jest iperyt. Odpowiadają one częściowo truciznom żrącym według poprzedniego podziału. Będziemy nazywali je truciznami skórnemi.
Wśród pozostałych trucizn rozróżniamy dwie wyraźne grupy: trucizny, działające przedewszystkiem na dostępne śluzówki i na spojówkę, nawet w bardzo małych stężeniach, wywołujące odruchy ochronne i trucizny, właściwości tej nie posiadające, a których zasadniczą cechą jest działanie na narządy oddechowe, polegające na uszkodzeniach anatomicznych. Pierwsza grupa może być nazwana grupą środków odruchowych, druga specjalnemi truciznami narządów oddechowych. Dość często trucizny o działaniu ogólnem, posiadające zdolność do bardzo silnych czynności chemicznych, nie wywołują znaczniejszych zmian miejscowych dlatego, że już w bardzo niewielkich stężeniach zabijają ustrój przez działanie na narządy odległe od miejsca wprowadzenia trucizny. Takiemi narządami są: system nerwowy albo krew. Dlatego też rozróżniamy trucizny krwi i trucizny ośrodka oddechowego i serca.
Trucizny skórne są dotychczas tak nieliczne, że dalszy podział ich jest zbyteczny.
Trucizny z działaniem na aparat odruchowy, t. j. środki odruchowe, mogą być podzielone stosownie do powierzchni alarmowych, na które one przeważnie działają, albo stosownie do wywoływanych przez nie odruchów. Mamy więc środki: 1) wywołujące odruchy przez podrażnienie spojówki; odruchy te składają się ze skurczowego zamykania oczu i łzawienia, (tak zw. lakrymatory), 2) środki, wywołujące odruch kichania przez podrażnienie śluzówki jamy nosowej, (t. zw. sternity), 3) środki, wywołujące złożone odruchy przez podrażnienie śluzówki gardzieli i górnych dróg oddechowych — kaszel i łącznie z nim wymioty. (Takie środki nazwano womitorami). Tego rodzaju odruchy mogą wywoływać prawie wszystkie trucizny oddechowe użyte w stężeniach mocniejszych.
Co do trucizn oddechowych, to zależnie od zdolności lub niezdolności wywoływania omówionych odruchów ochronnych, możemy odróżnić wśród nich takie, których obecność w powietrzu czyni to powietrze niewdychalnem i wywołuje natychmiastowe skurczowe zamknięcie głośni i atak kaszlu i takie, które niewywołując nawet w znacznych stężeniach takich zjawisk, są w stanie wywołać odrazu głębokie zmiany w płucach. Pierwszą grupę stanowią środki niewdychalne, albo trucizny górnych dróg oddechowych, drugą — trucizny płuc.
Trzeba zwrócić uwagę na czysto teoretyczne znaczenie tych podziałów. W teraźniejszych warunkach bojowych używano albo tak zwanego, „Buntschiessen“ — jednoczesnego zastosowania pocisków napełnionych rozmaitemi środkami, należącemi do dwóch lub trzech z omówionych grup, albo dość skomplikowanych mieszanin. Takich mieszanin używano tak w postaci fal (mieszaniny z 50% chloru i 50% fosgenu, używane przez Niemców i Anglików; z 70% chloru i 30% chloropikryny (Anglicy); 65% chloropikryny i 35% siarkowodoru (Anglicy)) jak również do napełniania pocisków i bomb, rzucanych przy pomocy specjalnych przyrządów lub z aeroplanów. W tym celu były używane np. przez Niemców rozczyny sternitów w chlorowanem eterze metylowem, rozczyny iperytu w siarczku węgla, chlorku benzolu lub nitrobenzolu, przez Francuzów znany „vincennite“ — mieszanina kwasu pruskiego (50%), chlorku arsenu (30%), chloroformu (5%) i chlorku cyny lub chlorku titanu.
Właściwości tych mieszanin często w znacznym stopniu odróżniały się od działania ich składników, przedewszystkiem co do warunków parowania. Również zauważono pewne przejawy synergizmu. I tak, „martonite“, mieszanina chloracetonu i bromacetonów, jest lepszym lakrymatorem niż czyste substancje z których on się składa.
Zwrócimy uwagę przedewszystkiem na trucizny narządów oddechowych, jako na środki bojowe, których użycie było początkiem wojny gazowej.
Działanie tych trucizn składa się przedewszystkiem z trzech zasadniczych objawów podrażnienia:
1) zmiany rytmu oddechowego, aż do wstrzymania oddechu w okresie wydechu;
2) skurczu mięśni głośni;
3) całego szeregu odruchów ochronnych, przedewszystkiem kaszlu skurczowego.

Rys. 11.
Aparat Mayer’a do badań skutków podrażnienia górnych dróg oddechowych. Do tchawicy zwierzęcia (królika) wstawiono dwie rurki: jedna w kierunku do płuc, druga do górnych części narządów oddechowych. Obie rurki połączono z dużą butlą A. napełnioną czystem powietrzem. Rurka połączona z płucami otwiera się swobodnie, na rurkę zaś połączoną z górnemi oddziałami, przymocowano pęcherz gumowy B. Do tego naczynia idzie rurka C połączona z wymienionym przyrządem Mayer’a celem otrzymania krzywej oddechu. Na pysk zwierzęcia nałożono maskę respiracyjną, połączoną z naczyniem D, zawierającem odpowiednią mieszaninę powietrza i trującego środka, do którego biegnie stały prąd powietrza z gazomierza.
Do tchawicy zwierzęcia (królika) wstawiamy dwie, zagięte pod prostym kątem rurki, jedną w kierunku płuc, drugą w kierunku jamy ustnej. Do tej ostatniej dołącza się duży gumowy pęcherz, z cienkiemi ściankami, znajdujący się w dużem naczyniu ze szkła, do którego przez ten sam korek doprowadzona jest druga rurka, która otwiera się bezpośrednio wewnątrz tego naczynia. Oczywiście, że ujemne ciśnienie, powstałe wskutek wdechu, wywoła rozszerzenie pęcherza, a więc pewien prąd powietrza przez górne drogi oddechowe jamę nosową, gardziel i krtań. Wydech, wywołując w naczyniu dodatnie ciśnienie, kieruje prąd powietrza w odwrotnym kierunku. Jeżeli postawimy koło pyska zwierzęcia maskę do usypiania, zwilżoną odpowiednim płynem, albo lepiej, jeżeli głowa tego zwierzęcia będzie się znajdowała w pęcherzu gumowym szczelnie przylepionym do szyi, przez który przepuszczano prąd powietrza ze stałem stężeniem badanej trucizny, będziemy mieli warunki, w których do płuc i oskrzeli (dolnych części, leżących poniżej krtani) może się dostać tylko niezatrute powietrze, a wszystkie obserwowane zjawiska będą zależne wyłącznie od podrażnienia górnych dróg oddechowych. W ciągu długotrwałych doświadczeń ilość powietrza, znajdująca się w naczyniu, może być za mała wskutek czego powstanie nagromadzenie CO2 i brak tlenu. Ażeby temu zapobiec do przyrządu dołącza się system zastawek, dzięki któremu prąd powietrza jest możliwy tylko w jednym kierunku, a nadto płuczkę z rozczynem ługu dla pochłaniania CO2 i gazomierz z tlenem, który podtrzymuje stałość objętości powietrza, zawartego w naczyniu.
Dzięki przeprowadzonym tak doświadczeniom ustalono, że omówione objawy rzeczywiście są skutkiem podrażnienia dróg górnych i powstają niezależnie od bezpośredniego działania trucizny na płuca.
Wszystkie te objawy są bardzo łatwe do zrozumienia, jeżeli rozpatrywać je z punktu widzenia przystosowania organizmu do nienormalnych warunków. Mają one na celu zapobieżenie dostarczeniu do płuc większych ilości trucizny, wskutek czego powstają zmiany rytmu oddechu w postaci — od wyraźnego zwolnienia, z krótkotrwałym wdechem i długim wydechem, aż do powstania tak zw. duszności wydechowej i zatrzymania oddechu wskutek skurczu wydechowego. Ta sama przyczyna wywołuje skurczowe zamknięcie głośni, którego celem jest niedopuszczenie zatrutego powietrza do czułych pęcherzyków płucnych. Ponieważ takie zabiegi ze strony ustroju nie zawsze są zupełnie skuteczne pewna ilość drażniącego środka przenika wkońcu poniżej krtani, a ponadto powstają jeszcze inne odruchy ochronne, których celem jest wyrzucenie trucizny z płuc — kaszel, a wskutek rozpromienienia tego odruchu — wymioty.
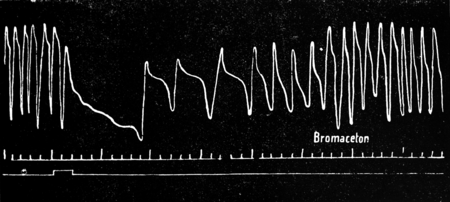
Rys. 12.
Krzywa oddechowa przy podrażnieniu górnych dróg oddechowych bromacetonem w ciągu 2″. Odrazu nastąpiło zatrzymanie oddechu, a następnie wyraźne zwolnienie jego przy zmniejszeniu objętości oddechowej.
Odruchy narządów oddechowych powstają w ściśle określonej kolejności. Jako pierwsza oznaka podrażnienia występuje zahamowanie i nawet chwilowe zatrzymanie ruchów oddechowych, następnie powstają ataki kaszlu, a jako najwyższy stopień rozwoju objawów podrażnienia — skurcz głośni i skurczowy bardzo mocny wydech.
Połączone z temi zmianami w czynności narządów oddechowych zmiany krążenia, podniesienie ciśnienia w żyłach, podniesienie a następnie spadek ciśnienia w tętnicach i osłabienie czynności serca, są wyraźnemi typowemi objawami tego rodzaju duszności. W pewnych, chociaż bardzo rzadkich wypadkach, podniesienie ciśnienia w klatce piersiowej, wskutek skurczowego czynnego wydechu przy zamkniętej głośni, może dosięgać tego stopnia, że serce nie jest już zdolne do napełnienia się krwią w czasie rozkurczu. Skutkiem tego następuje nagła niedokrwistość mózgu, utrata przytomności i nawet natychmiastowa śmierć. Na sekcji, w tych przypadkach nie można znaleźć żadnych zmian anatomicznych. Jest to jedna z typowych cech nagłej śmierci w zatruciu środkami tej grupy.
Zdolność do podrażnienia górnych dróg oddechowych jest cechą całego szeregu środków bojowych. Mocne środki odruchowe nie zawsze są również mocnemi środkami oddechowemi i naodwrót. Wogóle najlepiej zbadane co do napastliwości trucizny oddechowe można przedstawić w postaci następującego szeregu środków wzrastającej czynności. Zupełnie niedrażniące: siarkowodór i siarczek węgla. Mało drażniące: tiofosgen, kwas pruski i bromek benzylu. Mocno drażniące czyli niewdychalne: chlor, fosgen, chlorosiarczan etylu, akroleina, bromaceton, palit i brommetyloetyloketon.
Wszystkie środki działające na narządy oddechowe mogą wywoływać zapalenia, a w większych stężeniach martwicę tkanek, z któremi się bezpośrednio stykają. Dlatego w każdem dostatecznie długotrwałem działaniu tych trucizn powstają mniej więcej poważne zapalenia spojówki, katar jamy nosowej i gardzielowej i w dalszym ciągu zapalenia krtani, tchawicy, oskrzeli i wreszcie samych płuc. Ponieważ zmiany głębokich części narządów oddechowych są stałemi skutkami zatruć truciznami płucnemi i nawet różnica pomiędzy truciznami górnych dróg, a truciznami płucnemi jest przedewszystkiem oparta na wynikach badań anatomicznych, rozpatrzymy szczegóły tych zmian dla wszystkich trucizn oddechowych razem.
Działanie trucizn oddechowych na płuca i oskrzela jest możliwe tylko wskutek niewystarczalności narządów ochronnych i przesączania się powietrza, zawierającego wyżej omówione trucizny niewdychalne, poniżej krtani, albo wskutek tego, że dana trucizna, mogąc wywoływać miejscowe zmiany anatomiczne, nie jest dostatecznie drażniąca, żeby wywołać odpowiednie odruchy ochronne. Pierwsze jest niezbędne w takich warunkach, gdzie człowiek nie jest w stanie usunąć się natychmiast z zatrutego środowiska.
W doświadczeniach ze zwierzętami bezpośrednie działanie na głębokie części narządów oddechowych daje się łatwo uskutecznić przy pomocy tracheotomji t. j. wstawiania w tchawicę odpowiedniego kształtu rurki metalowej, otwierającej się bezpośrednio nazewnątrz i połączonej z źródłem zatrutego powietrza.

Rys. 13.
Krzywa oddechowa przy dostarczeniu pary fosgenu do głębokich części aparatu oddechowego. Wdmuchiwanie powietrza zawierającego fosgen przez kaniulę tchawiczną w ciągu 31/2 sekund wywołało odrazu przyspieszenie oddechu i zmniejszenie objętości oddechowej.
Dostarczenie tych trucizn do głębokich części narządów oddechowych wywołuje również szereg odruchów, mających jednak nieco inny charakter i jako skutek bezpośredniego działania na ścianki małych oskrzeli, skurcz ich mięśni, zdolny w pewnych wypadkach wywoływać w części ich zupełne nawet zamknięcie. Objawy zapalenia i toksycznego obrzęku płuc, najważniejszej ze zmian w zatruciu głębokich części dróg oddechowych, są w wypadkach bezpośredniego działania dużych ilości trucizny bardzo wyraźne.
Co do szczegółów takich zatruć specjalnemi truciznami płucnemi albo wogóle objawów przeniknięcia jakichkolwiek trucizn oddechowych do płuc, to pierwszym i najbardziej stałym symptomem bywa znaczne przyspieszenie rytmu oddechu, który staje się też więcej powierzchownym. Jest to wyrazem dążenia ustroju do najprędszej wentylacji płuc. Jednoczesny skurcz mięśni oskrzeli wytwarza jednak znaczny opór w przechodzeniu powietrza do pęcherzyków płucnych i dlatego, odwrotnie do tego, co mieliśmy na krzywej oddechu przy podrażnieniu górnych dróg, mamy w danym wypadku przedłużony wdech, a nie wydech.
Szereg napastliwości trucizn w stosunku do dolnych dróg oddechowych jest zupełne inny niż dla górnych. Najmniej czynnemi okazują się chlorosiarczan etylu i bromometyloetyloketon, które należały do najmocniejszych. Dalej idą akroleina i palit.
Najczynniejszemi są tlenki azotu i fosgen.
Stopień skurczu oskrzeli w użyciu trucizny można ustalić zapomocą następującego doświadczenia.
Na powierzchni płuc, wyjętych z tylko co zabitego psa, robiono liczne nakłucia ostrą długą igłą w tym celu, aby utworzyć możliwie dużą ilość otworów w ściankach pęcherzyków. Łącząc takie preparowane płuca z gazomierzem, w którym powietrze znajduje się pod pewnem ciśnieniem, otrzymujemy powstanie stałego prądu powietrza np. o 100 cm3 na minutę. Jeżeli do tego wchodzącego do płuc powietrza dodać małą ilość par drażniącego środka, skurcz oskrzeli wywołuje wskutek powiększenia oporu mniej więcej znaczne zahamowanie prądu i ilość powietrza wychodzącego z gazomierza zmniejsza się do 40 — 35 cm3. Stosunek 40/100 będzie wskaźnikiem stopnia zwężenia oskrzeli.
Dolne części narządów oddechowych, znacznie czulsze od górnych, łatwo podlegają zapaleniu, wskutek czego nabrzmiała śluzówka oskrzeli, wydzielająca obficie śluz pomimo skurczu mięśni może stać się o tyle grubą w stosunku do średnicy rurki oskrzelowej, że nastąpi długotrwałe zatkanie tej rurki. W takich wypadkach powietrze, znajdujące się w zraziku płucnym poniżej miejsca zatkania, dość prędko (kilka godzin) wchłania się, tkanka płuc ściąga się i staje się podobną do narządów miąższowych, np. śledziony (splenizacja płuc). Taki stan nazwano niedodmą. Ponieważ płuca znajdują się w przestrzeni o ciśnieniu mniejszem od atmosferycznego, w tych zrazikach, które bezpośrednio łączą się z podległemi niedodmie, ciśnienie wewnętrzne wzrasta w znacznym stopniu i wywołuje ich rozdęcie, a zatem zanik ścianek i tworzenie się dużych pęcherzy, odpowiadających kilkunastu normalnym pęcherzykom. Taki stan rozdęcia płuc, zawsze łączny z niedodmą, zowie się rozedmą zastępczą. Jest to najbardziej typowym objawem anatomicznym w płucach w ostrem zatruciu truciznami oddechowemi.
W razie jeszcze pełniejszego zatkania przez wciąganie kawałeczków obumarłej śluzówki, albo błonek rzekomych z wyżej leżących odcinków dróg oddechowych, niedodma staje się stałą i stopniowo, dzięki procesom zapalnym i martwicy uszkodzonych tkanek, powstaje ściągająca się blizna. Takie blizny pozostają już na zawsze.
Rozedma nie ogranicza się do pęcherzyków, lecz w okolicach uszkodzonej tkanki płucnej, w razie długotrwałego przebiegu, często znajdujemy mniej więcej znaczne jamy, napełnione ropą. Są to rozszerzone oskrzela. Takie zmienione oskrzela nazwano rozdęciem oskrzeli (bronchiektasia). Trzeba odróżniać je od ropników i zgorzeliny płuc, w których ścianki są utworzone z tkanki ziarniowej, jak w każdym innym ropniku i w żadnym wypadku nie są wysłane nabłonkiem.
Co do szczegółów zapalenia narządów oddechowych, to trzeba zauważyć, że po działaniu trucizn bojowych, mamy przeważnie powstawanie wysięku włókninowego, tworzącego obfite błony rzekome w gardzieli, krtani, tchawicy, oskrzelach i nawet we właściwej tkance płuc. W płucach powstaje typowe zapalenie zrazikowe, zwykle obejmujące prawie wszystkie zrazy i bezwzględnie śmiertelne. Jeszcze wcześniej, w początku działania trucizny, albo w takiem stężeniu, które nie jest jeszcze w stanie wywołać powstania wysięku włóknikowego, mamy znaczny stopień obrzęku zapalnego, który powstając w krtani, może też stać się przyczyną nagłej śmierci. W samych płucach takie wzmożenie przesiąkania, a w pewnych truciznach grupy fosgenu nawet swoiste wystąpienie osocza krwi, może stać się źródłem toksycznego obrzęku płuc, napełnienia pęcherzyków płucnych płynem, występującym z naczyń krwionośnych jego ścianek. Teorja tego zjawiska nie jest jeszcze dokładnie ustalona.
Nie ulega wątpliwości, że w pewnych wypadkach mamy tu do czynienia tylko ze zwykłemi skutkami zapalenia w pierwszych okresach jego rozwoju. W drugich znowu wypadkach obrzęk ten jest skutkiem wad krążenia z powodu osłabienia serca. Taki obrzęk płuc obserwowano nawet w działaniu trucizn nie wywierających zwykle żadnego wpływu na narządy oddechowe np. muskariny. Wreszcie znane są przypadki obrzęku płuc, rozwijającego się nagle, o bardzo znacznej ilości płynu obrzękowego, skład którego różni się od zwykłego płynu obrzękowego, i nawet od surowiczych wysięków, tak dalece że wytłumaczenie przyjęte nie wystarcza. Bardziej prawdopodobną wydaje się taka teorja: w normalnych warunkach błonka oddechowa pęcherzyków płucnych jest bezwzględnie nieprzepuszczalną dla płynów i służy tylko do przemian gazowych, nie wyłączając i przesączania się pary wodnej. W razie częściowego uszkodzenia nabłonka oddechowego, staje się on przepuszczalnym dla wysięków zapalnych, ale w niejednakowym stopniu we wszystkich zrazikach, dlatego obrzęk przyjmuje charakter częściowy, nie wykluczający możliwości wykonania czynności oddechowej. W wypadkach, kiedy nabłonek przestaje wykonywać swą czynność wskutek martwicy lub wskutek paraliżu, wywołanego zatruciem, nie przedstawia on już żadnej przeszkody występowania płynów i pęcherzyki natychmiast wypełniają się plazmą krwi, ponieważ w pęcherzykach płucnych zawartość naczyń jest oddzielona od jamki pęcherzykowej cienką warstewką śródbłonka i omówionego wyżej nabłonka oddechowego.
Trucizny, mające właściwość wywoływania takiej nieczynności nabłonka oddechowego, mogą zabijać natychmiast, wywołując tak zw. apoplexia serosa. Zjawisko to jest szczególnie charakterystyczne dla grupy fosgenu.
Ponieważ uszkodzenia nabłonka górnych dróg oddechowych w tych zatruciach są stosunkowo nieznaczne, a nabłonek śluzówki tchawicy może nawet zachowywać swoje rzęski migawkowe, trucizny takie są właśnie prawdziwemi truciznami płucnemi. Wszystkie inne trucizny oddechowe wywołują równocześnie zarówno zmiany w płucach, jak i w górnych drogach oddechowych. Zmiany te wahają się między powierzchownemi uszkodzeniami nabłonka, łatwo potem podlegającego odradzaniu (jak w zatruciach chloropikryną), a zupełną martwicą i odpadnięciem całej śluzówki (zmiany właściwe dla grupy chloru).
Prócz tego w zatruciach środkami oddechowemi nieuniknione są inne zmiany w samych płucach. Ze zmian tych najważniejszemi są: ogólne przepełnienie naczyń płucnych krwią skutkiem zatrzymania krwioobiegu małego i pewna utrata elastyczności płuc (Lungenstarrheit Basza), skutkiem których wytwarzają się porażenie płuc (Lungenblähung) i następnie chroniczna rozedma. Pierwszy z tych stanów jest prawie zwykłym wynikiem działania wszystkich trucizn narządów oddechowych. Przyczyną jego jest po pierwsze niewystarczająca czynność serca, a po drugie zmiany we właściwości tkanki, otaczającej naczynia, polegające na utracie elastyczności. Pewien brak elastyczności, pozostając nawet po uregulowaniu uszkodzeń krwioobiegu, jest znowu przyczyną tego, że w znacznym stopniu powiększa się ilość tak zw. minimalnego powietrza, czyli tej ilości powietrza, która jest zawarta w płucach po wyjęciu ich z klatki piersiowej. Dlatego ciężar gatunkowy takich płuc w wodnej próbie okazuje się mniejszym od normalnego. Podczas sekcji, gdy przednia ścianka klatki piersiowej zostaje usunięta, płuca pozostają tejże samej wielkości, wypełniają całkiem klatkę piersiową, i zakrywają serce, a nie odciągają się, jak zwykle, wtył i do góry.
Równocześnie z temi zmianami prawie we wszystkich wypadkach zatruć truciznami oddechowemi powstaje wyraźne nagromadzenie młodych komórek tkanki łącznej i śródbłonka tak w ściankach pęcherzyków płucnych jak również oskrzelików. Następna organizacja tej tkanki, łącznie z zanikiem swoistych komórek nabłonka oddechowego i migawkowego, powoduje typowe dla toksycznych zapaleń płucnych przewlekłe zmiany — sklerozę (marskość) płuc i broncholitis obliterans czyli zarośnięcie oskrzelików. Zmiany te są najwięcej wyraźne w zatruciach chlorem.
Wszystkie omówione zmiany stanowią bezpośredni skutek zatrucia i w znacznym stopniu mogą być zauważone natychmiast. Po upływie kilku dni do tych zmian dołączają się zwykle liczne zmiany następne, zależne od zakażenia uszkodzonych płuc drobnoustrojami. Nieżyt oskrzeli, zapalenie płuc, zmiany w miejscach dotkniętych niedodmą — przybierają charakter procesów ropnych, wywołanych najczęściej gronkowcami albo paciorkowcami, a w znacznej ilości wypadków typowemi drobnoustrojami zrazikowego zapalenia płuc — dwoinkami płucnemi. W pewnych wypadkach powstaje nawet typowa zgorzelina płuc, wywołana anaerobami. Zwykle są to laseczki wrzecionowate Vincent’a łącznie z krętkami.
Wszystkie te drobnoustroje, które są źródłem zakażenia płuc, pochodzą bezwątpienia z jamy ustnej. Wysięk zapalny i obumarła tkanka przedstawiają dla nich bardzo wygodne warunki istnienia; powikłania te wywołują przeważną część tak zw. śmierci odległych, w ciągu 2-3 tygodni po zatruciu.
W Używane dotychczas trucizny oddechowe można podzielić według ich właściwości toksykologicznych i chemicznych na następujące grupy.
A. Grupa chemicznych środków z działaniem podobnem do działania chloru. Charakterystyczną ich cechą jest stosunkowo niewielka jadowitość wobec wyraźnych uszkodzeń dróg oddechowych. Ta grupa składa się:
1) z chlorowców: chlor i znacznie słabszy co do czynności brom i jod.
2) Grupa organicznych pochodnych siarki: siarczan metylowy SO2(OCH3), chlorosiarczan metylu SO2Cl(OCH3) (vaillantite), chlorosiarczan etylu SO2Cl(OC2H5) (sulvinite).
3) Bezwodnik kwasu siarkowego i dwutlenek siarki SO3 i SO2.
4) Chlorki siarki S2Cl2, SCl2 i SCl4.
B. Grupa fosgenu: chlorobezwodniki kwasów organicznych.
1) Fosgen (bromofosgen i tiofosgen).
2) Pality i superpality.
C. Grupa chloropikryny.
1) Chloropikryna.
2) Akroleina, aldehyd krotonowy, formalina.
D. Grupa tlenków azotu NO, N2O2, N2O4, NO2, N2O5.
E. Grupa dymów bojowych.
1) Dymy obojętne: mieszaniny Bergera, chlorek amonu.
2) Dymy żrące, wytwarzające bezwodniki kwasów nieorganicznych. Fosfor, trójtlenek siarki, chlorek sulfurylu, kwas chlorosulfonowy, chlorek cynowy, chlorek tytanu, chlorek krzemu, chlorek chromilu.
3) Dymy trujące: chlorek arsenu, rozmaite chloroarsyny, mieszaniny Bergera, dające podczas spalania fosgen, mieszaniny chlorku cyny z kwasem pruskim, chloropikryną i fosgenem, mieszaniny chlorku arsenu z fosgenem.
F. Grupa amoniaku.
Znaczna część omówionych środków nigdy nie miała wielkiego znaczenia i próby używania tych środków należą do pierwszych okresów rozwoju broni chemicznej. Tak liczne pochodne siarki, pomimo wyraźnych właściwości żrących i mocnego działania na górne drogi oddechowe, pozostały prawie bez użycia, chociaż estry kwasu siarczanego, a szczególnie siarczan metylu są nietylko truciznami oddechowemi, lecz też potężnemi truciznami ogólnemi. Siarczan metylu np. powoduje u zwierząt głęboką śpiączkę, oraz ataki skurczowe.
Pochodnych (estrów) kwasu chloro-sulfonowego używali Francuzi do napełniania pocisków. Zasadniczą właściwością tych środków jest wywoływanie toksycznych zapaleń płuc. Bezwodnik kwasu siarczynego SO2, pierwszy z używanych gazów bojowych, jest znacznie mniej jadowity niż inne środki, nawet niż chlor. Był on oddawna używany dla celów taniej dezynfekcji i niszczenia szkodników, przedewszystkiem w stanie tak zw. gazu claytonowskiego dla deratyzacji (niszczenie szczurów) w okrętach. Jest to ciężki (ciężar gatunkowy 2,2) bezbarwny gaz o nieprzyjemnym duszącym zapachu, znany każdemu. Dość łatwo podlega skropleniu (punkt wrzenia 8°); łatwo jest rozpuszczalny w wodzie (79,8 na litr wody). Powstaje przy spaleniu siarki, albo przy spaleniu mieszaniny spirytusu z siarczkiem węgla, wraz z CO2. Do celów bojowych jest mało użyteczny wskutek zbyt małej jadowitości. Ludzie łatwo wytrzymują obecność jego do 2/M3. Doświadczenia z zatruciem zwierząt na wolnem powietrzu dały wyniki ujemne. Pomimo tego w znacznych stężeniach (kilka %) jest on jednym z najmocniejszych środków odruchowych, mianowicie wywołujących skurcz mięśni głośni i oskrzeli.
Działanie chlorków siarki SCl2 i SCl4 zależy od rozkładu ich na chlor i jednochlorek siarki S2Cl2, więc nie różni się od działania chloru. Jadowitość jednochlorku siarki jest mało zbadana, ale w każdym razie nieznaczna. Lehman zalicza ten związek, używany w znacznych ilościach przy wulkanizacji kauczuku, do substancyj obojętnych.
Z dużej liczby pochodnych kwasu siarczynego i siarkowego rolę środków bojowych odgrywała dość niewielka ilość. Są to po pierwsze nieorganiczne związki zawierające chlor, mianowicie: chlorek sulfurylu SO2Cl2, kwas chlorosulfonowy OH.SO2.Cl, chlorek tionylu SO.Cl2, i chlorek pyrosufurylu Cl2S2O5. Żadny z tych związków nie posiada samodzielnego znaczenia za wyjątkiem kwasu chlorosulfonowego, który używano jako dym bojowy. Są one jednak ciekawe jako stałe domieszki do pewnych trucizn bojowych, mianowicie używanych przez Francuzów w początku wojny gazowej vaillantite i sulvinite. Są to płyny któremi napełniano pociski. Obydwa omówione środki są złożonemi mieszaninami organicznych pochodnych kwasu chlorosiarczanego. Vaillantite jest przeważnie chlorosiarczanem metylu, a sulvinite chlorosiarczanem etylu. Wzory ich są Cl.SO2OCH3 i Cl.SO2OC2H5. Napastliwość tych środków jest bardzo znaczna: vaillantite drażni górne drogi oddechowe w stężeniu 0,06/M3 a sulvinite nawet w stężeniu 0,04/M3. Obydwa są dość mocnemi lakrymatorami i wywołują w płucach zmiany bardzo podobne do obserwowanych w zatruciach chlorem. Zabójcze stężenie dla vaillantite jest 2/M3 dla sulvinite nieco więcej.
Bardzo ciekawym jest z powodu swoich właściwości drażniących należący też do pochodnych kwasu chlorosiarczanego chlorosiarczan trójchlorometylu CCl3O.SO2Cl. Jest to stałe ciało dotychczas jeszcze mało zbadane z punktu widzenia toksykologicznego.
Wśród organicznych pochodnych kwasu siarczanego nie zawierających chloru znajduje się też cały szereg niebezpiecznych trucizn jak to siarczan dwumetylowy (CH3)SO4, i kwas metylosulfonowy CH3SO2OH jak również homologiczne pochodne etylowe. Są to jednak raczej trucizny z działaniem ogólnem i są one w każdem razie mniej drażniące niż związki chlorowane. Przewlekłe zatrucie siarczanem dwumetylu powoduje zapalenie płuc, nawet bez żadnych przejawów natychmiastowych.
Bardzo mało czynnym okazał się amoniak. Próby używania amoniaku były dość liczne. Chociaż obecność tego gazu daje się zauważyć już w stężeniach 0,1/M3, nawet w stężeniu 4/M3, nie wywołuje on jeszcze poważnych skutków i powietrze pozostaje wdychalnem aż do stężenia 200/M3.
Chlor, w porównaniu z innemi środkami bojowemi, jest bardzo słabą trucizną. Dla człowieka niebezpieczne stężenie chloru rozpoczyna się od 6/M3. Koncentracja 10 M3 jest już bezwzględnie śmiertelną. Obecność chloru w powietrzu (według danych Lehmana) można zauważyć od stężenia 0,003/M3, które jest już wyrażnie drażniące i wywołuje w drogach oddechowych uczucie zimna. Stężenie 0,006/M3 wywołuje łzawienie i ślinienie, 0,01/M3 — wyraźny nieżyt dróg oddechowych, 0,03/M3 może wywołać po dłuższem działaniu zmiany w płucach. Według nowszych danych mamy następujące liczby: zapach chloru można zauważyć rozpoczynając od 0,01/M3, podrażnienie górnych dróg następuje w stężeniu 0,48/M3, powietrze staje się niewdychalne, gdy stężenie chloru dosięgnie 0,96/M3. Zabójcze działanie (na psy) obserwowano od 10/M3. Drobne zwierzęta są znacznie czulsze. Świnka morska ginie w stężeniu 2/M3.
Z powodu szeregu właściwości wygodnych do celów wojennych używano chloru w początku wojny z bardzo dodatniemi wynikami. Od użycia chloru w kwietniu 1915 roku na froncie francuskim datuje się rozpoczęcie wojny gazowej.
Chlor jest gazem ciężkim (21/2 razy cięższy od powietrza) żółto-zielonej barwy z charakterystycznym nieprzyjemnym zapachem. Jest on bardzo czynnym chemicznie i łatwo tworzy cały szereg związków. W warunkach podniesienia ciśnienia (przy temperaturze 18° do 16,5 atm.) lub obniżenie temperatury do -34°C (ciśnienie 760 mm) chlor łatwo podlega skropleniu, tworząc płyn (z c. g. 1,46) wrzący o -33,5°C. i zabarwiony na zielono-żółty kolor. Przy -102°C płyn ten przybiera postać blado-żółtej masy. Chlor łatwo rozpuszcza się w wodzie w stosunku 2,15 na 100 wody.
Dzięki właściwości łatwego stężenia, chlor używano tak dla bojowych, jak i dla technicznych celów w postaci płynu zawartego w stalowych bombach. Jest to możliwe dlatego że suchy chlor na żelazo nie działa, gdy w obecności wody powstaje łatwo rozpuszczalny związek Fe2Cl6.
Chlor oddawna otrzymano w dużych ilościach z soli kuchennej. W tym celu z początku otrzymuje się kwas solny, który następnie rozkłada się przy działaniu nadtlenku manganu według wzoru MnO2 + 4HCl = 2H2O + MnCl2 + Cl2. Nadtlenek manganu można otrzymać zpowrotem z pozostałego MnCl2 przez następne obrabianie kredą, wapnem lub tlenkiem magnesu.
Istnieją też sposoby utleniania HCl tlenem powietrza w obecności dwuchlorku miedzi jako katalizatora (sposób Deakon’a); jak również utleniania chlorku magnezu też w prądzie gorącego powietrza. Najwygodniejszym sposobem jest elektroliza stężonego wodnego rozczynu soli kuchennej. Jako wynik takiej elektrolizy mamy na anodzie czysty chlor, a na katodzie wodorotlenek sodu i wodór. W ten sposób otrzymano teraz chlor wszędzie gdzie jest źródło taniej energji elektrycznej.
W organizmie łączy się on przede wszystkiem z wodą według wzoru Cl2 + H2O = HClO + HCl; kwasy te w obecności jonów Na tworzą sole NaCl i NaClO. Ostatnia sól pod wpływem CO2 rozkłada się we krwi w sposób następujący:
2 NaClO + CO2 = Na2CO3 + Cl2 + O
Chlor jest więc mocnym odczynnikiem utleniającym. Reakcje z Cl zachodzą w ustroju bardzo powoli i dlatego podczas sekcji zatrutych chlorem można zawsze zauważyć zapach jego (przeważnie w mózgu) jeszcze po 1 — 2 dniach.
Przy pomocy odpowiednich odczynników — sole talu i odczynnik Fitzgeralda (mieszanina rozczynów żelazocyanku potasu i cytrinianu żelaza) udało się ustalić iż w razie śmiertelnych zatruć chlorem w naczyniach krwionośnych płuc może powstać wolny kwas solny. Dla otrzymania takiego wyniku potrzebne stężenie chloru wyżej od 25/M3. W takich wypadkach w płucach zauważono nagromadzenie typowych kryształów chlorku talu, które łatwo ustalić przy badaniu mikroskopowem, lub osad błękitu pruskiego, tworzącego w tkance płuc wyraźne plamki. W razie mniejszego stężenia odczynnik Fitzgeralda daje bronzowo-żółte plamki wskutek powstania Fe(OH)3.
W takich wypadkach zabarwienie płuc jest niezwykłe już wskutek rozkładu hemoglobiny krwi, która tworzy bronzową kwaśną hematinę lub nawet heminę, jej pochodne chlorowane. Następnie te bronzowe barwniki podlegają obezbarwieniu wskutek działania HClO i przybierają brudno-zielonawy a nareście żółty kolor. Odpowiednie zmiany barwniku krwi dają się łatwo ustalić przez badania spektroskopiczne.
Chociaż działanie chloru na ustrój było badane oddawna — istota tego działania nie jest jeszcze dokładnie wyjaśniona. Należy najpierw zwrócić uwagę na stare poglądy Binca, który doszedł do przekonania, że wszystkie chlorowce mają znaczenie środków narkotycznych. Jest jeszcze rzeczą zupełnie nieustaloną czy działanie Cl polega, jak w użyciu innych środków narkotyzujących, mających właściwości ciał chemicznie biernych, tylko na zjawiskach przeładowania, nasycenia chlorem lipoidów komórek nerwowych, czy też na powstawaniu przetworów chlorowanych przez dołączenie chloru do związków o podwójnem połączeniu C albo wogóle przez chlorowanie składników ustroju. Podkreślić należy, że mózg rzeczywiście zawiera wolny chlor, łatwy do określenia zapomocą odczynu ze skrobią i jodkiem potasu, jeszcze wówczas gdy w innych tkankach już go zupełnie brakuje.
Po drugie wiadomem jest, że chlor, działając na wodę, daje kwas solny i wraz z nim czynny tlen.
Nagromadzenie w ustroju kwasu solnego musi wywołać zjawiska tak zw. acidozy, czyli powiększenia stopnia kwasowości krwi ze wszystkiemi następczemi zmianami. Przeciw takiemu przypuszczeniu przemawiają jednak następujące okoliczności, że 1) kwas solny jest znacznie mniej jadowity niż chlor (mniej więcej 30 razy). Do zabicia psa trzeba na kg nie mniej od 2,0 kwasu solnego wprowadzonego dożylnie, wówczas gdy śmiertelna dawka Cl2 przy wdychaniu waha się około 0,008 — 0,06. 2) Bardzo nieznaczną jest zmiana stężenia jonów wodoru w zatruciu chlorem (w normie pH=7,4 po zatruciu Cl2 — 7,25), i ta nieznaczna różnica znika po usunięciu ze krwi CO2, zapomocą prądu powietrza. O pewnym stopniu acidozy, którą organizm jest w stanie całkiem zrównoważyć, wnioskujemy ze znacznego wzrostu kwaśności moczu i zawartości znaczniejszych ilości kwasu solnego w soku żołądkowym, co wywołuje nawet u zatrutych chlorem ataki bólów żołądka.
Częściowo skutkiem tej acidozy, częściowo zaś skutkiem bezpośredniego działania na procesy chemiczne w tkankach, prawdopodobnie w zależności od działania czynnego tlenu, powstają niewątpliwie zmiany w przemianie materji. U wszystkich jednostek, zatrutych dawkami chloru nie powodującemi śmierci, mamy stale wyraźne podniesienie wydzielenia N, dwa razy większe w porównaniu z okresem, poprzedzającym zatrucie.
Przyczyną natychmiastowej śmierci mogą być miejscowe zmiany w płucach (przedewszystkiem ich obrzęk) i zmiany krwi; znaczna anhydremja i powiększona krzepliwość, która jest źródłem powstania niebezpiecznych zakrzepów (najczęściej w żyłach nóg) powodujących następnie zgorzelinę.
Wśród klinicznych postaci zatrucia chlorem i innemi związkami tej grupy, najważniejszemi są następujące.
1) Śmierć natychmiastowa lub w ciągu kilku minut po działaniu stężenia wyższego niż 0,1% (10,0)M3 dla ludzi i od 0,5% (50) M3 dla zwierząt. W pewnej nieznacznej ilości przypadków mamy tu śmierć wskutek skurczu głośni, zwykle jednak jest ona wywołana nagłym rozkładem krwi wskutek powstania pod wpływem HCl kwaśnej hematyny. Badanie pośmiertne wykazuje w tych razach niezwykłe zabarwienie płuc, które są usiane bronzowemi, zielonemi i żółtemi plamami. Natomiast obrzęk płuc i zjawiska zapalenia nie występują wyraźnie z powodu szybkiej śmierci.
2) Ostre zatrucia, wywołujące śmierć w ciągu 20 — 30 minut po kilku godzinach (do 2 — 3 dni) po zatruciu, następują po działaniu stężenia 6/M3 do 10/M3. Najważniejszym objawem tej postaci zatruć jest ostry obrzęk płuc z następną anhydremją, do których dołączają się zwykle objawy osłabienia serca. Kliniczne objawy polegają przedewszystkiem na męczącej duszności. Objawy zapalne występują dość wyraźnie w długotrwałych przypadkach, przeważnie w górnym odcinku dróg oddechowych.
3) Podostre zatrucia, obserwowane u oporniejszych jednostek w tychże lub nieco słabszych stężeniach. Z początku występują tu dość wyraźne objawy podrażnień śluzówki oczu, nosa i gardzieli, do których prędko dołącza się silny nieżyt, a następnie tworzenie się w gardzieli i jamie nosa błon rzekomych, jak w błonicy. Nieżyt rozpowszechnia się następnie na oskrzela, a w płucach powstaje zapalenie zrazikowe z początku toksyczne, a później o charakterze bakteryjnym. W niektórych przypadkach obserwowano zgorzel płuc. Bardzo często tworzy się rozszerzenie oskrzeli.
W czasie wojny chlor był używany sam przez się lub z dodatkiem pewnych substancyj, jak fosgen (50%) i chloropikryna, do tworzenia fal gazowych. Do tego celu służyły duże stalowe butle napełnione płynnym chlorem, używane w czasach pokoju do przewożenia i przechowywania tego odczynnika. Chlor należy do stosunkowo łatwo skraplających się gazów.
Ujemną cechą chloru jest to, że wskutek swojej wyraźnej czynności chemicznej jest on trucizną bardzo łatwą do zwalczania. Nawet wilgotna chustka jest już w pewnym stopniu skuteczną obroną. Maski z kilku warstw muślinu, zwilżonego rozczynem tiosiarczanu sodu z dodatkiem węglanu sodu i gliceryny, używano już w pierwszym czasie powstania wojny gazowej. Tiosiarczan sodowy Na2S2O3 rozkłada się w obecności chlorowców według wzoru:
t. j. powstaje sól kuchenna i sodowa sól kwasu tetrationowego. Teraźniejsze maski z aktywowanym węglem pochłaniają chlor również bardzo łatwo. Do wytwarzania chmury gazowej potrzebną jest olbrzymia masa materjału. Dostarczenie na pole walki dużej ilości bardzo ciężkich butli z chlorem jest niełatwem zadaniem. Prócz tego wyniki ataku są uzależnione od kierunku i siły wiatru i od stopnia wilgoci powietrza. Niema więc nic dziwnego, że gdy użyto chloru, tylko pierwszy atak gazowy ze strony Niemców na zachodnim froncie 22.IV.1915 r. miał rzeczywiście zatrważające wyniki. Z 12.000 Kanadyjczyków, którzy padli ofiarą tego ataku, po upływie 5 dni pozostało przy życiu tylko 2.000. Przeważna część była zabita natychmiast. Drugiego takiego ataku nie udało się już dokonać aż do 19.XII.1915 r. Użyto wtedy jeszcze niebezpieczniejszej mieszaniny chloru i fosgenu, lecz skutki ataku dzięki użyciu masek były znacznie mniej przerażające. Prawdopodobnem jest, że w pierwszym ataku Niemcy użyli na każdy krok swego frontu nie mniej niż jeden cylinder zawierający 40 — 45 funtów płynnego chloru, który nagle wyrzucono w przeciągu kilku minut.
Innych środków, należących do grupy chloru, a również pochodnych kwasu siarczanego, nigdy nie używano w takich rozmiarach. Technika ataku gazowego podległa później znacznym zmianom, dzięki użyciu pocisków gazowych; dla tego celu jadowitość chloru jest niewystarczająca, wskutek czego ma on obecnie już tylko znaczenie historyczne.
Wśród współczesnych środków duszących na pierwszy plan występują fosgen i inne związki tej grupy.
O znaczeniu grupy fosgenu dla celów wojennych można wnioskować z tego, że Niemcy użyli w czasie wojny 10682 tonn fosgenu i 15616 tonn palitu. We Francji ilość otrzymanego fosgenu osiągła 15800 tonn. Zakład w Edgewood wyrabiał aż do 40 tonn codziennie i za krótki czas jego czynności było dostarczono dla wojska 1616 tonn. Superpalit w większych ilościach wyrabiali tylko Niemcy. Produkcja jego osiągała 600 tonn na miesiąc.
Zasadniczą właściwością chemiczną tej grupy jest zdolność do odszczepiania pod wpływem wody kwasu solnego. Są one wszystkie tak zwanemi chlorobezwodnikami kwasów organicznych: węglowego i mrówczanego. Pochodne wyższych homologów kwasów tłuszczowych (np. kwasu octowego) mają mniej wyraźne właściwości trujące.
Kwas węglowy
| CO< | OH OH |
Węglan dwumetylowy
| CO< | OCH3 OCH3 |
Chloropochodne węglanu dwumetylowego
| CO< | OCH2Cl OCH3 |
| CO< | OCHCl2 OCH3 |
| CO< | OCCl3 OCH3 |
| CO< | OCCl3 OCH2Cl |
| CO< | OCCl3 OCCl2 |
| CO< | OCCl3 OCCl3 |
(najważniejsza domieszka superpalitu)
| CO< | O—CH2Cl O—CH2Cl |
| CO< | O—CHCl2 O—CHCl2 |
| CO< | O—CHCl O—CHCl2 |
| CO< | OCH2Cl OCCl3 |
| CO< | OCHCl2 OCCl3 |
| CO< | Cl Cl |
Kwas mrówczany
| CO< | H OH |
Kwas chloromrówczany
| CO< | Cl OH |
Chloromrówczan metylu
| CO< | Cl OCH3 |
Chloromrówczan chlometylu
Palit. K Stoff
| CO< | OCH2Cl Cl |
Chloromrówczan trójchloru metylu. Superpalit Dwufosgen
| CO< | Cl OCCl3 |
Kwas octowy
| CO< | OH CH3 |
Kwas dwuchlorooctowy
| CO< | CHCl2 OH |
Dwuchlorooctan etylu
| CO< | CHCl2 OC2H5 |
Czynność ich zależy od obecności grupy —CO—Cl.
Przy działaniu na fosgen wody mamy następną postać rozkładu
Chlorobezwodniki są wogóle bardzo czynnemi związkami i łatwo reagują z całym szeregiem innych substancyj jak np. z amoniakiem i jego pochodnemi, z alkoholami i t. d.
Tak np. fosgen tworzy z suchym amoniakiem mocznik: COCl2 + 2NH3 = CO(NH2)2 + 2HCl, z dwumetylfenilaminą — benzofenon.
| 2.(CH3)2C6H3NH2 + COCl2 = 2 HCl + CO< | C6H3(CH3)2 C6H3(CH3)2 |
z aldehydami reaguje on w taki sposób
| O ‖ | ||||||
| R—C | / H \ O |
+ C | / Cl = O \ Cl |
= R—C | / O—C—Cl — Cl \ H |
I tak z chloralu według wzoru: CCl3COH + COCl2 = CCl3—CHCl—O—COCl powstaje C3Cl5HO2
W taki sposób mogą łatwo powstać duże cząsteczki złożonej budowy. W związku z tem zwracamy uwagę, że zastępując chlor przez brom i tlen przez siarkę otrzymujemy podobne związki: bromfosgen COBr2 i tiofosgen CSCl2, wogóle bardzo niestałe i znacznie mniej trujące.
Fosgen, palit i superpalit są najniebezpieczniejszemi ze wszystkich środków duszących. Były one w dalszym ciągu wojny gazowej używane w dużych ilościach do napełniania specjalnych pocisków (niemieckie pociski z białą literą D); do tych celów najlepiej nadawały się płynne pochodne kwasu chloromrówczanego (pociski z zielonym krzyżem u Niemców zawierające superpalit) i z białą literą C (palit albo KStoff). Z tych pocisków pociski białe C zawierały czysty superpalit, a pociski z zielonym krzyżem: 1) superpalit i chlorek fenilkarbylaminy, 2) mieszaninę superpalitu z 35% chloropikryny, 3) superpalit, fosgen i dwufenylochoroarsinę.
Jadowitość fosgenu jest rzeczywiście bardzo znaczna. Zajmuje on co do jadowitości w szeregu środków użytecznych do zatruwania powietrza drugie miejsce, na pierwszem miejscu stoi kwas pruski, który w warunkach doświadczeń laboratoryjnych zabija psy i króliki natychmiast już w stężeniu 0,1/M3 = 1(10-7). Dla fosgenu mamy 0,25(M3) = 25(10-8) (Mayer). Według innych badaczy mamy dane następujące: stężenie 0,02(M3) = 2(10-8) jest już nie do wytrzymania dla ludzi; w stężeniu 0,05(M3) = 5(10-8) obserwowano już śmiertelne wypadki.

Rys. 14.
Krzywa postępowego wzrastania obrzęku płuc w czasie zatrucia fosgenem. Normalny stosunek wagi płuc do wagi ciała jest 8‰ (punktowana linja — równoległa osi odciętych). Rzędne oznaczają zmianę tego stosunku w ciągu pierwszych 6 dób po zatruciu. Stosunek ten podnosi się w ciągu pierwszych 12 godzin aż do 40‰ i następnie powoli obniża się w ciągu 3—6 dób do pierwotnego stanu.
Palit w porównaniu z fosgenem jest mniej jadowity — zabija on króliki w stężeniu nie niższem od 1(M3) = 1(10-6). Psy są znacznie odporniejsze (śmiertelne stężenie od 4(M3), prawdopodobnie to samo odnosi się też do ludzi. Superpalit (dwufosgen, Grünkreutz) nie ustępują co do jadowitości fosgenowi.
Ażeby wywołać zmiany pod wpływem kwasu solnego, powstałego z rozkładu fosgenu, na hemoglobinę krwi, więc tworzenia się kwaśnej hematyny podobnie do tego, co obserwowano w nagłej śmierci w przypadkach zatrucia chlorem, potrzebne są praktycznie nieosiągalne stężenia. Takie zmiany były zauważone tylko u zwierząt zatrutych w komorach gazowych czystym fosgenem.
Zwykłą przyczyną nagłej śmierci, w zatruciu temi środkami ludzi i zwierząt jest nagle powstający, niezwykle obfity obrzęk płuc. Obrzęk ten nigdy nie powstaje natychmiast po zatruciu, lecz potrzebuje do swego rozwoju kilku godzin czasu. Rozwój jego jest prawie że proporcjonalny do liczby ct t. j. zależy zarówno od stężenia jak i od czasu działania. Ponieważ fosgen w trujących stężeniach jest tylko słabo drażniącym, — wywołuje on jednak w stężeniu 0,1/M3 napady kaszlu, kichania, połączonego w pewnych przypadkach z wymiotami, — więc nie można go zaliczyć do gazów niewdychalnych, zarówno dla zwierząt doświadczalnych jak dla ludzi. Na polu walki z początku można zupełnie nie zauważyć obecności trucizny, którą jednak można odczuć dzięki charakterystycznemu zapachowi, podobnemu do zgniłych jesiennych liści albo owoców i dzięki zjawiskom parosmii (zmiana zdolności rozróżniania zapachów, np. wstręt do tytoniu u palących). Znane są przykłady niespodzianego zatrucia całych plutonów, które nie dostrzegły niebezpieczeństwa.
Długotrwałe działanie nieznacznych stężeń albo znaczniejsze stężenia działające w ciągu kilku minut, powodują po upływie pewnego czasu obrzęk płuc, który prędko wzrasta. Tak w doświadczeniach na kotach (Heitzman) mamy przy ct=450 po trzech godzinach wzrost stosunkowy wagi płuc (stosunek pomiędzy wagą płuc, a wagą ciała) z 8‰ do 12&premil;, po 5 godzinach do 23,5%permil;, a po 10 godzinach dosięga on najwyższego stopnia rozwoju do 40‰. Jeżeli zwierzę przeżyje ten okres, następuje powolne wchłanianie płynu w ciągu 2 — 3 dni. Skład płynu obrzękowego jest podobny pod względem zawartości białka do osocza krwi. Dlatego powstawanie obrzęku nie powoduje anhydremji, a tylko polyglobulje, t. j. we krwi wzrasta stosowna ilość krwinek bez powiększenia stężenia osocza. Zależnie od zmian właściwości krwi, także w pewnym stopniu wskutek bezpośredniego działania trucizny na mięsień serca powstaje ostre rozszerzenie serca, słabość jego i wreszcie porażenie. Porażenie to może nastąpić po upływie kilku dni albo tygodni po zatruciu i jest zwykłą przyczyną śmierci odległej. Dlatego na sekcji ludzi i zwierząt zatrutych fosgenem albo palitami znajdujemy zwykle serce w stanie wyraźnego rozkurczu, przepełnione krwią, zwłaszcza prawa jego komora.
Objawy zapalenia płuc i oskrzeli są obserwowane tylko wyjątkowo jako skutek następnych zakażeń. Bardzo wyraźną jest chroniczna rozedma, wskutek utraty elastyczności tkanki płucnej.
Sposób toksycznego działania trucizn tej grupy jest bardzo mało wyjaśniony. Istniały co do tego następujące cztery teorje.
Teorja acidozy, opierająca się na powstawaniu podczas hydrolizy fosgenu kwasu solnego. Oczywistem jest, że ponieważ kwas solny, nawet po bezpośredniem wprowadzeniu do krwi jest 800 razy mniej jadowity niż fosgen, niema mowy o takiej bezpośredniej acidozie, której objawy zresztą są zupełnie inne. Wskutek tego przypuszczano, że mamy tu do czynienia z wewnątrzkomórkową acidozą. Trucizna rozpuszczalna w lipoidach komórki przenika do jej wnętrza i rozkładając się na kwas solny i dwutlenek węgla, zabija żywą zarodź. Takie tłumaczenie nie godzi się z brakiem w tych zatruciach jakichkolwiek wyraźnych objawów martwicy i zwyrodnienia komórek. Jak już podkreślono w zatruciach tych nie spostrzegano żadnego wyraźnego działania na bardzo czuły nabłonek dróg oddechowych. Trzecim możliwym skutkiem acidozy jest zmiana odczynu tkanki i jej właściwości koloidalnych. W tych warunkach zmienia się jej zdolność do pochłaniania wody i powstaje typowy obrzęk. Jednak w obrzęku fosgenowym mamy nie nagromadzenie wody w tkankach płuc, a naodwrót występowanie z naczyń osocza krwi bez jakichkolwiek znaczniejszych zmian zwykłego stężenia krwi i płynu tkankowego. Brak jakichkolwiek zmian w odczynie moczu i zawartości jonów H we krwi też trudno połączyć z przypuszczeniem acidozy.
Druga teorja polega na przypuszczeniu zatrucia tlenkiem węgla powstałym przez rozkład fosgenu we krwi, odwrotnie do jego syntezy, według wzoru COCl2 = CO + Cl2. Taki rozkład jest mało prawdopodobny.
Obecność CO byłaby bardzo łatwa do ustalenia ze zmiany widma hemoglobiny, nie mówiąc już nawet o tem, że objawy zatrucia czadem nie mają nic wspólnego z objawami zatrucia fosgenem. Również trzeba zwrócić uwagę, że próg napastliwości dla CO jest 0,6/M3 gdy dla fosgenu 0,05/M3.
Trzecia teorja polega na przypuszczeniu istnienia bezpośredniego połączenia fosgenu z białkiem. Hydroliza fosgenu ostatnio nie odgrywa poważnej roli podczas jego rozkładu w ustroju, o ile chodzi o stężenie słabe, używane zazwyczaj, a reakcja krwi nie zmienia się przez przepuszczanie prądu zatrutego powietrza nawet in vitro. W takich warunkach następuje inne bardzo ciekawe i mało zbadane zjawisko: 98% fosgenu zawartego w powietrzu znika podczas przepuszczania przez krew bez jakichkolwiek zmian we właściwościach hemoglobiny i bez powstania bliżej określonych pochodnych. Tylko po dłuższym okresie działania i pochłanianiu wielkich ilości COCl2 powstaje powoli zmiana odczynu na wyraźnie kwaśny i tworzenie się kwaśnej hematyny. Krew, która pochłonęła kilka bezwzględnie śmiertelnych dawek fosgenu, okazuje się przy dożylnem wstrzyknięciu zupełnie obojętną. Zjawisko to nie jest jeszcze dokładnie zbadane, możemy jednakże z niego wywnioskować, że fosgen w ustroju ulega prócz hydrolizy innym zmianom, które następują nawet wcześniej niż hydroliza. Znana jest zdolność białka, wynikająca z jego oddziaływania dwoistego (odczyn amfoteryczny), do pochłaniania znacznej ilości zarówno kwasów jak i zasad, a z drugiej strony łatwość powstawania przez połączenie fosgenu z grupami NH.CO.NH;−C.CO.C.;NH−CO.C= podwójnych cząsteczek, podobnie do omówionego wyżej powstawania benzofenonów. Takie odczyny są bardzo prawdopodobne dla białka i mogą wywołać powstanie nowych ugrupowań jego molekuł, niezdolnych do wykonania zwykłych odczynów życiowych. W takim razie fosgen miałby właściwości porażającej trucizny komórkowej. Podstawy tej teorji ogłosił w roku 1922 prof. Wojnicz Sianożęcki.
Ostatnią możliwością tłumaczenia działania fosgenu jest tak zw. działanie cząsteczkowe, więc niezależne od rozkładu. Jednak katalityczne działanie nie było dotychczas ustalone, a miejscowe działanie na płuca wobec braku jakichkolwiek ogólnych objawów czynią takie przypuszczenie mało prawdopodobnem. Będąc w stanie, dzięki rozpuszczalności w lipoidach, przeniknąć do wnętrza komórek, fosgen ulega zniszczeniu już w pierwszych dostępnych dla niego komórkach. Dlatego za podstawę wszystkich objawów zatrucia temi środkami przyjmujemy, jako najprawdopodobniejsze, miejscowe funkcjonalne uszkodzenie nabłonka pęcherzyków płuc.
Co do ogólnych właściwości trucizn, należących do tej grupy, to trzeba zanotować następujące dane:
1) fosgen (collongite u Francuzów) w zwykłej temperaturze (15 — 20C°) jest bezbarwnym gazem 3,5 raza cięższym od powietrza. W T° -8°C i ciśnieniu 760 mm tworzy się z tego gazu bezbarwny płyn. Otrzymują go zwykle przez bezpośrednie połączenie czadu i chloru CO−Cl2 = COCl2, używając węgla jako katalizatora, lub przez działanie na chlorek węgla CCl4 bezwodnika kwasu siarczanego, t. zw. oleum, albo dymiącego kwasu siarczanego według wzorów.
CCl4 + 2SO3 = COCl2 + S2O5Cl (chlorek pirosulfurylu). CCI4 + H2S2O7 = COCl2 + SO2Cl2 (chlorek sulfurylu).
Ostatni sposób był używany z początku we Francji, teraz go zupełnie zaniechano.
Znaczne ilości fosgenu wytwarzają się podczas spalania tak zw. mieszaniny Berger’a, składającej się z 48% C2Cl6; 47% KClO3 i 5% C. Powstający stąd dym zawiera 40,6% fosgenu i 20% czadu, 32% CO2 i pewne ilości HCl i Cl2.
2) Palit ClCOOCH2Cl chloromrówczan chlorku metylu stanowi bezbarwną ciecz z ciężarem gatunkowym 1.236 i punktem wrzenia +71,4°C. Łatwo paruje. Para ma swoisty drażniący zapach inny niż fosgen. W ustroju rozkłada się z powstaniem aldehydu mrówczanego.
3) Superpalit (Perstoff u Niemców) chloromrówczan trójchlorku metylu albo dwufosgen ClCOOCCl3 jest bezbarwną cieczą, z punktem wrzenia +128°C. Jest on znacznie mniej zdolny do hydrolizy i dlatego trwalszy od fosgenu i palitu.
Palit i superpalit otrzymują się przez chlorowanie mrówczanu metylu HCO2CH3 lub przez działanie fosgenu na alkohol metylowy według wzorów.
COCl2 + CH3OH = ClCO.OCH3 + HCl
ClCOOCH3 + 3Cl2 = ClCOOCCl3 + 3HCl
ClCOOCH3 + Cl2 = ClCOOCH2Cl + HCl
Dość liczne inne związki tej grupy omówione wyżej, nie są tak jadowite i do celów bojowych nie były używane. Pochodne kwasu węglowego są prawie obojętne.
Trzy następne grupy (C, D, E) środków oddechowych obejmują takie substancje, które oprócz działania na narządy oddechowe mają jednocześnie i inne właściwości, dzięki którym można je przenieść również do innych zasadniczych grup.
Tak np. chloropikryna ma wyraźne właściwości drażniące i dlatego można byłoby zaliczyć ją do trucizn odruchowych, chociaż jest ona najsłabszym z tych środków (próg wrażliwości według Fries’a i West’a — 0,019/M3, gdy dla kamitu mamy = 0,0003/M3). Ma ona jednak w tych stężeniach już wyraźne właściwości trucizny, wywołującej zapalenie narządów oddechowych. Należąca do tejże grupy akroleina, będąc gazem silnie trującym, wywołuje podrażnienie i odpowiednie odruchy (łzawienie) w stężeniu 0,075/M3. Grupa tlenków azotowych niezależnie od tego, że posiada właściwości środków duszących, chociaż słabo uwydatnione, ma szczególne wyraźnie działanie na naczynia krwionośne, wywołując ich porażenie.
Trucizny tego rodzaju naogół mało używano do świadomych zatruć. Tlenków azotu (NO2) używano w Niemczech jako domieszki do chloru tylko w pierwszym okresie walki gazowej. Mają one jednak bardzo ważne znaczenie jako jeden ze składników gazów, powstających podczas spalania środków wybuchowych. Zawartość ich całkowicie zależy od warunków spalania i wzrasta wraz z obniżeniem szybkości spalania. W odpowiednich warunkach, podczas spalania piroksyliny może powstać aż do 9% NO2; podczas spalania przetworów nitrogliceryny (dynamitów) do 4,2%, podczas spalania preparatów kwasu pikrynowego (lydditu, melinitu, szimozy) do 40% i trotylu do 30%. Skutki działania na narządy oddechowe są podobne do działania chloru; należy jednak zauważyć, że niebezpieczne następstwa występują nie natychmiast, a dopiero po upływie dość długiego okresu wylęgania.
Bardzo ważnemi, ale jeszcze prawie niezbadanemi z punktu widzenia toksykologicznego są właściwości dymów bojowych. Dymami nazwano suspensje bardzo małych (o średnicy 10-3 — 10-9 cm) cząsteczek stałych ciał (pyłu) w powietrzu; podobne suspensje płynów tworzą mgły. Powstają one skutkiem albo rozpylania mechanicznego, np. podczas wybuchów, albo termicznego, powstałego przez działanie ciepła (jak sublimacja i parowanie) przy następującem ochłodzeniu, albo nareszcie chemicznego, gdy twarde albo płynne cząsteczki tworzą się przez połączenie chemiczne dwóch albo więcej związków, znajdujących się w stanie par w powietrzu.
Pod względem działania na ustrój takie dymy mogą odgrywać rolę wyłącznie mechaniczną, wywołując tak zw. pylice płuc. Do tego mechanicznego działania może dołączyć się pewne chemiczne działanie, zależne od właściwości rozpylonej substancji.
Zależnie od tego dzielimy odpowiednie środki bojowe na dymy obojętne, których cechą jest zupełny brak działania chemicznego, dymy albo raczej mgły żrące, zawierające drobne kropelki kwasów nieorganicznych i dymy trujące, których składnikami są pewne trucizny oddechowe lub inne trucizny o wyraźnem działaniu ogólnem jak fosgen i kwas arsenawy.
Obojętnemi są dymy, w których składnikiem rozpylonym jest węgiel i takie związki, jak chlorek amonu lub tlenek cynku. Używano ich do maskowania zarówno na morzu jak i na lądzie. Zwykle stosowano w tym celu albo niezupełne spalanie węgla w paleniskach okrętów, albo spalanie szczególnych mieszanin w postaci świec lub w specjalnych przyrządach dymotwórczych. Skład jednej z najbardziej udanych mieszanin, używanych w tym celu, mianowicie obojętnej mieszaniny Bergera, jest taki: pyłu cynkowego 25, tlenku cynku 20, czterochlorku węgla 50, ziemi okrzemkowej 5; albo lepiej: pyłu cynkowego 34,6, czterochlorku węgla 40,8, chlorku amonu 7, węglanu magnezu 8,3, chloranu sodu 9,3.
Podczas spalania obojętnych mieszanin powstaje szary, albo czarny dym, zawierający cząsteczki węgla, chlorku amonu i tlenku cynkowego. Żadna z tych substancyj nie jest trująca, a drażniące właściwości ich są też bardzo słabe. Skutkiem działania takiego dymu może być tylko, tak zw. antrakoza czyli pylica węglowa płuc, chorobliwe wzmożenie stanu, w którym znajdują się płuca wszystkich ludzi.
Obojętność dymów, powstałych wskutek spalania mieszanin, zawierających KClO3 i proszki metalowe, podlega jednak pewnej wątpliwości. U Koberta znajdujemy wskazówkę, że podczas spalania takich mieszanin powstają bardzo jadowite i drażniące tlenki chloru ClO2 i Cl2O4, wywołujące nietylko podrażnienie dróg oddechowych, lecz także objawy zatrucia ogólnego i przykre następstwa w postaci zaćmy (katarakty). W dymie z mieszaniny Bergera znajduje się też i fosgen.
Większej ilości dymów bojowych używano jako jednego ze środków zaczepnych. Dymy powstają przez wybuch pocisków dymowych w terenie, zajętym przez nieprzyjaciela i dlatego mogą zawierać najniebezpieczniejsze trucizny. Są to środki żrące albo trujące.
Najważniejszemi ze środków drażniąco-duszących są środki z grupy chloropikryny. Do tej grupy należą po pierwsze pewne aldehydy, mianowicie bardzo drażniący aldehyd krotonowy i używana przez Francuzów akroleina (papite) CH3CH:CH.COH i CH2:CH.COH. Podobnie, jak wszystkie aldehydy substancje te łatwo polimeryzują się (akroleina daje nierozpuszczalny biały osad disakrylu) i utleniają się i dlatego są mało wygodne do celów bojowych. Żeby zapobiec temu rozkładowi używano pewnych domieszek, mianowicie azotynu amylowego i hydrochinonu. Do nich należy również znana każdemu formalina — aldehyd mrówkowy HCOH mająca, jak wiadomo, wyraźne właściwości drażniące. Działając na ustrój wywołują one wybitne podrażnienie górnych dróg oddechowych, odruchowe zatrzymanie oddechu, łzawienie, kaszel i wymioty. Działanie na oskrzela i płuca jest niemniej wyraźne niż w zatruciu chlorem. W szerszym zakresie używano tylko akroleiny pod nazwą „papite” dla napełniania pocisków.
Szczegóły jej działania na ustrój są jeszcze mało ustalone.
O wiele ważniejszym środkiem jest sama właśnie chloropikryna (aquinite u Francuzów). W przeciwieństwie do bardzo niestałych aldehydów jest ona jednym z najtrwalszych środków bojowych. Dzięki swej trwałości wywołuje ona nietylko dość znaczne zmiany miejscowe, lecz posiada też wyraźne działanie ogólne w pewnej mierze podobne do działania chloroformu (CHCl3); do którego jest ona zresztą bardzo zbliżona ze swej natury chemicznej, będąc nitropochodną chloroformu CCl3NO2.
Chloropikryna była wprowadzona jako trujący gaz przez Włochów w końcu r. 1916. Następnie była ona używana w dużych ilościach jako jeden z najskuteczniejszych środków bojowych zarówno przez Niemców jak i przez sprzymierzonych (aquinite Francuzów, vomiting gaz Anglików, Grünkreuz (mieszanina z superpalitem) Niemców). Chloropikryna była zastosowana również przez wszystkich biorących udział w wojnie w mieszaninach do fal gazowych (mieszanina z chlorem, z siarkowodorem, fosgenem (u Anglików) i (z SnCl4) do pocisków. Zwykle otrzymywano ją przez działanie na kwas pikrynowy (trójnitrofenol) wapna blicharskiego C6H2OH (NO2)3 + 11 Cl2 + 5H2O = 3CClNO2 + 3CO2 + 13HCl (sposób Stenhouse). Powstaje ona też przy działaniu na aceton mieszanin kwasów solnego i azotowego CO(CH3)2 + N2O5 + 3Cl = 2CCl3NO2 + CO2.
Chloropikryna stanowi prawie bezbarwną ruchliwą ciecz, cięższą od wody (c. g. 1,69) wrzącą przy 113°C, lecz mimo to dość lotną. Ciśnienie pary w temperaturze 25°C = 23,87 mm. Z punktu widzenia chemicznego jest ona związkiem bardzo biernym. W wodzie prawie się nie rozpuszcza; według danych francuskich autorów 100 cm3 nasyconego wodnego rozczynu zawiera 0,163 (Bernard) albo 0,125 (Nicoladot) chloropikryny. Niemieccy autorzy uważają ją za praktycznie nierozpuszczalną. Chloropikryna hidrolizie zupełnie nie podlega, lecz powoli rozkłada się z powstaniem substancyj utleniających (odczyn ze skrobią i KJ); rozpuszcza się ona łatwo we wszystkich rozczynnikach organicznych. Stosunek do lipoidów nie jest jeszcze dokładnie ustalony. Według danych autorów francuskich tłuszcze absorbują ją w bardzo nieznacznym stopniu. Ani kwasy ani zasady na nią nie działają. Chloropikryna pali się bardzo trudno. Ze specjalnych odczynów zwrócić trzeba uwagę na powstanie pod działaniem siarczynów krystalicznych związków z całkowitem odszczepieniem chloru, ale z zatrzymaniem grupy NO2.
CCl3NO2 + 3Na2SO3 + H2O = 3NaCl + 3NaHSO4 + CH(NO2)(NaSO3)2.
Odczyn ten służy do ilościowego określania zawartości chloropikryny w powietrzu.
Z innych jej odczynów są ciekawe: 1) powstanie metylaminy przy działaniu kwasu octowego i żelaza metalicznego, 2) powstanie chlorku cyanu przy działaniu chlorku cyny i 3) powstanie guanidyny CNH (NH2)2 przy gotowaniu z alkoholowem rozczynem amoniaku.
Chloropikryna podobnie jak inne pochodne organiczne zawierające chlor, powoduje zielone zabarwienie płomienia gazu świetlnego przy obecności jej pary w gazie zapalonym nad siatką miedzianą.
Hemoglobina w obecności chloropikryny przetwarza się w ciągu kilkudziesięciu minut w methemoglobinę, z której następnie może powstać kwaśna hematyna. Zależy to oczywiście od działania grupy NO2, która przedtem ulega redukcji do NO.
Co do działania na ustrój, to, ze względu na swą stałość, chloropikryna po pierwsze działa nietylko drogą wdychania, lecz również w razie wprowadzenia jej w jakikolwiek inny sposób do organizmu po drugie, wywołuje nietylko miejscowe uszkodzenia ale cały szereg objawów ogólnych.
Należy zwrócić uwagę na to, że ciężkie zmiany w płucach powstają także w razie innych sposobów wprowadzenia (np. dożylnego), prawdopodobnie wskutek wydzielania trucizny z wydychanem powietrzem przez płuca i że zatrucie jest możliwe również przez nieuszkodzoną skórę nawet bez wywoływania jakichkolwiek zmian skórnych.
W obecności pary chloropikryny w powietrzu, zależnie od stężenia, obserwujemy zjawiska następujące:
chloropikryna ma charakterystyczny zapach, który można zauważyć już przy zawartości kilkutysięcznych mg na M3. Zapach ten przypomina zapach ananasów. W znaczniejszych stężeniach chloropikryna działa na rozgałęzienia nerwu trójdzielnego jako środek drażniący. Najczulszą jest spojówka oczu; w stężeniu 0,019 mg na 1 M3 (2/100.000.000), następuje wyraźne łzawienie, podrażnienie śluzówki nosa (zapach ostry), kichanie i kaszel. Dalej dołącza się skurczowe zamykanie powiek, podrażnienie oczu staje się bolesne, nie do wytrzymania i następują odruchowe wymioty, jako skutek podrażnienia gardzieli.
W jeszcze znaczniejszych stężeniach lub po dłuższym czasie działania dołączają się do tych objawów zmiany anatomiczne, zapalenie spojówki, zapalenie krtani i mniej więcej wyraźne zapalenie oskrzeli, nie tak znaczne jak w działaniu mocnego stężenia trucizn grupy chloru, jednak powodujące martwicę górnych warstw nabłonka, t. j. zanik nabłonka migawkowego, obrzęk śluzówki i zatkanie drobnych oskrzeli. Stąd powstaje, nawet po dożylnem dostarczeniu trucizny, właściwa dla działania środków duszących rozedma i niedodma płuc.
Pomimo wyraźnego działania na narządy odruchowe chloropikryna dość łatwo przenika do pęcherzyków płucnych, gdzie wywołuje zmiany podobne do tych, które powstają pod wpływem fosgenu, a więc znaczny stopień obrzęku z wysiękiem zawierającym niezwykle wielkie ilości białka, zgęstnienie krwi wskutek poliglobulji i wad krwioobiegu. Takie zatrucia niezależnie od zwykłych powikłań w postaci np. zakaźnego zapalenia płuc, mogą same przez się wywołać w pewnych przypadkach śmierć w ciągu pierwszych 3 dni po zatruciu.
W takich przypadkach rozwijają się wyraźne ogniska zwyrodnienia w wątrobie i nerkach i zmiany mięśnia sercowego. Serce po śmierci zawsze znajduje się w stanie rozkurczu i we wszystkich narządach występuje wyraźne przekrwienie żylne. Użycie bardzo znacznych stężeń, wyżej 2,9/M3 = (2.10-6), daje objawy ostrych śmiertelnych zatruć; zgon następuje po upływie 3 — 30 godzin. Stężenie od 7,5 — 20,0 na M3 zabija zwierzęta w kilka minut.
Przyczyną nagłych zatruć, kończących się śmiercią są objawy, których nie spotykamy po użyciu niższych stężeń — mianowicie od 2 — 7,5/M3. Jednym z nich jest skurcz mięśni naczyń i serca. Przy sztucznej hematyzacji (przepuszczaniu krwi przez naczynia izolowanego narządu, w danym wypadku płuc) ilość krwi wyciekającej z żyły zmniejsza się nagle do zera, skoro tylko nasycimy krew chloropikryną. W zatruciu zwierząt parą śmierć może nastąpić w ciągu jednej minuty. Na sekcji znajdujemy serce w stanie najwyższego skurczu, komory blade i zupełnie puste, wówczas, gdy przedsionki i płuca są napełnione krwią. Śmierć następuje więc skutkiem paraliżu serca w chwili skurczu. Drugiem zjawiskiem jest ciemne zabarwienie płuc podobnie jak w zatruciu chlorem. Zabarwienie to obejmuje całe płuca lub występuje tylko w postaci mniejszych albo większych plam. Zabarwienie to zależy nie od powstania kwaśnej hematyny, jak w zatruciu chlorem, lecz od tworzenia się methemoglobiny. Obrzęk w wypadkach śmiertelnych w ciągu kilku godzin powoduje powiększenie wagi płuc 5 — 6 krotne w porównaniu z normą; w przypadkach śmierci nagłej obrzęk taki nie następuje.
W zatruciach dawkami nie wywołującemi wyników śmiertelnych, chloropikryna występuje z jednej strony jako substancja nieco drażniąca ośrodki nerwowe a przedewszystkiem korę mózgu, z drugiej strony jako trucizna działająca na przemianę materji. Wywołuje ona mianowicie wyraźne obniżenie tej przemiany.
Co do teorji działania to chloropikryna jest trucizną o wyraźnem działaniu cząsteczkowem i prawdopodobnie większa ilość jej wydziela się z organizmu w niezmienionem stanie, dzięki jej wyjątkowej bierności. Miejscem wydzielania są płuca.
Jadowitość waha się w znacznym stopniu, zależnie od sposobu wprowadzenia. Dla kotów i królików mamy dawki następujące:
| 1) dożylnie: | najmniejsza dawka | 0,01 na kg |
| 2) podskórnie | „ „ | 0,15 „ „ |
| 3) naskórnie | „ „ | 15,0 „ „ |
| 4) drogą pokarmową | nawet „ | 1,5 nie powoduje zatrucia. |
Przy wprowadzeniu przez płuca mamy dość powikłane stosunki, ponieważ ilość wchłanianej trucizny nie da się określić ściśle. Zwrócić uwagę należy po pierwsze na stężenie trucizny w powietrzu, po drugie, na czas działania, ponieważ chloropikryna, dzięki swej trwałości, ma wyraźne zdolności do kumulacji. Z połączenia tych dwóch zjawisk mamy znany wyraz ct.
Stężenie wyższe od 7,5/M3 zabija natychmiast, stężenie wyższe od 2/M3 także zabija ale po pewnym czasie. Stężenia mniejsze od 0,5/M3 są zabójcze tylko w razie dłuższego czasu działania. Co do stężeń umiarkowanie mocnych, dla których właściwie użyteczny jest taki sposób określenia jadowitości, mamy jako zabójcze (w ciągu kilku — 1 — 12 dni) ct leżące pomiędzy 2100 — 125000 mg min.M3.
Działanie chloropikryny na ludzi, według danych laboratorjum w Edgewood, powoduje łzawienie natychmiast już w stężeniu 25.10-9, w 2.10-9 dopiero po pewnym czasie działania. Trujące właściwości leżą poniżej 2/10-6. Stężenie 2,5/M3 jest bezwzględnie śmiertelne. Stąd wynika, że chloropikryna narówni z fosgenem jest najniebezpieczniejszym ze wszystkich chemicznych środków bojowych.
Grupa tlenków azotowych ma mniejsze znaczenie.
Azot tworzy z tlenem cały szereg związków: N2O (gaz rozweselający); NO, NO2; N2O3; N2O4; N2O5. Z tych związków mniej więcej trwałe są tylko N2O, NO NO2(N2O4), szczególnie ostatni. Gaz rozweselający wyraźnych trujących właściwości nie posiada.
NO w obecności tlenu natychmiast utlenia się do NO2. N2O4 częściowo rozczepia się według wzoru 2NO2 = N2O4, a N2O3 rozkłada się na NO2 i NO. N2O5 rozkłada się w następujący sposób: 2N2O5 = 4NO2 + O2. W ten sposób więc powstaje dwutlenek azotu i tlen. Dwutlenek azotu NO2 stanowi czerwono-bronzowy gaz cięższy od powietrza (c. g. 1,626) o bardzo nieprzyjemnym, żrącym zapachu. Wdychanie tego gazu w nieznacznych stężeniach nie wywołuje jednak odruchów i dlatego zaliczyć go do środków niewdychalnych byłoby trudniej niż fosgen. Mimo to jest on dość niebezpieczną trucizną. Charakterystyczną cechą jego działania jest rozwój objawów zatrucia po pewnym okresie wylęgania (zwykle kilkugodzinnym). Zwykłem źródłem zatrucia są gazy powstałe przy wybuchach środków nitrowanych. Trzeba zwrócić uwagę, że większość tych środków sama przez się jest w znacznym stopniu jadowita jak np. nitrogliceryna, trotyl, kwas pikrynowy i że jeszcze jadowitszemi od związków, zawierających grupę NO2, są pochodne kwasu azotawego z grupą O−N=O, jak np. najbardziej typowy azotyn amilowy (amilnitrit). Wszystkie te związki wywołują porażenie naczyń krwionośnych, spadek ciśnienia krwi i śmierć wskutek porażenia serca. Wywołują one również wyraźną methemoglobinemję. Zatrucia tlenkami azotu przebiegają zazwyczaj w sposób następujący: stężenia mocne, bliżej zresztą nieokreślone, mogą natychmiast spowodować duszność, niepokój, kaszel, zawrót głowy, sinicę i zapalenie oskrzeli z wydzielaniem obfitej ilości plwociny zabarwionej na żółto. Do tego dołączają się wymioty, biegunka i upadek sił. W znacznej części przypadków już w ciągu pierwszej doby następuje śmierć.
Zwykle jednak mamy do czynienia ze słabszemi stężeniami, którym zupełnie brak właściwości drażniących. Ludzie w zatrutej atmosferze mogą się znajdować w ciągu kilku godzin. Lecz po upływie 6 — 8 godzin od początku działania, gdy człowiek już oddawna opuścił miejsce zatrute, zupełnie nieoczekiwanie następuje nagły napad duszności, podobny do dychawicy, połączony ze skurczem głośni, męczącem pragnieniem i uczuciem zbliżającej się śmierci. Twarz staje się blada, występuje zimny pot, oczy wychodzą z orbit, mowa staje się przerywana. Od czasu do czasu następują długotrwałe ataki uporczywego kaszlu, do którego zwykle dołączają się wymioty. Wreszcie twarz staje się siną. Przytomność jest zupełna i zanika dopiero w ciągu dalszego rozwoju zatrucia, wzrastającej sinicy i osłabienia oddechu. Krew żylna jest ciemna i lepka. Śmierć następuje w ciągu pierwszych 40 godzin. W nielicznych przypadkach wyzdrowienia mamy właściwe dla methemoglobinemji zmiany moczu i łącznie z niemi zapalenie nerek i żółtaczkę.
Prawdopodobne jest jednak, że do wywołania takich objawów potrzebne są długotrwałe działania dość mocnych stężeń, ponieważ podczas ostatniej wojny pomimo ogromnego użycia trotylu i kwasu pikrynowego masowe zatrucia tlenkami azotu nie były notowane. Możliwe jest, że takie wypadki zatrucia nie były dostatecznie odróżniane od jednocześnie powstających zatruć czadem. W każdym razie pomimo powszechnie przyjętej ujemnej oceny tlenków azotu, jako środków bojowych, zasługują one na dokładniejsze zbadanie toksykologiczne.
Jadowite dymy bojowe, z których składa się ostatnia grupa środków duszących są, jak już zaznaczono, jeszcze bardzo mało zbadane z punktu widzenia toksykologicznego. Pewna część tych dymów należy do trucizn odruchowych — przeważnie sternitów. Inne są źródłem drażniących kwasów, przedewszystkiem solnego, ponieważ zwykłe substancje używane w tym celu są chlorobezwodnikami kwasowemi, rozkładającemi się pod wpływem wody na kwas solny i odpowiedni kwas lub wodorotlenek metaloidowy. W pewnych przypadkach wodorotlenek też jest mocnym kwasem, albo w każdym razie ma wyraźne właściwości żrące. Brak dotychczas zupełnie wskazówek co do działania drobnego pyłu powstającego podczas takiego rozkładu i co do powstania niebezpiecznych pylic płuc. Zagadnienie jest jednak bardzo poważne, ponieważ dymotwórcze substancje mogą być i bywają używane nietylko jako domieszka do prawdziwych trucizn (przy napełnianiu pocisków artyleryjskich) w celu utworzenia dymów w miejscu zajętym przez wroga, lecz i w niemniejszym stopniu do celów maskowania czyli ukrywania w terenie własnego wojska. Dlatego wynalezienie istotnie nieszkodliwych dymów obok dymów trujących jest bardzo pożądane.
Dotychczas do tworzenia dymów bojowych były używane następujące środki.
1) Chlorek cyny SnCl4, rozkładający się stopniowo w wilgotnem powietrzu na kwas solny i wodorotlenek cynowy Sn(OH). Z początku w obecności wody powstają liczne wodziany przejściowe, temperatura podnosi się w znacznym stopniu aż do powstania pary chlorku cyny. Tworzy on gęsty biały dym i był używany w czasie wojny w znacznych ilościach, jako domieszka do chloru, a przede wszystkiem do fosgenu w pociskach („opacite“ Francuzów). Sam przez się chlorek cyny jest ciężkim bezbarwnym płynem, wrzącym w temperaturze 114°C. Ma on wyraźne żrące właściwości, dlatego też był używany jako causticum w starożytnej medycynie. Tlenek cyny SnO2 ma też żrące właściwości. Dlatego wdychanie dymu cynowego prawdopodobnie nie jest obojętne.
2) Chlorek tytanowy TiCl4 też jest bezbarwnym płynem, wrzącym temperaturze 136,4°C i rozkładającym się pod wpływem wody z powstaniem chlorowodorotlenków TiCl,3OH, TiCl2(OH)2, TiCl(OH)3 i wreszcie wodorotlenku Ti(OH)4.
Według istniejących nieścisłych wskazówek ma on posiadać właściwości środka słabo-duszącego. Żadnych danych toksykologicznych o nim nie posiadamy.
3) Chlorek krzemowy SiCl4 — bezbarwny płyn, wrzący w temperaturze 59°C, tworzy pod wpływem powietrza gęsty biały dym z mieszaniny tlenku i wodorotlenku krzemu. Zwykle do chlorku krzemowego dodawano amoniaku celem równoczesnego wytworzenia salmiaku powiększającego nieprzejrzystość dymu. Taka mieszanina wytwarza jedną z najlepszych obojętnych zasłon dymowych. Z zakresu działania tlenków krzemu na ustrój zbadano mniej więcej tylko działanie rozpuszczalnych soli kwasu krzemowego. Wyniki są nieuchwytne. W każdym razie nie posiada on wyraźnych właściwości trujących.
4) Chlorek arsenu AsCl3 — również bezbarwny płyn, wrzący w temperaturze 130°C. Na powietrzu rozkłada się, tworząc pył kwasu arsenawego As2O3, znanej, bardzo czynnej trucizny i kwas solny.
Sam przez się chlorek arsenu ma wyraźne właściwości żrące. Para jego wywołuje podrażnienie spojówki, przekrwienie i obrzęk płuc. Jednak nawet w zatruciu dość znacznemi stężeniami (0,2/M3) śmierć następuje dopiero po upływie kilku dni. Chlorek arsenu był używany w wojsku rosyjskiem celem zapobiegania rozkładowi kwasu pruskiego w pociskach, a we Francji jako domieszka też i do innych środków trujących. Jako dym przesłaniający jest gorszy od omówionych wyżej.
5) Chlorek antymonawy SbCl3 krystaliczna, bezbarwna, oleista masa, która była używana w medycynie za dawnych czasów jako środek żrący. Pod działaniem wody powstaje kwas solny i chlorotlenek antymonu, środek także drażniący. Pod względem jadowitości antymon jest niewiele mniej jadowity od arsenu, ale resorbuje się nieco gorzej. Jako dym bojowy był mało używany.
6) Chlorek fosforu — PCl3. Bezbarwny płyn wrzący w temperaturze 76°C i rozkładający się pod wpływem wody na kwasy solny i fosforawy P/HO/3.
7) Chlorek sulfurylu SO2Cl2 — bezbarwny płyn o charakterystycznym żrącym zapachu, wrzący w temperaturze 69°C. W obecności niewielkich ilości wody rozkłada się na kwas solny i kwas chlorosulfonowy (wybitny środek duszący), w obecności większych ilości wody powstaje kwas siarczany.
SO2Cl2 + H2O = SO3ClH + HCI; SO2Cl2 + 2H2O = 2HCl + H2SO4.
8) Bezwodnik kwasu siarczanego SO3 albo rozczyn jego w kwasie siarczanym t. zw. oleum SO3 jest to płyn bezbarwny, ciężki, wrzący w temperaturze 46°. W temperaturze 15° tworzy on masę twardą z sześciotlenku siarki S2O6. W obecności wody dymi, wytwarzając drobne kropelki kwasu siarczanego. Jest jednym z najlepszych dymów bojowych.
9) Biały fosfor — ciało stałe, łatwo zapalające się na powietrzu nawet samo przez się i wytwarzające gęsty dym z P2O5, który z wodą daje kwas fosforowy P2O5 + 2H2O = 2H3PO4
Fosfor jest najlepszym ze środków dymowych i był używany w czasie wojny w olbrzymich ilościach. Środki 6 — 9 nie wytwarzają w szeregu produktów swego rozkładu ani mocnych trucizn ani drażniących pyłów. Wszystkie one jednak mają tę wspólną cechę, że powstają z nich mocne kwasy mineralne mające zawsze wyraźne właściwości drażniące i żrące. Należy jednak pamiętać, że najczynniejszy z tych kwasów, kwas solny, jest 800 razy mniej trujący niż fosgen i że dla powstania prawdziwej acidozy (ogólnego zatrucia kwasem) trzeba wprowadzić nie mniej od 0,9 HCl na kg żywej wagi psa albo kota (króliki są znacznie czulsze). Człowiek ma prawdopodobnie nie mniejszą odporność niż pies. Takich ilości kwasu solnego powietrze nie zawiera nawet w razie największego stężenia dymów bojowych. Dla człowieka zawartość HCl 00,16/M3 jest już bardzo nieprzyjemna i trudno jest takiem powietrzem oddychać; zawartość 0,50/M3 może już wywołać niebezpieczne powikłanie w narządach oddechowych, a 1,6/M3 jest prawie nie do wytrzymania nawet na krótką chwilę (kilka minut). Mamy w takich wypadkach wyraźne skutki podrażnienia górnych dróg oddechowych.
16) Chlorek chromylu CrO2Cl2 — ciecz czerwonego koloru, wrząca w temperaturze 117°C. Pod działaniem wody rozkłada się na kwas solny i bezwodnik kwasu chromowego. Ten ostatni stanowi mocny środek żrący, a wprowadzony do krwioobiegu wywołuje nawet w niewielkich dawkach śmiertelne zapalenie nerek. Jako dym bojowy jest on mało użyteczny.
Środkami odruchowemi nazywamy wszystkie trucizny, które posiadają właściwości drażniące w takim stopniu, że, działając już w nieprawdopodobnie małych dawkach, wywołują odpowiednie odruchy ochronne. Swoistą ich cechą jest właśnie takie oligodynamiczne działanie. W wyższych stężeniach są one przeważnie środkami duszącemi, wywołującemi zapalenie górnych dróg oddechowych, zapalenie spojówki i nawet śmiertelne zapalenie płuc wraz z ostrym obrzękiem, co przypomina poniekąd właściwości chloropikryny, która dlatego też może być zaliczona zarówno do jednej jak i do drugiej grupy.
Zdolność poszczególnych duszących środków bojowych do wywoływania podrażnienia dróg oddechowych jest bardzo niejednakowa. Tak np. siarczek węgla i siarkowodór są pod tym względem prawie że obojętne. Kwas solny, jodowodór, bromowodór, dwutlenek azotu, tiofosgen, kwas pruski, i co jest bardzo zajmujące, również i mocny lakrymator — bromek benzylu są tylko słabemi środkami drażniącemi dla górnych dróg oddechowych, wywołując zjawiska odruchowe tylko w stężeniach większych od 2/M3. Znaczne, lecz krótkotrwałe, podrażnienia wywołują: chlor, brom, jod, chlorek siarki. Bardzo mocnemi środkami, drażniącemi, wywołującemi najokropniejsze skutki nawet w słabych (mniejszych od 2/M3) stężeniach są fosgen (COCl2), palit (ClCOOCH2Cl), superpalit (ClCOOCl3), chloro i bromo aceton, akroleina i chloropikryna.
Środki odruchowe musimy zaliczyć do najstarszych z trucizn bojowych. Jeszcze w roku 1914, w samym początku wojny, Niemcy wypróbowali w tym celu proszek chlorku dianisidyny (H2N (CH3O) C6H3−C6H3(CH3O)NH2 + 2HCl, który według danych laboratoryjnych musiał posiadać właściwości mocnego sternitu, środka wywołującego kichanie i podrażnienie górnych dróg oddechowych. Ten środek okazał się jednak mało użyteczny w warunkach wojennych. Wkrótce zastąpiono go znacznie mocniejszemi organicznemi związkami arsenowemi.
O stopniu względnej czynności tych środków można sądzić albo z porównania ich z jednym przyjętym za miarę jako jednostka, albo wprost określając próg podrażnienia t. j. najmniejsze stężenie, które jest jeszcze w stanie wywołać, niezależnie od czasu wylęgania, odpowiedni odruch. Stężenie, które wywołuje odruch ten natychmiast t. j., gdy „okres wylęgania“ jest równy 0, nazywa się granicą wytrzymałości.
Zasadniczą cechą środków odruchowych, w stężeniu poniżej tej granicy wytrzymałości, jest powstanie pewnego odruchu nie natychmiast po podrażnieniu powierzchni alarmowej, a zawsze po upływie pewnego czasu nazwanego okresem wylęgania. Długość tego okresu waha się w granicach od nieskończoności, jak to mamy w stężeniach poniżej progu wyczuwalności danego środka aż do zera t. j. do natychmiastowego odruchu, który świadczy o przekroczeniu górnej granicy wrażliwości. Powyżej tej granicy mamy już zazwyczaj wyraźne uszkodzenia anatomiczne i badana substancja działa już nie jako środek odruchowy, a jako trucizna żrąca albo dusząca.
Jeżeli będziemy odkładali na osi rzędnych wzrastające stężenia, a na osi odciętych odpowiedni czas wylęgania, to otrzymamy krzywą, która rozpoczyna się w nieskończoności jako linja równoległa do osi rzędnych, potem będzie się odchylać od niej, z początku nieznacznie, a w miarę wzrostu stężeń coraz prędzej, dążąc do równoległości z osią odciętych jako jej asymptota. Matematycznie taka krzywa odpowiada wzorowi.
Dawka (lub stężenie) jest odwrotnie proporcjonalna do logarytmu czasu wylegania.
Jest to inna forma znanego prawa Weber-Fechnera, według którego siła odruchu jest proporcjonalna do logarytmu podrażnienia.
Istnienie okresu wylęgania zależy od działania kumulacyjnego środków drażniących. Z ich stałości chemicznej, małej rozpuszczalności i stąd bardzo małych stężeń wypływa możność stopniowego nagromadzania trucizny aż do osiągnięcia progu wyczuwalności. Można to znowu przedstawić zapomocą pewnej formuły algebraicznej. Przypuśćmy, że a będzie minimalną dawką zdolną wywołać odruch, t czas wylęgania w sekundach, c stężenie trucizny w powietrzu, q prędkość absorbowania trucizny z powietrza przez daną powierzchnię alarmową, t. j. ilość, która jest pochłaniana w stężeniu 1 w ciągu 1″ i r ilość trucizny, która może być własnemi środkami organizmu zniszczona albo usunięta z danej śluzówki też w ciągu 1″. Ilość a będzie wtedy równa (cq − r)t, skąd . Jeżeli w tym wzorze r dosięgnie cq to t staje się równym to jest nieskończoności, jeżeli naodwrót cq będzie bardzo wielkie w porównaniu z r, to t będzie zmniejszać się, dążąc do zera. Ostatni stosunek, o ile q jest liczbą mniej więcej stałą, może powstać dla każdej trucizny przy powiększeniu c, co zupełnie odpowiada danym doświadczenia.
Dla porównania damy trzy szeregi danych działania lakrymatorów, czyli środków łzawiących; w jednym środki te są ułożone według progu wrażliwości, w drugim oznaczono granicę napastliwości zgodnie z danemi Mayera (M) i Fries i Westa (F. W), a w trzecim według stosunkowej ich czynności w porównaniu z bromkiem benzylu.
Wzór chem.
|
Próg wrażliw. X/M3 |
Gran. napast.
X/M3 |
Stopień stos. czyn.
| |
| Chloropikryna) | C Cl3NO2 | M. 0,00074 | 0,037 | 0,3 |
| F.W. 0,019 | — |
0,21 | ||
| Chloroaceton | CH2Cl.CO.CH3 | M. 0,02 | 0,04 | 0,125 |
| F.W. 0,018 | — |
0,2 | ||
| Bromaceton | CH2 Br CO CH3 | M. 0,0061 | 0,002 | 0,4 |
| F.W. 0,011 | — |
0,36 | ||
| (Akroleina) | CH2: CH. COH | M. 0,012 | 0,025 | 0,2 |
| Jodooctan etylu | CH2I.CO.O.C2H5 | M. 0,0095 | — |
0,26 |
| F.W. 0,0014 | — |
2,8 | ||
| Chlorek benzoilu | C6H5 COCl | M. 0,0142 | 0,044 | 0,17 |
| Bromek benzylu | C6H5 CH2 Br. | M. 0,0025 | 0,005 | 1 |
| F.W. 0,004 | — |
1 | ||
| Bromek ksylilu | C6H4CH2Br.CH3 | |||
| F.W. 0,0018 | — |
2,2 | ||
| Martonit | CH3CHCH2Br + CH3COCH2Cl | |||
| F.W. 0,0012 | — |
|||
| Cedenit | C6H4 NO2CH2Cl | M. 0,0018 | 0,0036 | 1,4 |
| Kamit | C6H5 CHBr CN | M. 0,00035 | 0,0007 | 7 |
| F.W. 0,0003 | — |
13 | ||
| Chloroacetofenon | C6H5CO CH2 Cl | M. 0,00062 | 0,00124 | 4 |
Wśród związków tych chloropikryna i akroleina, jako dość słabe lakrymatory, są mocnemi truciznami oddechowemi, które rozpatrzyliśmy w odpowiedniem miejscu. Stosownie do tego prawie wszystkie środki o właściwościach trucizn oddechowych wywołują też podrażnienie spojówki, lecz tylko w takich stężeniach, które już powodują powstawanie wyraźnych zmian w narządach oddechowych.
Wrażliwość górnych dróg oddechowych dla niektórych środków nie ustępuje wrażliwości spojówki. Są to jednak zupełnie inne środki i wogóle najmocniejsze lakrymatory są dość słabemi środkami odruchowemi dla górnych dróg oddechowych. Odruchem, jak już omówiono, jest przedewszystkiem skurczowe zatrzymanie oddechu. Według nowszych doświadczeń mamy taki szereg wrażliwości dla królików. Pierwsza liczba przedstawia stężenie trucizny w powietrzu wystarczające do wywoływania pierwszych oznak odruchu, druga stopień napastliwości środka w porównaniu z najmocniejszym z nich bromacetonem.
| Bromaceton | 0,001/M3 | 1 |
| Akroleina | 0,001/M3 | 1 |
| Chloropikryna | 0,005/M3 | 1:5 |
| Chloromrówczan metylu | 0,005/M3 | 1:5 |
| Palit | 0,02/M3 | 1:20 |
| Fosgen | 0,1/M3 | 1:100 |
| Superpalit | 0,2/M3 | 1:200 |
| Chlor | 0,25/M3 | 1:250 |
| (Chloroform) | 20,00/M3 | 1:2000 |
Dla środków używanych do wywoływania odruchu kichania warunki działania są nieco inne. Są to nielotne płyny lub pyły, które znajdują się w powietrzu i jako takie nie podlegają rozcieńczeniu. Napastliwość ich jest bardzo znaczna. Są to przedewszystkiem związki arsenowe. Dla używanego w samym początku wojny dość słabego środka wywołującego kichanie — chlorku dianizidiny, ścisłych danych co do napastliwości nie posiadamy.
Napastliwość związków arsenowych jako sternitów jest następująca.
| Chlorek arsenu AsCl2 | 0,100/M3 |
| Tlenek kakodylu ((CH2)2As)2O | 0,030/M3 |
| Cyanek kakodylu (CH3)2AsCN | 0,010/M3 |
| Tlenek metylarsiny CH3AsO | 0,005/M3 |
| Sternit I Dwuchlorek etyloarsiny AsCl2C2H5 | 0,005/M3 |
| Tlenek etylarsiny C2H5AsO | 0,005/M3 |
| Dwuchlorek naftylarsiny AsCl2C10H7 | 0,005/M3 |
| Dwuchlorek paranitrophenylarsiny As Cl2. C6H4NO2 | 0,0025/M3 |
| Sternit II Chlorek difenylarsiny As Cl(C6H5)2 | 0,001/M3 |
| Sternit III Imido difenilo chloroarsina (Adamsyt) N H (C6H4)2 As Cl | 0,0001/M3 |
Wrażliwość dolnych dróg oddechowych i płuc, których podrażnienie wywołuje przyspieszenie oddechu, jest znacznie mniejsza niż górnych. Najmocniejszym środkiem tego rodzaju jest fosgen. Szereg napastliwości jest całkiem inny niż dla górnych dróg oddechowych, jak to wynika z następującego porównania innych substancyj z fosgenem.
Górne drogi oddechowe
|
Dolne drogi oddechowe
| |
| Fosgen | 1 | 1 (0,05/M3) |
| Chlor | 2,5 | 2,5 |
| Palit | 0,2 | 20 |
| Chloropikryna | 0,05 | 10 |
| Bromaceton | 0,01 | 20 |
W większych stężeniach środki odruchowe mają właściwości trucizn narządów oddechowych, trucizn działających na skórę i trucizn z działaniem resorpcyjnem.
Zmiany ustroju wywołane znacznemi stężeniami lakrymatorów niewiele różnią się od działania innych mocno drażniących środków, szczególnie gdy się bierze pod uwagę narządy oddechowe. Ogólne rezorptywne działania, również skutki wprowadzania w inny sposób, nie są jeszcze zbadane dokładnie. Z analogji z innemi już zbadanemi związkami można wnioskować, że chlorowane ketony i estry szeregu tłuszczowego muszą mieć właściwości narkotyczne. Chloraceton jest oprócz tego mocnym środkiem dezynfekcyjnym, czyli trucizną komórkową.
Związki aromatyczne są oprócz tego wogóle bardzo trwałe w organizmie; do nich należy cały szereg trucizn o wyraźnem działaniu ogólnem. Znaczna ich część posiada wybitne właściwości dezynfekcyjne. Ciekawe jest, że dla środków aromatycznych pomiędzy zdolnością wywoływania podrażnienia spojówki z jednej strony, a odruchów oddechowych z drugiej nie ma ścisłej łączności. Tak np.
typowe lakrymatory: bromek benzylu i ksylilu tylko w nieznacznym stopniu drażnią drogi oddechowe. O głębszych zmianach anatomicznych i o zabójczem działaniu tych środków brak jakichkolwiek ścisłych danych, a są znane tylko granice śmiertelności dla zwierząt. Najlepiej zbadane w tym kierunku są związki arsenowe, które, oprócz właściwości najmocniejszych sternitów, mają wyraźne właściwości trucizn żrących i wywołują szereg niebezpiecznych objawów charakteru ogólnego, mianowicie choroby nerek i uszkodzenia przewodu pokarmowego. Dlatego w czasie wojny używano ich też jako trucizn zabójczych. Drażniące ich działanie na drogi oddechowe jest bardzo znaczne, wskutek czego należą one w pewnym stopniu do gazów duszących. Wywołują one znaczne przekrwienia i wybroczyny we wszystkich częściach narządu oddechowego.
Niemcy używali do napełniania pocisków mieszaniny złożonej z superpalitu, fosgenu i dwufenylochloroarsiny (Grünkreuz 2) i innej mieszaniny nie zawierającej żadnych środków duszących, a złożonej z samych sternitów etylodwuchloroarsiny, metylodwubromoarsiny i eteru dwuchlorometylowego jako środka sprzyjającego parowaniu tych sternitów (Grünkreuz 3).
Zwykły podział tych środków według wywoływanych przez nie odruchów może być uważany za dość względny. Prawie wszystkie trucizny te są bowiem w stanie wywoływać, zależnie od dawki, z początku łzawienie, następnie kichanie, wreszcie kaszel i drogą rozpromienienia odruchu — wymioty.
Odruchy te powstają wskutek podrażnienia rozgałęzień nerwu trójdzielnego i częściowo błędnego, o ile dołączają się odruchy oddechowe.
Środki zaliczone do tej grupy są przeważnie płynami niełatwo parującemi, wskutek czego nie można osiągnąć mocniejszych stężeń ich w powietrzu; albo nawet są to ciała stałe, tworzące lekki lotny proszek albo wreszcie sublimujące się w stanie trwałego delikatnego dymu. Z chemicznego punktu widzenia znaczna część ich należy do rzędu substancyj biernych i nawet zawartość chlorowców w nich najczęściej nie powoduje łatwej hidrolizy i działania chemicznego. Wiele z nich trudno rozpuszcza się w wodzie; wszystkie prawie są rozpuszczalne w tłuszczach i rozczynnikach organicznych, skąd staje się zrozumiałą zasadnicza ich cecha — zdolność do działania kumulatywnego i wyraźny okres wylęgania po użyciu stężenia niższego od granicy wrażliwości. Istota działania na zakończenia czuciowych nerwów i na komórki jest jeszcze zupełnie niewyjaśniona, jak wogóle wszystkich zmian czynnościowych. Anatomiczne zmiany, powstałe pod wpływem mocniejszych stężeń na odpowiednie śluzówki — należą zwykle do zjawisk zapalenia. Według właściwości chemicznych środki odruchowe mogą być podzielone w następujący sposób.
I. Środki wywołujące (przeważnie) łzawienie.
1. Pochodne szeregu tłuszczowego, zawierające chlorowce w rodnikach alkylowych. Do nich należą przedewszystkiem pochodne acetonu (dwumetyloketonu) i etylometyloketonu. Drugą część stanowią estry kwasów tłuszczowych, zawierające chlorowce w alkylowym rodniku (kw. octowego).
2. Pochodne szeregu aromatycznego: a) ketony (fenony) np. chloroacetofenon; b) chlorowane wyższe węglowodory szeregu aromatycznego (toluol i ksylol) z chlorowcami, zastępującemi w łańcuszku pobocznym wodór; c) podobne pochodne, zawierające prócz chlorowców cyan (nitryly).
3. Połączenie cyanu z chlorowcami.
4. Olejki gorczyczne.
II. Środki wywołujące kichanie.
5. Roślinne i zwierzęce proszki, tworzące drażniący pył.
6. Organiczne pochodne arsenowe (tak zw. sternity).
III. Środki wywołujące wymioty.
7. Karbazoly.
8. Izonitryly.
Dwie pierwsze grupy są wybitnemi lakrymatorami, wśród których pochodne, zawierające rodniki aromatyczne, są zwykle mocniejsze od pochodnych tłuszczowych. Związki bromowane są zwykle (3 — 4 razy) czynniejsze od chlorowanych. Zamiana chlorowca na rodnik CN znacznie podnosi czynność związków zawierających prócz tego chlorowce.
Do pierwszej grupy należą: chlorowany, bromowany i jodowany dwumetylo i etylometyloketon zwykle z jednym atomem chlorowca, choć istnieją też i związki z większą zawartością chlorowców np. używany przez Niemców dwubromoaceton (CH2Br)2 CO. Mieszanina produktów bromowania i chlorowania ketonów była używana też przez Francuzów pod nazwą martonite do ręcznych granatów. Próg działania tego martonitu leży około 0,003/M3, stężenie to wywołuje mocne łzawienie. W mocniejszych zatruciach powstaje zapalenie spojówek, ból w gardzieli i kaszel. W ciągu kilku godzin trwa zupełna utrata wzroku wskutek światłowstrętu, a później długotrwałe osłabienie wzroku wskutek zapalenia rogówki. Razem z kaszlem mogą powstać wymioty. Następnie daje się zauważyć cały szereg objawów zatrucia ogólnego.
Inne środki tej grupy, mianowicie estry metylowy i etylowy kwasów bromo i chlorooctowego są dwa razy słabszemi truciznami. W znaczniejszych ilościach ich nie używano, tem bardziej, że należą do kategorji produktów bardzo kosztownych.
Działanie ich nie różni się od działania pochodnych acetonu. Są to substancje łatwo rozkładające się; płyn z początku bezbarwny i oleisty, w ciągu kilku tygodni staje się ciemno bronzowym i znacznie traci na sile działania.
Dlatego znacznie użyteczniejszemi lakrymatorami okazały się pochodne aromatyczne, z których bromek benzylu został przyjęty przez francuskich autorów za jednostkę typową do oceny innych środków. Takiemi związkami są: chlorek, bromek i jodek benzylu i bromek ksylilu; estrom tłuszczowym kwasu jodooctowego odpowiada jodooctoan benzylu. Czynnemi lakrymatorami są też pochodne z większą zawartością chlorowców jako np. dwubromek benzylu i dwubromek ksylilu. Są to albo ciężkie ciecze wrzące powyżej 100°C, albo nawet (jodek benzylu) ciała krystaliczne. Czynność ich jest dość znaczna (około 0,015/M3) i dzięki swojej trwałości i natychmiastowemu działaniu były one używane przez Niemców w znacznych rozmiarach do pocisków oznaczonych literą T.
Dość mocnemi i wygodnemi do celów bojowych okazały się chlorowane fenony, mianowicie chloroacetofenon C6H5CO.CH2Cl — krystaliczne ciało łatwo sublimujące się. W ten sposób wytwarza ono drażniący dym i w tej formie jest najczynniejszem ze znanych lakrymatorów. Chloroacetofenon zdaje się być środkiem zupełnie niejadowitym i dlatego bardzo użytecznym z punktu widzenia humanitarnego.
Po zastąpieniu drugiego atomu wodoru w rodniku metylowym bromku benzylu przez rodnik cyanowy CN otrzymuje się bromofenyloacetonitryl. Wzór takiego związku więc będzie C6H5CHBrCN. Związek ten otrzymał u Francuzów specjalną nazwę „camite” — kamit i jest najmocniejszym (7 razy mocniejszym od bromku benzylu) z używanych dotychczas lakrymatorów. Odpowiedni związek chlorowy CHCHClCN jest znacznie od niego słabszy (4 razy mocn. od bromku benzylu). Działanie kamitu nie różni się od działania innych lakrymatorów, ale dzięki swojej znacznej napastliwości działa on w takich minimalnych dawkach, że poważne podrażnienie oczu następuje wcześniej niż wyczuwa się zapach tego środka który zresztą nie posiada żadnych cech charakterystycznych. Dlatego prawdopodobnie powstała legenda o użyciu podczas ostatniej wojny jakichś oślepiających promieni ultrafjoletowych. Takie promienie o krótkiej fali rzeczywiście nie są pozbawione zdolności wywoływania podrażnienia rogówki i spojówki, jak to wynika np. z istnienia ślepoty polarnej, obserwowanej na lodowcach i w krainach podbiegunowych, lecz sztuczne źródła tych promieni są za słabe, żeby działać na większe odległości, a nieprzepuszczalna dla tych promieni soczewka zupełnie zabezpiecza czułą siatkówkę nawet od działania mocniejszych promieni światła słonecznego.
Mniejsze znaczenie wskutek swej kosztowności posiadają jodowane pochodne, z których jako trucizny bojowej używano jodooctanu etylu. Jest to bezbarwny oleisty płyn wrzący przy 180°, otrzymany przez działanie jodku sodu na chlorooctan etylu. Napastliwość jego jest bardzo znaczna, mianowicie 0,0014/M3, więc nie mniejsza od bromooctanu etylu.
Mało używanemi i prawie niezbadanemi lakrymatorami są tiofosgen i bytylmerkaptan. Napastliwość ich jest znacznie mniejsza od bromacetonu. Tiofosgen CSCl2, czerwony płyn o drażniącym bardzo nieprzyjemnym zapachu, z p. w. 75°, otrzymano przez chlorowanie siarczka węgla CS2 w obecności wody. Butylmerkaptan C4H9 SH jest to okropnie śmierdzący płyn, z bardzo nieznaczną napastliwością.
Mniej czynnemi lakrymatorami są związki cyanu z chlorowcami mianowicie chlorek, jodek i bromek cyanu, które są słabsze nawet od chloropikryny. Są one jednak wyraźnemi truciznami duszącemi.
Mimo to są one bardzo czynnemi truciznami o działaniu ogólnem, podobnem do kwasu pruskiego. Jodek cyanu jest również wyraźną trucizną krwi wywołującą powstanie methemoglobiny. Zatrucie temi związkami powoduje z początku znaczną duszność, kurcze, rozszerzenie się źrenic, ślinienie, wymioty i wkońcu śmierć od porażenia ośrodka oddechowego.
Stężenie śmiertelne dla psów jest: CNCl 0,25/M3 (śmierć w 30′) CNBr 0,5/M3 (30″) i CNJ 2/M3 (30″).
Chlorek cyanu jest w temperaturze 15° oleistym płynem i posiada zapach drażniący. Bromek cyanu jest stałem ciałem z p. t. 52°C.
Obydwóch tych środków używano w czasie wojny jako drażniących i duszących trucizn do napełniania pocisków. Chlorek cyanu, czysty lub zmieszany z chlorkiem arsenu, był zastosowany przez Francuzów, pod nazwą mauginit (Mauguinite), bromek cyanu był jednym ze składników austrjackiej mieszaniny kampelitu. Bromek cyanu oprócz właściwości duszących i drażniących posiada wyraźne właściwości środka żrącego, wywołującego natychmiastowe bardzo bolesne oparzenie skóry.
Bardzo słabemi lakrymatorami są też mocno drażniące olejki gorczyczne czyli połączenia nienasyconych rodników alkoholowych np. allylu C3H5 albo winylu C2H3 z grupą NCS (sulfoizocyanową). Najlepiej zbadany jest zwykły olejek gorczyczny t. j. związek allylowy, zawarty w licznych gatunkach roślin warzywnych w połączeniu z typem glukozydów, np. tak zw. sinigriny. Olejek ten może być otrzymany dość łatwo sztucznie. Połączenia grupy sulfoizocyanowej z aromatycznemi albo nasyconemi rodnikami tłuszczowemi są prawie pozbawione właściwości drażniących.
Podobnemi do olejków gorczycznych są ciała wywołujące łzawienie, znajdujące się w cebuli i czosnku; są to siarczki (siarczkoetery) tychże rodników. Zwykła cebula zawiera siarczek dwuallylowy (C3H5)2S, czosnek zaś cały szereg siarczków i dwusiarczków, przeważnie siarczek allylopropilowy; nadzwyczaj cuchnąca cebula kaukaska (Allium ursinum) zawiera siarczek dwuwinylowy.
Napastliwość tych związków w porównaniu z omówionemi wyżej jest bardzo nieznaczna. Zwykły olejek gorczyczny jest np. 3 razy słabszym lakrymatorem od bromku benzylu. Trzeba jednak podkreślić, że wszystkie te związki, jako łatwo rozpuszczalne w tłuszczach, szybko wywołują bolesne podrażnienie skóry, jak to wiadomo każdemu z działania synapizmów. Jako środków bojowych używano w pewnych pociskach niemieckich olejku gorczycznego (pocisk Nr 13).
Poszczególne właściwości najważniejszych lakrymatorów są takie:
aromatyczne pochodne — bromki benzylu (T Stoff) i ksylylu (grün T Stoff) jak również kamit są bezbarwnemi płynami z wysokim punktem wrzenia (około 200°); przy obniżeniu temperatury przybierają one postać stałych ciał (kamit posiada p. t. +16° do 22°). Otrzymano ich przez chlorowanie względnie bromowanie toluolu i ksylolu. Dla otrzymania kamitu chlorek benzylu przetwarzano z początku w cyanek benzylu przez dodawanie cyanku sodu, a następnie bromowano.
Bromowane ketony są też bezbarwnemi lub żółtawemi płynami, wrzącemi około 120°. Otrzymywano je przy pomocy bromowania, w obecności KClO3.
Chloracetofenon, lakrymator przyszłości, jest krystalicznym stałym ciałem z p. t. 59° i p. w. 245°. Otrzymano go z bezwodnika kwasu octowego i kwasu benzoesowego.
Środkami, które używano specjalnie w celu wywoływania odruchu kichania, były 1) pewne proszki roślinne i proszek z majek, 2) pewne syntetyczne substancje i wśród nich przedewszystkiem organiczne związki arsenowe, z których pewna część otrzymała specjalną nazwę sternitów (Blaukreuzstoffe).
Co do proszków roślinnych to najbardziej dostępnym z nich jest tak zw. tabaka, czyli proszek z liści tytoniowych; niektórzy używają jej nałogowo. Zwyczaj zażywania tabaki teraz prawie zanikł, ale sto lat temu był niemniej rozpowszechniony niż obecnie nałóg palenia. Rzucenie garstki tabaki w twarz może napewno obezwładnić na jakiś czas ofiarę, to też proszek ten jest być może najstarszym ze sternuatorów. Zwracamy uwagę, że stałe znajdowanie się w atmosferze zawierającej pył tytoniowy wywołuje specjalną chorobę płuc tak zw. pylicę tytoniową (Tabacosis pulmonum), połączoną zwykle z gruźlicą.
Znacznie czynniejszemi od tabaki są proszki z korzenia trużynu wymiotnego (Cephaelis ipecacuanha) zawierającego alkaloid emetynu. W aptekach nie są rzadkie wypadki niebezpiecznych zapaleń oczu, nosa i gardzieli podczas wyrobu tego proszku.
Pierwszemi oznakami działania są: łzawienie, katar, ślinienie i oporne wymioty. Roślina ta należy do flory podzwrotnikowej Ameryki i jest za kosztowna na to, żeby mieć znaczenie środka bojowego.
To samo można powiedzieć o bardzo skutecznych, jako sternity, proszkach z nasion sabadylly (Veratrum sabadilla), albo kichawca i z korzenia ciemierzycy (Helleborus niger). Słabszym środkiem są proszki z Veratrum album i viride (roślin należących do flory europejskiej). Wszystkie te rośliny zawierają bardzo drażniący alkaloid — weratrynę, która prócz tego należy sama przez się do najmocniejszych trucizn wogóle. Na przeszkodzie do użycia tych proszków w większych ilościach stoi ich wysoka cena i trudność otrzymania tak wielkich ilości, jakie są potrzebne do celów bojowych. Weratryna jest też środkiem mocno drażniącym skórę.
Z innych proszków roślinnych trzeba jeszcze zwrócić uwagę na proszek z kory mydłoki, bardzo rozpowszechniony preparat apteczny, używany do czyszczenia sukien.
Proszek ten jest według danych francuskich autorów jednym z najmocniejszych sternitów i wywołuje obfite wydzielanie śluzu w nosie i oporne łzawienie. Zawiera on jeden z saponinów, mianowicie kwas kwiłajowy. Saponiny wogóle są substancjami bardzo rozpowszechnionemi wśród roślin — więc prawdopodobne jest iż analogiczne właściwości muszą posiadać preparaty z bardzo zwykłych roślin naszej strefy jak to preparaty dziewanny i kasztanu końskiego.
Bardzo mocnym środkiem drażniącym i do tego dostępnym w stosunkowo dużych ilościach jest pieprz czerwony (Capsicum annuum), jedyny środek pochodzenia roślinnego, który rzeczywiście był używany w czasie ostatniej wojny. Posiada on zdolność przenikania przez zwykłe maski ochronne i zmusza do natychmiastowego usunięcia masek. Jest to według pewnych wskazówek jeden z najmocniejszych środków wogóle, działający nietylko na dostępne śluzówki, ale też i na skórę, wywołując bolesne oparzenia. (Według naszych własnych doświadczeń, drażniące działanie czerwonego pieprzu na skórę jest w przeciwieństwie do tych danych bardzo słabe).
Jeszcze mocniejszym jest pieprz kajeński (Capsicum crassum), którego znaczne ilości importowano z Ameryki Południowej. Te rodzaje pieprzu zawierają, podobny do kamfory, lotny związek — kapsicinę, czynny w bajecznie małych stężeniach. Cokolwiek mocniejsze stężenia wywołują już znaczne stopnie zapalenia i zmianę w odległych narządach — nerkach i jądrach. Ponieważ pieprz czerwony jest zwykłą przyprawą, używaną w całej południowej Europie i może być kultywowanym i w Polsce, to dalsze badania tej trucizny i warunków zastosowania jej do celów bojowych są bardzo pożądane.
Syntetyczne środki do wywołania kichania były zastosowane według niemieckich danych przez Niemców, jako pierwsze chemiczne środki bojowe. Pierwszym sternitem z tych czasów była prawdopodobnie dwuanisidyna — NH2. (CH3O) C6H3. C6H3 (CH3O) NH2, biały proszek, który w warunkach laboratoryjnych doświadczeń okazał się jako dość mocna trucizna, wywołująca skurczowe kichanie i duszność. Używano jej w formie tak zw. pocisków Ni, oraz bomb zawierających ten proszek (Staubgeschosse). Podrażnienie okazało się jednak dość słabe, trwało tylko krótki czas i działanie środka rozciągało się tylko na bardzo małą przestrzeń.
Najważniejszemi z tych środków, zarówno z punktu widzenia łatwości otrzymania, jak i z punktu widzenia napastliwości, są bezwątpienia syntetyczne związki arsenowe, które właśnie otrzymały specjalną nazwę sternitów. Wszystkie one są pochodnemi arseniaku AsH3, albo raczej trójchlorku arsenu, w którym jeden, dwa albo nawet trzy atomy chloru są podstawione przez jakiś, w niektórych wypadkach również chlorowany, rodnik szeregu tłuszczowego albo aromatycznego. Chlor może być też zastępowany przez brom lub cyan, co, jak już zauważyliśmy w lakrymatorach (synteza kamitu), znacznie podnosi napastliwość związku, jako środka drażniącego. Dotychczas używano z dość dodatniemi skutkami następujących związków:
| 1) metylodwuchloroarsiny | As Cl2CH3 |
| 2) metylodwubromoarsiny | AsBr2CH3 |
| 3) dwuchloro-etyloarsiny | AsCl2C2H5 |
| 4) dwubromo-etyloarsiny | AsBr2C2H5 |
| 5) dwuchlorofenyloarsiny | As Cl2C6H5 B. Kr. I |
| 6) chlorodwufenyloarsiny | AsCl(C6H5)2 Bl. Kr. I. |
| 7) cyanodwufenyloarsiny | As CN (C6H5)2 Bl. Kr. II. |
Do tych typowych arsin trzeba dodać jeszcze najczynniejszy ze sternitów adamsyt czyli
8) imidodwufenylo-chloroarsinę NH(C6H4)2 AsCl, związek pochodny z dwufenyloaminy C6H5.NH. C6H5.
Do tego szeregu związków należy też i słynny luizyt, osławiony jako najmocniejsza trucizna bojowa. Luizyt ma rzeczywiście wyraźne właściwości trujące, oprócz właściwości żrących i drażniących. Jednakże wyraźnej zdolności do wywoływania odruchu kichania u prawdziwego luizytu (a luizytu) nie zauważono i dlatego należy go zaliczać do środków żrących, czyli trucizn skórnych. Niezłym sternitem jest tak zw. c luizyt.
Wzór luizytu a jest: ClCH: CH. AsCl2, czyli, że jest on chlorowinylodwuchloroarsiną. Luizyt c jest trójchlorowinyloarsiną (Cl CH2CH)3As.
Właściwości środków drażniących posiadają jeszcze inne liczne związki arsenowe, w praktyce bojowej nieużywane. Do takich należą:
| 1. tlenek metyloarsiny | CH3AsO |
| 2. tlenek kakodylu | (CH3)2 As. O. As (CH3)2 |
| 3. chlorek kakodylu | (CH3)2AsCl. |
| 4. bromek kakodylu | (CH3)2AsBr |
| 5. cyanek kakodylu | (C3H)2AsCN |
| 6. rodanek kakodylu | (C3H)2AsCNS |
| 7. tlenek etyloarsiny | (C2H5)AsO |
| 8. tlenek fenyloarsiny | (C6H5)AsO |
| 9. paranitrofenylodwuchloroarsina | (C6H4NO2)AsCl2 |
| 10. naftylodwuchloroarsina | (C8H9)AsCl2 |
Wogóle pochodne aromatyczne posiadają wyraźniejsze właściwości drażniące, lecz mniej wyraźne ogólne trujące niż pochodne szeregu tłuszczowego. Są jednak ciekawe wyjątki. I tak dwufeniloimidoarsina (C6H5)2 As NH jest zupełnie pozbawiona właściwości drażniących, gdy bardzo podobny do niej adamsyt
| NH < | C6H4 C6H4 |
> As. Cl |
jest jednym z najmocniejszych sternitów.
Napastliwość związków arsenowych jest bardzo znaczna. Człowiek nie jest w stanie wytrzymać dłużej niż jedną minutę w stężeniach na M3:
| cyanku difeniloarsiny | 0,00025 |
| chlorku difeniloarsiny | 0,001 |
| tlenku etyloarsiny | 0,0005 |
| etylodwuchloroarsiny | 0,038 |
| cyanku kakodylu | 0,04 |
| fenylodwuchloroarsiny | 0,04 |
W tych warunkach bromek acetonu wywołuje takie same skutki w stężeniu 0,045, a bromek benzylu w stężeniu 0,06.
Napastliwość arsenowych środków bojowych jest taka:
| 1. dwubromoetyloarsina | 0,05/M3 |
| 2. dwuchloroetyloarsina | 0,034/M3 |
| 3. dwufenylochloroarsina | 0,001/M3 |
| 4. dwufenylocyanarsina | 0,001/M3 |
| 5. adamsyt | 0,0004/M3 |
Wszystkie prawdziwe sternity są ciałami stałemi, bardzo mało lotnemi, t. j. dającemi minimalną ilość pary w niskiej temperaturze j. np. ciśnienie nasyconej pary niemieckiego sternitu II (dwufenylochloroarsiny) wynosi w temperaturze 25°C tylko 0,0003 mm Hg. fenylodwuchloroarsiny (sternit I) trochę więcej — 0,035 mm, adamsytu prawdopodobnie mniej. Są one nierozpuszczalne w wodzie, lecz w wilgoci nieco rozkładają się zczasem.
Dwufenylochloroarsina i dwuchloroetyloarsina dają z wodą odpowiednie tlenki — też drażniące i trujące substancje; na dwufenylocyanoarsinę woda nie działa, a adamsyt jest całkiem nierozpuszczalnym w czystej wodzie bardzo stałym związkiem.
Zasadniczą cechą wszystkich prawdziwych sternitów jest ich zdolność do sublimowania i do wytwarzania wskutek tej sublimacji bardzo stałych dymów drażniących, znacznie czynniejszych od dymów trujących, o których mówiono wyżej. Cząsteczki trucizny powstałe w taki sposób są niezwykle małe (dla dwufenylochloroarsiny np. mniej od 10-5 cm.) Dzięki temu powstały dym ma w pewnym stopniu właściwości koloidów, w których dyspersującą fazą jest gaz, a dyspersowaną ciało stałe. Na żywe komórki dymy takie muszą działać nie jako rozczyn, w którym stopień dyspersji jest o wiele znaczniejszy, lecz jako substancja w nierozpuszczonym stanie. Na tem polega oczywiście mocne działanie wszystkich drażniących pyłów o wiele mocniejsze niż jakichkolwiek prawdziwych gazów i par. Prawdopodobnie mamy takież same warunki dla pewnych lakrymatorów, jak np. chloroacetofenon, używanych jako ciała stałe.
Działanie związków arsenowych nie ogranicza się jedynie do wywoływania odruchu kichania. Jest ono znacznie niebezpieczniejsze. Nawet w stężeniach, których można było użyć w doświadczeniach na ludziach mamy np. takie objawy.
Dwuchloroarsina, płyn wrzący w temperaturze 156°C i łatwo rozpuszczalny w odczynnikach organicznych, nie tworzy dymów jak prawdziwe sternity; dla doświadczeń rozpuszczano ją w benzynie i rozpylano w zwykły sposób. W doświadczeniach okazało się, że w zawartości w pokoju 0,1 mm3/M3 — 0,000168/M3 nie można jeszcze zauważyć charakterystycznego zapachu trucizny, przypominającego zapach jabłek, ani odczuć jakiegokolwiek podrażnienia śluzówki nosa, które jest bardzo wyraźne w obecności 0,5 mm3/M3. Po rozpyleniu 1 mm3/M3 = 0,00168/M3 i po upływie 5 minut zauważono już znaczne podrażnienia śluzówki nosa, kichanie i palenie w gardzieli. W stężeniu 20 mm3/M3 (0,0336/M3) można było zaledwie wykonać kilka wdechów w zatrutej atmosferze. Po upływie kilku godzin po doświadczeniu, zauważono ataki prawdziwej dusznicy, powtarzające się ponownie w ciągu następnej nocy.
Dwufenylocyanoarsina jest jeszcze mocniejszym środkiem drażniącym. Obecność 0,00001/M3 wywołuje objawy podrażnienia nosa a potem gardzieli, stężenie 0,0005/M3 jest już nie do wytrzymania.
Skutki podrażnienia są mniej więcej takie same, jak dla innych sternitów, t. j. kichanie, kaszel, do którego dołącza się wymioty, ból zębów a nawet ciężki ból głowy i ataki dusznicy.
Trzeba podkreślić niezwykłe słabe działanie trucizny na oczy, zależne od tego, że prąd łez natychmiast usuwa nierozpuszczalną w wodzie substancję do jamy noso-gardzielowej.
Podczas użycia większych stężeń w doświadczeniach na zwierzętach zauważono omówione wyżej zjawiska podrażnienia i anatomiczne zmiany górnych dróg oddechowych niemniej wyraźne niż w zatruciu truciznami grupy chloru. Już w ciągu pierwszej godziny po zatruciu powstają masy błon rzekomych w tchawicy i oskrzelach, które wskutek martwicy nabłonka i wysięku włóknikowego podśluzówki przybierają charakter dyfterytyczny, następnie dołączają się, wywołane przez drobnoustroje, obfite ropienia. W płucach już w pierwszych chwilach zatrucia występuje na pierwszy plan znaczne przekrwienie, wybroczyny i zastój krwi, skąd wynika wyraźne rozszerzenie się prawego serca. Zjawiska te mogą być przyczyną śmierci już w ciągu pierwszej godziny po zatruciu. Zwykle śmierć następuje w ciągu 4 — 18 godzin po zatruciu.
Do tych objawów miejscowych uszkodzeń narządu oddechowego, wśród których paraliż naczyń jest typowym dla działania związków arsenowych, w wypadkach długotrwałych zatruć, gdy zatrute zwierzę żyje dłużej niż dobę, dołączają się objawy zatrucia ogólnego — przedewszystkiem wymioty i biegunka, jak zwykle w zatruciu kwasem arsenawym, a dalej zwyrodnienia tłuszczowe i białkowe narządów miąższowych: nerek i wątroby. Związki arsenowe są wogóle wybitnemi truciznami nerkowemi.
Zatrucie sternitami pociąga za sobą też bardzo poważne skutki. Zauważono cały szereg objawów ze strony układu nerwowego (ataksję i paraliże, zapalenia nerwów obwodowych), znaczne wychudzenie i zmiany we krwi (wyraźna leukocytoza), choroby skórne. W ostrych zatruciach powstaje zapalenie skóry podobne do róży, a następnie tworzenie się pęcherzy jak w oparzeniach.
Istota działania sternitów polega więc na zdolności związków arsenowych trójwartościowych wywoływania uszkodzeń zarodzi komórek. Dlatego wszystkie związki arsenowe, o ile są rozpuszczalne w wodzie, okazują się mocnemi truciznami dla jednokomórkowych tworów (wymoczków) i dla zwierząt wodnych wogóle, które giną wskutek zniszczenia nabłonka oskrzeli i skóry. Jadowitość sternitów, o ile są rozpuszczalne w wodzie, albo dają odpowiednie związki rozpuszczalne tlenowe, jest w porównaniu z kwasami arsenawym i arsenowym o wiele znaczniejsza i tak wymoczki giną już w rozczynie dwufenylochloroarsiny 1/20.000.000, gdy dla kwasów arsenawego i arsenowego to stężenie jest równem 1/1000, a dla ich soli sodowych nawet 1/200 względne 1/300.
Chemiczne właściwości najważniejszych sternitów są następujące.
Arsiny szeregu tłuszczowego są bezbarwnemi płynami, z wyraźnym zjadliwym zapachem, cięższe od wody. Ciężar gatunkowy CH3AsCl2 = 1,84, C2H5As Cl₂ = 1,68. Punkty wrzenia 132° względnie 156°. Są one nieco rozpuszczalne w wodzie, podlegają jednak stopniowo hidrolizie. W odczynnikach organicznych są one łatwo rozpuszczalne.
Otrzymano ich w czasie wojny w znacznych ilościach (w Niemczech) przez działanie kwasu solnego na tlenek metylo względnie etylo arsiny. Tlenki te są produktami odtleniania sodowej soli kwasu alkyloarsenowego, etery otrzymują się z arseninu sodu przez działanie (CH3)2SO4 względnie C2H5Cl według wzorów:
Na3AsO3 + (CH3)2SO4 = CH3AsO + Na CH3 SO4
Na3 AsO3 + C2H5Cl = C2H5Na2AsO3 + NaCl
R. AsO3Na2 + SO2 = RAsO + Na2SO4
Przy działaniu kwasu solnego na RAsO powstają chloroarsiny: RAsO + 2 HCl = RAsCl2 + H2O.
Arsiny szeregu aromatycznego w Niemczech otrzymano w sposób podobny do omówionego z tlenku difeniloarsiny i kwasu solnego. Sodową sól kwasu feniloarsenawego otrzymano przez działanie chlorku diazobenzolu na arsenin sodu. Na3 AsO3 + C6H5N2Cl = Na Cl + N2 + C6H5 As O3 Na2. Anglicy i Francuzi używali wygodniejszego sposobu kondensacji chlorobenzolu i trójchlorku arsenu w obecności metalicznego sodu.
3 C6H5Cl + As Cl3 + 6 Na = (C6H5)3As + 6 NaCl
(C6H5)3As + 2 As Cl3 = 3 (C6H5) As Cl2.
Adamsyt AsCl (C6H4)2NH otrzymywano przez działanie AsCl3 na dwufeniloaminę.
(C6H5)2 NH + As Cl3 = 2 HCl + AsCl (C6H4)2 NH.
Jest on krystalicznem stałem ciałem z p. t. 194°. W czystem stanie posiada on jasnożółte zabarwienie. Techniczny produkt, używany do celów bojowych, jest brudnozielony.
Większość omówionych środków drażniących posiada właściwości wywoływania prócz innych odruchów, wymiotów, jako skutku rozpromieniania się odruchu kaszlowego. Istnieją jednak trucizny, które są w stanie wywołać wymioty niezależnie od kaszlu, albo też drogą odruchową, drażniąc zakończenia nerwu błędnego, przedewszystkiem w żołądku i w gardzieli, albo bezpośrednio działając na ośrodek tego odruchu w rdzeniu przedłużonym. Ostatniego rodzaju trucizną jest np: apomorfina. Czy pewne trucizny bojowe mają zdolność bezpośredniego drażnienia ośrodka, czy też wszystkie działają wyłącznie przez podrażnienie powierzchni alarmowych (w wypadkach wprowadzenia trucizny z pominięciem przewodu pokarmowego, takie działanie może być skutkiem wydzielenia trucizny przez śluzówkę żołądka), tego dotychczas jeszcze nie wiemy. W każdym razie pewnych środków używano specjalnie do wywoływania wymiotów. Takiemi środkami są etylokarbazol i dwuchlorek fenylokarbiłaminy. Skuteczność ich jednak ulega pewnej wątpliwości. Te same związki były używane także do innych celów, mianowicie: dwuchlorek fenilokarbiłaminy (feniloimidofosgen) jako lakrymator, a etylo karbazol jako sternit (w niemieckich pociskach Blaukreutz w mieszaninach z pochodnemi arsenowemi).
Feniloimidofosgen C6H5NCOCl2 zabija króliki w stężeniu 2 — 6/M3. W mniejszych stężeniach (1/M3) zwierzęta zdychają dopiero po kilku dniach, wskutek znacznego zapalenia oskrzeli.
Etylo karbazol
| C6H4 C6H4 |
> N.C2H5 |
jest dość słabą trucizną skórną, lecz wywołuje również podrażnienie górnych dróg oddechowych: kaszel, kichanie i wymioty. Stężenie 1 — 2/M3 zabija psy w ciągu 2 — 3 dni przez powstanie zmian w narządach oddechowych podobnych do tych, które zauważono w zatruciu chlorem. Podskórne wstrzykiwania 0,01 — 0,02 p. k. zabijają w ciągu 4 — 9 godzin. Należy on raczej do środków duszących niż do prawdziwych womitatorów. Używanie obydwóch związków jako środków bojowych było tylko przejściowe.
Wymioty, wywołane przez te dwa środki, są oczywiście pochodzenia odruchowego.
Do środków odruchowych, których działanie jest jeszcze zupełnie niewyjaśnione, należy nieliczna grupa środków wywołujących stratę uczucia równowagi. Francuzi określili ich jako poisons labyrinthiques, chociaż nie posiadamy żadnych podstaw, żeby uznać, iż te trucizny miały istotnie zdolność do uszkodzenia labiryntu, lub ściślej kanałów półkulistych. Jako taka trucizna występuje eter dwuchlorometylowy (CH2Cl)2O i jego homolog eter dwuchloroetylowy (CH3CHCl)2O, jak również odpowiednie związki bromowane (CH2Br)2O i (CH3CHBr)2O. Używano ich raczej jako niezłych lakrymatorów lub jako rozczynników dla sternitów (Niemcy). Eter dwuchlorometylowy otrzymano przez działanie na formalinę (aldehyd mrówczany) kwasu solnego w obecności kwasu siarczanego
2 H. COH + 2 HCl = ClCH2 O. CH2Cl + H2O.
Zamiast kwasu siarczanego zwykle używano chlorosulfonowego. Eter dwubromometylowy otrzymano przez dodawanie zamiast kwasu chlorosulfonowego bromku amonu.
Strata uczucia równowagi w doświadczeniach z zatruciem zwierząt, przeważnie ptaków, jest bardzo wyraźna. Ścisłych badań dotychczas niema.
Z punktu widzenia toksykologicznego trucizny skórne można podzielić według sposobu dostarczania ich do skóry na dwie grupy: trucizny, których źródłem jest krew, więc trucizny wywołujące zatrucia skóry pochodzenia wewnętrznego i trucizny, których źródłem jest otoczenie, dla ludzi więc przedewszystkiem powietrze i w znacznie mniejszym stopniu zanieczyszczone trucizną powierzchnie otaczających przedmiotów i samej skóry.
Trucizna taka musi koniecznie posiadać właściwości dermotropizmu, t. j. być zdolną do łączenia się w pierwszym szeregu z komórkami skóry, przeważnie z komórkami naskórka, albo gruczołów skórnych. Prócz prawdziwych trucizn skórnych mamy jeszcze cały szereg substancyj, które, wywołując w odpowiednich stężeniach ścinanie się białka albo jego denaturację, mogą przez działanie na żywe tkanki spowodować natychmiastową martwicę. Ponieważ te trucizny wywołują martwicę nietylko skóry — przeto nie zaliczamy ich do szeregu trucizn skórnych mimo to, że zwykle miejscem wywołanych zmian jest rzeczywiście skóra.
Są to środki żrące w prawdziwem znaczeniu tego wyrazu, używane w medycynie jako środki przypalające. Do nich należą: mocne kwasy mineralne i ich pochodne, pewne kwasy organiczne i szczególnie ich pochodne, mocne ługi, sole ciężkich metali, chlorowce jak również niektóre inne substancje.
Jako przykład mogą służyć: HNO3; H2SO4; CH2OH. CH2COOH; CCl3. COOH; KOH; HgCl2; AgNO3, Br2; Cl2.
Niektóre z nich nawet były stosowane w ofensywie, np. rzucanie naczyń z kwasem siarczanym, jednakże mając na względzie już umówione zasady, do istotnych trucizn bojowych zaliczyć ich nie możemy. Słabsze ich stężenia, niezdolne do natychmiastowego niszczenia naskórka, są dla skóry prawie obojętne.
Poza tem dla większości tych środków, z wyjątkiem chlorowców, żadnych zjawisk dermotropizmu po wprowadzeniu wewnątrz ustroju nie zauważono.
Z szeregu prawdziwych trucizn skórnych, trucizny z działaniem wewnętrznem mają z naszego punktu widzenia również małe znaczenie. Objawy takich zatruć są przeważnie skutkiem uszkodzenia gruczołów skórnych, mianowicie gruczołów tłuszczowych, których zapalenie wywołuje powstanie trądzików. Jest to dość pospolite zjawisko spowodowane używaniem całego szeregu lekarstw np. bromków i jodków.
Inne zaś środki, z działaniem zazwyczaj wewnętrznem, należące do rzędu substancyj obojętnych — wywołują przekrwienie i raptownie powstający obrzęk skóry, t. zw. pokrzywkę. Zjawisko to zależy od pewnych właściwości indywidualnych zatrutej jednostki, których zespół nazwano idjosynkrazją. Takich środków, które mogłyby wywoływać pokrzywkę u każdego zatrutego osobnika dotychczas nie znamy.
Trzeci rodzaj środków może w długotrwałych zatruciach wywołać niezwykłe zabarwienie skóry. Takie zabarwienie w jednych wypadkach powstaje wskutek tworzenia się pochodnych samej trucizny, jak to bywa np. w chronicznem zatruciu solami srebra (t. zw. argyrja), w drugich zaś barwniki te stanowią produkty odpowiedniego rozkładu krwi (melanodermia arsenicalis w zatruciach arszenikiem). Jeszcze w innym wypadku mamy do czynienia z powstawaniem nadmiernej ilości własnego barwnika skóry. Ta postać jest raczej skutkiem działania zewnętrznego. Występuje ona pod działaniem promieni Roentgena, promieni ultrafioletowych i jako skutek zatruć bojowych iperytem, co ma znaczenie dla djagnozy dawniejszych zatruć. Prócz tego należy zauważyć, że cały szereg, w zasadzie obojętnych, ciał może uczynić skórę bardzo wrażliwą na działanie światła. Działanie takie zowie się fotodynamicznem. Jest ono właściwością fluoryzujących barwników anilinowych (np. eozyny) i substancyj zawartych w pewnych roślinach. Używanie takich roślin jako pokarmu wywołuje zapalenie skóry (egzema) na wszystkich dostępnych dla słonecznego światła powierzchniach ciała, zarówno u ludzi jak i u zwierząt. Taką właściwość posiada np. gryka, mianowicie używana jako pokarm dla bydła łuska gryczana. Ciekawem zjawiskiem jest, że wśród zwierząt chorują w taki sposób tylko białe albo mające białe plamy jednostki, czarne są zupełnie niewrażliwe.
Wszystkie zatrucia skórne tego rodzaju, t. j. zatrucia pochodzenia wewnętrznego, powstają wyłącznie w razie chronicznego, powolnego działania trucizn i dlatego jako zatrucia bojowe nie mają żadnego znaczenia.
Wszystkie trucizny bojowe, działające na skórę można zaliczyć do środków, wywołujących zatrucia pochodzenia zewnętrznego.
Zasadniczą właściwością trucizn skórnych, działających z otaczającego środowiska jest dermatropizm, czyli zdolność do nagromadzenia się w skórze i przenikania tą drogą do krwi. Zależy to przedewszystkiem od tego, że takie substancje są bardzo łatwo rozpuszczalne w tłuszczu, a ponieważ naskórek jest zawsze przepojony tłuszczem skórnym, podobnym do lanoliny (tłuszczowy eter cholesteryny), skóra staje się jakby pułapką dla wszystkich tego rodzaju związków, znajdujących się w środowisku w najmniejszych nawet stężeniach. Dzięki temu skóra, nieprzepuszczalna dla rozczynów wodnych, jest bardzo łatwo przepuszczalna dla mieszanin trucizn z tłuszczami albo dla ich rozczynów alkoholowych, eterowych, chloroformowych i t. d.
Skóra, a przede wszystkiem skóra ludzka, jest jedną z najczulszych tkanek już wskutek swej budowy anatomicznej.
Pod martwym naskórkiem rogowym, przepojonym tłuszczem, leży warstwa żywych, obficie dzielących się, komórek nabłonkowych (warstwa Malpighiego) nadzwyczaj czułych na trucizny. Głębiej znajduje się obfitująca w naczynia włoskowate warstwa brodawkowata skóry właściwej, w której leży znaczna ilość zakończeń nerwowych. Mamy więc podstawę zarówno dla szybkiego rozwoju zapaleń z obfitym wysiękiem, jak i dla zjawisk czynnościowych. Wskutek omówionych właściwości anatomicznych mamy następujące zasadnicze formy działania trucizn na skórę: 1) podrażnienia swoistych narządów nerwowych, powstawanie uczucia zimna (np. przy działaniu mentolu), ciepła (działanie alkoholu), znieczulenia (kwas karbolowy) i przedewszystkiem swędzenia, palenia i bólu (prawie wszystkie trucizny skórne). Łącznie z temi, przeważnie czynnościowemi zmianami, występują zwykle objawy zapalenia, z początku jako miejscowe przekrwienie, następnie obrzęk, a dalej surowiczny wysięk pomiędzy warstwami naskórka (głównie w warstwie komórek kolczastych) w postaci pęcherzy. Pęcherze te mogą być bardzo drobne, tworząc rodzaj wysypki, mogą też zajmować całą powierzchnię podległą działaniu trucizny. Jeszcze mocniejsze, albo raczej jeszcze dłuższe działanie wywołuje martwicę, z początku nabłonka, a potem i głębokich warstw skóry. Po zagojeniu powstałych wrzodów pozostają blizny: białe wskutek zaniku komórek barwnikowych, albo odwrotnie zabarwione na ciemno wskutek zwiększonego ich rozwoju.
Charakter i stopień rozwoju tych zmian zależy nietyle od rodzaju trucizny, ile od jej stężenia i ogólnej ilości. Należy zwrócić uwagę na ten szczegół, że różne ustroje oddziaływują niejednakowo i że wrażliwość skóry jest niejednakowa nawet wśród przedstawicieli jednego gatunku. Dlatego w danym wypadku doświadczenia wykonane na zwierzętach mają bardzo małe znaczenie, a doświadczenia na ludziach zasługują na uwagę tylko w tych wypadkach, kiedy są dokonane na dużej ilości osobników. Tyczy się to przedewszystkiem określenia stopnia napastliwości danej trucizny.
Czynność trucizn skórnych określa się obecnie (badania laboratorjum arsenału Edgewood i wojskowych laboratorjów w Paryżu) w ten sposób, że na skórę wewnętrznej powierzchni przedramienia, zapomocą bardzo cieniutkiej pipety, wprowadza się maleńką ilość rozczynu danej trucizny w odpowiednim rozczynniku i rozsmarowuje się. Używa się do tego rozczynów najsłabszych, które wywołują wyraźne przekrwienie, trwające zazwyczaj niemniej niż dobę.
Trzeba zauważyć, że wybór rozczynnika nie jest rzeczą obojętną i zależy oczywiście od stopnia rozpuszczalności w tym odczynniku lipoidów skóry i od jego zdolności przenikania do głębszych warstw skóry, a mianowicie do naczyń włoskowatych.
Tak np. dla iperytu próg wrażliwości zmienia się zależnie od rozczynników w taki sposób:
rozczyn alkoholowy dla człowieka 1/100 — 1/500; dla konia 1/1000,
| rozczyn w eterze naftowym dla człowieka | 1/500 |
| „ chlorobenzolu „ „ | 1/500 |
| „ czterochlorku węgla „ „ | 1/200 |
Następujące grupy posiadają właściwości zewnętrznych trucizn skórnych.
I. Środki pochodzenia zwierzęcego.
1. Kantarydyna — trucizna zawarta w ciele pewnych owadów (żuki majki).
II. Środki pochodzenia roślinnego. Znamy ich wiele, skuteczniejszemi z nich są:
2. trucizny otrzymane z rozmaitych gatunków sumaku, mianowicie laccol z Rhus vernicifera, drzewa lakowego, z którego wyrabia się japoński lak i toksykodendrol jeszcze znacznie mocniejsza trucizna z amerykańskiego bluszczu Rhus toxicodendron.
3. Kardol, oleisty płyn, otrzymywany z łupin nasion t. zw.
słoniowych wszy, Anacardium orientale i Semecarpus anacardium, roślin podzwrotnikowych, z których pierwsza spotyka się w Ameryce podzwrotnikowej, a druga w Indjach Wschodnich. Roślina ta stanowi bardzo niebezpieczny środek.
4. Olej krotonowy — tłuszcz zawarty w nasionach rośliny Croton Tiglium, również pochodzącej z Indyj Wschodnich. Niemniej mocnym środkiem jest olej z nasion Jatropha Curcas, rośliny chodowanej we wszystkich krajach podzwrotnikowych (Indje, Afryka, Ameryka), jako źródło taniego tłuszczu, używanego do celów technicznych.
5. Smoła loczydła gargańskiego (Thapsia garganica) rośliny dość pospolitej na południu Europy i w północnej Afryce.
6. Kapsycyna, bardzo drażniący związek zawarty w rozmaitych gatunkach czerwonego pieprzu (Capsicum annum, crassum, fastigiatum), znanego też jako sternit.
7. Olejki gorczyczne.
III. Środki otrzymane sztucznie (syntetycznie).
1. Środki nie zawierające siarki lecz zawierające chlorowce.
a) Pochodne acetonów:
dwuchloroaceton ClCH2−CO−CH2Cl,
trójchloroaceton CCl3−CO−CH3.
b) Trójchlohydryna CH2Cl−CHCl−CH2Cl.
c) Trójchloroamina NCl3 in statu nascendi (wybuchający chlorek azotu, używany w stanie chmur — według danych francuskich).
d) Bromek benzylu C6H5CH2Br.
e) Bromofenilooctan etylu C6H5−CHBr−CO−C2H5.
2. Środki zawierające siarkę.
a) Tiofenol C6H5SH. Działa dość słabo.
b) Iperyt S(CH2.CH2Cl)2 i inne związki tego typu. Iperyt jest najmocniejszą z syntetycznych trucizn skórnych.
c) Związki sulfocyanowe: siarkocyanek etylenowy (NCS.)2C2H4. Jeden z najsilniejszych środków świerzbiących.
d) Sztuczne olejki gorczyczne, isosulfocyanki, np. etylo iso sulfo karbylamina C2H5NCS, wywołują dość szybko bolesne przekrwienie i zapalenie skóry z obfitym wysiękiem. Są też one mocnemi lakrymatorami.
3. Nitrowane pochodne aromatyczne.
a) Cedenit — mieszanina orto i para chloronitrobenzylu ClCH2C6H4NO2. Wywołuje natychmiast ból i obrzęk skóry podobny do oparzenia pokrzywą.
b) Chloronitrobenzonitryl Cl.C6H3. CN.NO2.
4. Pochodne arsenowe.
a) Chlorowane i bromowane arsiny szeregu tłuszczowego (związki nasycone).
b) Chlorowane i bromowane arsiny szeregu aromatycznego (zwykle używane jako sternity).
c) Cyanki arsenowe.
d) Chlorowane arsiny nienasycone. Grupa luizytu.
Z tych bardzo licznych środków rzeczywiście używano do celów bojowych tylko iperytu i związków arsenowych, z których luizyt otrzymany i wytwarzany w dużych ilościach już w końcu wojny, pozostał jednak nieużyty. Dla innych substancyj można ograniczyć się powyższemi wskazówkami, tem bardziej, że działanie ich jest mało zbadane, z wyjątkiem kantarydyny — środka bardzo drogiego i dlatego do celów bojowych nieużytecznego. Trzeba jednak zwrócić uwagę na to, że czynne substancje wielu środków roślinnych muszą być zaliczone do najczynniejszych trucizn skórnych. Tak np. toksikodendrol wywołuje zapalenie skóry już w dawce 0,00005, gdy słynny iperyt nie zawsze jest czynny w ilości jednej kropli 0,1% rozczynu, t. j. w dawce około 0,0005. Niemniej czynną zdaje się być kapsicyna, wywołująca natychmiast ból i parzenie skóry. W użyciu tych trucizn do celów bojowych przeszkodą nie do zwalczenia jest niemożliwość dostarczenia dostatecznych ich ilości.
Jak to łatwo jest zauważyć z rozpatrywania syntetycznych trucizn skórnych, znaczna ich ilość była używana także w charakterze lakrymatorów albo sternitów.
Trucizny, które będziemy rozpatrywali poniżej, są nieliczne. Najskuteczniejszą z nich jest iperyt, który prócz uszkodzeń skóry wywołuje bardzo poważne uszkodzenia narządów oddechowych, oczu, a następnie cały szereg zmian ogólnych.
Ponieważ celem używania tych trucizn, jako środków walki jest przedewszystkiem działanie na skórę, któremu nie mogą przeszkodzić żadne maski, grupę iperytu i grupę luizytu musimy wydzielić osobno, jako bojowe trucizny skórne.
Najważniejszym z tych środków bojowych jest bezwątpienia iperyt, który odegrał prawie rozstrzygającą rolę w ostatnich chwilach wojny światowej i w każdym razie w bardzo znacznym stopniu wpłynął na przewagę sprzymierzonych. Dlatego otrzymał on nazwę „króla gazów bojowych”.
Nazwa iperyt pochodzi od miejscowości Ypres we Francji, gdzie ten środek był użyty po raz pierwszy przez Niemców 12. VII. 1917 r. Naukowa nazwa odpowiednia do wzoru chemicznego jest siarczek chlorku etylowego albo chlorek siarczku dwuglykolowego. Chemiczny wzór jego jest — Cl.CH2CH2S.CH2CH2Cl. Z tego wzoru wynika, że jest on chlorowanym w pozycji ββ t. j. w drugim zkolei atomie C, licząc od atomu z siarką siarczkiem glikolu. Prócz tego istnieją związki αα ze wzorem CH3CHClS CHClCH3 i αβ — CCl.CH.2CH2S CHCl.CH3. Z tych związków pierwszemu brak zupełnie trujących właściwości iperytu, zaś drugi jest dwa razy od niego słabszym. Również znacznie słabsze jest działanie związku OH CH2CH2S CH2CH2Cl zawierającego tylko jeden atom chloru. Otrzymano również liczne pochodne iperytu i jego homologi (związki, w których zamiast etyleno-glikolu, użyto propyleno albo butylenoglikolu), więc — S.(CH2.CH2.CH2.Cl)2. i S.(CH2CH2CH2CH2Cl)2. Są one mniej więcej czynnemi tylko w tych wypadkach, gdzie istnieje grupa CH2CH2 S CH2CH2, którą proponowano nazwać rodnikiem toksofornym, mustarylem.
Odwrotnie dość czynną trucizną jest symetryczny siarczek dwuchlorku metylu ClCH2 SCH2 Cl. Jest on jednak raczej wyraźną trucizną oddechową, ponieważ wywołuje on, już w stosownie nieznacznych stężeniach, przekrwienie i zapalenie płuc. Anatomiczne zmiany w takich zatruciach są bardzo ciekawe. Skutkiem nawet słabych i krótkotrwałych zatruć jest wyraźne nagromadzenie leukocytów, tak w świetle pęcherzyków jak również w samej właśnie tkance płucnej. Działanie na skórę jest jeszcze mało zbadane, lecz zdaje się być słabsze od działania iperytu.
Do tegoż szeregu pochodnych należą też jeszcze całkiem niezbadane z punktu widzenia toksykologicznego inne produkty chlorowania siarczku metylu (CH3)2S mianowicie: CH.Cl2 S. CH3; CHCl2 S. CH2Cl; Cl3 S CH3; CCl3 SCH2Cl; CCl3 S.CHCl2 i nareszcie (CCl3)2 S z których ostatni jest dość stałym związkiem. Właściwości jego są bardzo podobne do właściwości symetrycznego siarczku dwuchlorometylu.
Przy działaniu tlenu, siarka w iperycie zmienia swoją wartościowość i z dwuwartościowej staje się cztero albo sześciowartościową. W taki sposób powstają sulfoxyd (ClCH2CH2)2 SO i sulfon iperytu (ClCH2CH2)2 SO2, rozpuszczalne w wodzie związki, o wiele mniej czynne niż iperyt. Takie utlenienie powstaje jednak tylko w użyciu najmocniejszych środków utleniających, mianowicie kwasu azotowego i nadmanganianu potasu. Powstaje ono też pod działaniem chloru albo kwasu podchlorawego. Tlen zawarty w powietrzu na iperyt prawie nie działa. Dlatego do zniszczenia iperytu i usunięcia go z terenu używano wapna blicharskiego.
Iperyt został przypadkowo otrzymany przez francuskiego chemika Gouthrie w latach 60-ch, a następnie dokładnie zbadany jeszcze w r. 1889 przez Wiktora Mayera, który podał sposób jego syntezy, użyty przez Niemców do celów technicznych. Sposób otrzymania według W. Meyera jest następujący.
Przez działanie kwasu podchlorawego na etylen (powstający z alkoholu i kwasu siarczanego przez usunięcie wody) otrzymano chlorohydrynę etylenoglykolu.
C2H5OH−H2O = C2H4
C2H4 + HClO = HOCH2CH2Cl
Przez działanie na chlorohydrynę glykolu siarczka sodu otrzymano siarczek etylenglykolu (tiodwuglykol)
Na2S + 2Cl CH2CH2CH = 2NaCl + S(CH2CH2OH)2
z którego dalej pod działaniem suchego HCl powstaje iperyt
S(CH2CH2OH)2 + 2HCl = S(CH2CH2Cl)2 + 2H2O
Teraz we Francji i w Stanach Zjednoczonych Ameryki używają innego prostszego sposobu: działania na etylen chlorku siarki S2Cl2. Otrzymany w taki sposób nieczysty przetwór był właśnie używany jako środek bojowy pod nazwą iperytu lub gazu musztardowego. Według pewnych danych (ze źródeł niemieckich) działa on nawet mocniej od czystego siarczku chloroetylu.
Pozbawiony zdolności do jakichkolwiek wyraźnych odczynów chemicznych, iperyt przedstawia znaczne trudności dla wykrycia jego obecności w powietrzu. Zapach jego jest mało wyraźny i nie różni się prawie od zapachu całego szeregu innych substancyj np. olejków gorczycznych. Najpewniejszym zabiegiem do ustalenia obecności śladów par iperytu w powietrzu jest odczyn Guinjarda, który polega na tworzeniu się z iperytu w obecności Na I nierozpuszczalnego w wodzie siarczku dwujodoetylu. Używano 30% rozczynu NaI w wodzie z domieszką CuSO4 jako katalizatora. 0,00025 iperytu wywołuje już wyraźne zmętnienie płynu. Dla ustalenia obecności iperytu w ubraniu i na powierzchni rozmaitych przedmiotów, najlepszym sposobem jest zmywanie go przy pomocy jakiegoś rozczynnika organicznego (benzyna, eter, alkohol) i następne doświadczenia na zwierzętach, wykonane zresztą pozostałą po wyparowaniu rozczynnika. Najczulszym objektem jest ucho królika, które podlega zapaleniu w razie obecności znikomych ilości iperytu.
Trującą właściwość iperytu, mianowicie jego działanie na narządy oddechowe ustalił jeszcze Mayer, którego asystent zatruł się i zachorował na zapalenie płuc. Dokładniej zbadał te właściwości Lebert w 1891 r. Obecnie iperyt ma olbrzymią literaturę, możliwie że najobszerniejszą ze wszystkich trucizn bojowych.
Iperyt, albo jak go nazywają Anglicy i Amerykanie „mustard gas“ — gaz gorczyczny, jest bezbarwnym oleistym płynem, mającym wyraźny, lecz mało charakterystyczny zapach chrzanu albo rośliny gorczycy. Płyn ten wrze w temperaturze 215 — 217°C, a około 14°C, zależnie od stopnia czystości, tworzy krystaliczną masę. Dlatego w czystym stanie iperyt nie może być używany do celów bojowych podczas zimna. Żeby zapobiec takiemu stygnięciu zamiast czystego iperytu używano jego rozczynów w nitrobenzolu, czterochlorku węgla, nitrobenzolu, chlorku benzylu, albo chloropikrynie. W wodzie jest on prawie nierozpuszczalny i powoli podlega hydrolizie, odszczepiając kwas solny. Ciężar gatunkowy jest równy 1,27 przy 15°C. Dzięki bardzo małemu napięciu powierzchniowemu, równemu 0,581, w porównaniu z wodą, iperyt rozpełza się bardzo łatwo po powierzchni, którą zrasza i trzyma się jej bardzo opornie, jak zresztą inne ciecze oleiste. Sam przez się ulega on zniszczeniu bardzo powoli. Wskutek tego zabrudzone iperytem przedmioty, jak laboratoryjne naczynia, odzież, amunicja, nawet ziemia i znajdująca się na niej roślinność mogą służyć za trwałe źródło zatruć w ciągu długiego czasu. Spotykano wypadki zatrucia iperytem powstałe u fermerów podczas pracy rolnej, po upływie całego roku od bombardowania danej miejscowości pociskami gazowemi.
Iperyt rozpuszcza się łatwo w tłuszczach, czem tłumaczy się jego wyraźny dermatropizm, występujący w obecności nawet niewielkiej ilości jego par w powietrzu (ciśnienie nasycone pary jest równe przy 20° tylko 0,06 mm Hg.), a po wprowadzeniu dożylnem niemniej wyraźny neurotropizm. Z właściwości tej wynikają zdolność do nagromadzenia się w skórze podczas długotrwałego działania słabych stężeń i wyraźny okres wylęgania w zatruciach.
Pierwsze objawy zatrucia — podrażnienie oczu i skóry dają się zauważyć zazwyczaj dopiero po upływie kilku godzin po wprowadzeniu trucizny do ustroju. Nawet przy bezpośredniem działaniu czystego iperytu na skórę człowieka pierwsze objawy zapalenia (zaczerwienienie) powstają dopiero po upływie 4 — 6 godzin.
Iperyt łatwo przenika przez skórę i wchłania się. Jednak najmniejsze stężenie czyli próg działania jest dość wysokie. Dla człowieka jest ono nie niższe od 0,1% alkoholowego rozczynu (w warunkach doświadczalnych). W zatruciach przez powietrze trzeba się liczyć z tem, że do nasycenia powietrza wystarczą bardzo małe ilości trucizny. Tak np. M3 powietrza nasyconego parą iperytu zawiera w temperaturze 14° zaledwie 0,345 g, w 22° — 0,719 g i w 39° — 2,98 g. Jednak wobec wyraźnego dermatropizmu i kumulatywnego działania tego środka wystarcza obecność najmniejszej ilości jego par i tylko okres wylęgania staje się jeszcze dłuższy. Według doświadczeń, wykonanych na psach granica wrażliwości jest 0,00005M3 (fosgen 0,6/M3, kwas pruski 0,1/M3). Pomimo takich właściwości trucizny jaskrawo występują znaczne wahania jej siły działania. Wogóle zwierzęta są mniej wrażliwe niż ludzie, z wyjątkiem znacznie (o 10 razy) wrażliwszych koni. Wrażliwość ludzi też jest niejednakowa, jak to wynika z następujących danych laboratorjum w Edgewood. Wobec 0,01% alkoholowego rozczynu mamy tylko 3,3% wrażliwych osób wśród białych i 0% wśród murzynów. Po użyciu 0,1% liczba wrażliwości dosięga 55,3% wśród białych i zaledwie 15% wśród murzynów. Wogóle, jak to zresztą zauważono dla całego szeregu innych trucizn i chorób skórnych, osobniki z mało zabarwioną skórą i jasnemi włosami są więcej wrażliwi niż bruneci. Dlatego jest bardzo możliwe, że wyraźne powiększenie pigmentacji dostępnych części skóry, np. ogorzałość bardzo podobna do słonecznej, która powstała wskutek dłuższego działania małych stężeń iperytu, jest jakby przystosowaniem się ochronnem. Trzeba zauważyć, że takie zabarwienie jest skutkiem działania wszystkich czynników promieniotwórczych (promieni ultrafioletowych, promieni radjum i Roentgena), dla których jest też charakterystycznym wyraźny okres wylęgania, znacznie dłuższy (kilkanaście dni) niż dla iperytu.
Treść działania iperytu na ustrój jest bardzo złożona i zależna zarówno od stężenia jak i od sposobu wprowadzenia.
Przedewszystkiem trzeba podkreślić, że iperyt, prócz bardzo poważnych zmian miejscowych, wywołuje cały szereg objawów ciężkiego zatrucia ogólnego i jest typową trucizną przemiany materji, wywołującą podniesienie się przemiany N. Losy jego w ustroju są jeszcze mało zbadane. Jest on prawdopodobnie wyjątkowo oporną substancją. Są pewne wskazówki, że w skórze może on być wykryty zarówno sposobami chemicznemi, jak też i biologicznemi (podrażnienie skóry u innego osobnika) nawet po upływie kilku dni. Rozkład jego (hidroliza) w warunkach istniejących w ustroju (temperatura 37° i prawie obojętny odczyn) musi przebiegać bardzo powoli i dlatego jakichkolwiek produktów rozkładu iperytu w wydzielinach jeszcze nie ustalono. Działanie jego na przemianę materji, jak również bardzo trudne gojenie oparzeń, zmusza nas do przypuszczenia, że działanie jego w ustroju jest długotrwałe i niełatwe do zrównoważenia. Prawdopodobne jest, że mamy tu do czynienia z działaniem wyłącznie cząsteczkowem t. j. niepołączonem z żadnemi zasadniczemi zmianami budowy chemicznej iperytu, podobnem do działania fosforu w stanie pierwiastkowym.
Zatrucie ustroju może nastąpić wskutek: 1) zatrucia przez skórę, 2) drogą oddechową i 3) drogą pokarmową. W warunkach doświadczeń laboratoryjnych mamy jeszcze wstrzykiwania podskórne i dożylne. Chociaż, dzięki swojej rozpuszczalności w tłuszczach iperyt zostaje zatrzymany przedewszystkiem przez komórki tkanek, z któremi się styka, wywołując zmiany miejscowe, niema wątpliwości, że ulega on również wchłanianiu. Według Warthina i Wellera wstrzykiwanie dożylne iperytu w dawce 0,0075 na kg wywołuje u królika śmierć po upływie 4 godzin. Według danych Flury i Wielanda 0,01 na kg zabija królika w 3 dni, 0,02 na kg w ciągu 36 godzin, 0,03 w ciągu 24 godzin po wstrzykiwaniu podskórnem. Dożylne wlewanie 0,0075 na kg nie dało śmiertelnego wyniku. W porównaniu z innemi truciznami o działaniu ogólnem iperyt jest mniej czynny niż np. strychnina (dawka 0,0002 na kg) albo kwas pruski (0,0003), ale jest więcej jadowity niż czad (s. d. 0,015) i dorównywa mniej więcej pod tym względem arszenikowi (0,008).
Z ogólnych objawów zatrucia zwrócić uwagę należy na biegunkę i głębokie uszkodzenia jelit, połączone ze zwyrodnieniem śluzowem nabłonka. Przemiana materji w chronicznem zatruciu iperytem wykazuje podniesienie przemiany azotowej jak w zatruciu przetworami gruczołu tarczowego. Zauważono wzmożenie ogólnego wydzielania azotu, amoniaku, kreatyny i kwasu fosforowego. Waga ciała prędko się zmniejsza.
O wiele ważniejszemi niż zmiany ogólne są uszkodzenia skóry, narządów oddechowych, a także oczu.
Zmiany skóry następują nawet w najmniejszych stężeniach iperytu w powietrzu i są szczególnie wyraźnie po bezpośredniem zetknięciu się z przedmiotami zabrudzonemi iperytem. Odzież z jakiegokolwiek materjału, skóra butów, nawet guma — nie przedstawiają dla iperytu żadnej przeszkody. Na pewien czas (do 400 min.) można uczynić materjał bawełniany albo wełniany nieprzenikliwym dla iperytu przez przepojenie mieszaniną składającą się z 85% smaru maszynowego (waseliny) i 15% oleju lnianego (Fries i West).
Zabezpieczyć się od oparzeń iperytowych można też przez używanie pewnych maści, które proponowano w czasie wojny. Niektóre z takich maści są istotnie w stanie uchronić skórę nawet w razie smarowania iperytem in substancja.
Najwięcej i najczęściej cierpią te części ciała, które, zdawałoby się, są najlepiej ochronione przez odzież, mianowicie organa płciowe, pachy, skóra między palcami nóg i t. p. Najłatwiej podlegają uszkodzeniom takie miejsca, które obfitują w gruczoły potowe i tłuszczowe i gdzie skóra jest cieńsza i delikatniejsza. W tych miejscach u jednostek nie dość czystych mamy zawsze najwięcej brudu przepojonego tłuszczem, martwego naskórka i kurzu, który nawet sam przez się wywołuje zwykle już pewne podrażnienie skóry. Niema takiego miejsca, które byłoby bezwględnie oporne na działanie iperytu. Bardzo wrażliwą jest skóra w tych miejscach, gdzie rosną włosy, których cebulki odkrywają łatwą drogę do przenikania trucizny do głębszych warstw naskórka.
Przebieg choroby w ogólnych zarysach przedstawia się w sposób następujący:
nie wcześniej niż po upływie kilku godzin po zatruciu, a w wielu wypadkach dopiero na drugi dzień, na miejscach działania trucizny powstają czerwone plamki, które zupełnie nie bolą, ale swędzą dotkliwie. Powstaje wyraźny obrzęk skóry.
U zwierząt następuje natychmiast martwica skóry, wrzody, albo, w razie głębokiej martwicy naskórka razem z górnemi warstwami skóry właściwej, zmartwiałe tkanki podlegają mumifikacji i wytwarzają twardy nieczuły puklerz, odpadający następnie, wskutek czego powstają duże i głębokie wrzody. Najwyraźniej zmiany takie są widocznie u konia. U człowieka mamy jeszcze jedno stadjum pośrednie — tworzenie się bąbli podobnych do powstających w drugim stopniu oparzenia. Z początku pęcherze te są bardzo małe i liczne, następnie łączą się one w stosownie niewielką ilość dużych bąbli.
Zwykle większe pęcherze są otoczone wiankiem mniejszych pęcherzyków. Po pęknięciu bąbli powstają wrzody rozmaitej głębokości aż do zupełnego zniszczenia skóry właściwej. Wrzody te, podobnie jak wrzody powstałe wskutek działania promieni Roentgena, goją się bardzo powoli i pozostawiają wyraźne blizny, które potem przybierają charakter blizn ściągających się i mogą stać się przyczyną ciężkich okaleczeń. Skóra w miejscu powstawania blizn w lżejszych stopniach uszkodzeń barwi się na ciemno, wskutek znacznej trwałości komórek barwnikowych i ich zdolności do rozrostu. W innych przypadkach takie ciemne zabarwienie występuje tylko na brzegach byłego wrzodu, zaś sama blizna pozostaje białą wskutek zupełnego zaniku komórek barwnikowych skóry.
Co do niebezpieczeństwa tych uszkodzeń skórnych, to nie różnią się one od innych oparzeń i wynik jest zależny od przestrzeni skóry uszkodzonej. Tak samo jak po zwykłych oparzeniach oparzenie obejmujące więcej niż 1/3 powierzchni ciała jest już niechybnie śmiertelne.
Podobne uszkodzenia powstają też na powiekach, bardzo czułych na obecność iperytu. Zabliźnienia wrzodów na powiekach powodują w swych skutkach przykre okaleczenia — podwinięcie albo odwinięcie powiek.
Co do samych oczu to spojówka i rogówka, nie zawierające tak znacznej ilości lipoidów jak naskórek, są stosunkowo mniej wrażliwe niż skóra. Dlatego ciężkie uszkodzenia oczu są zjawiskiem dość rzadkiem. Tem niemniej wyraźne zapalenie spojówki następuje już w stężeniu 0,005m/4. Ludzie mają spojówkę wrażliwszą od zwierząt; małpy i psy są wrażliwsze od królików. Po bezpośredniem wprowadzeniu do spojówki, w postaci rozczynu w eterze naftowym, iperyt wywołuje zmiany w oku już w ilości 1/500 mg. Dawka 0,5 mg jest bardzo niebezpieczna nawet dla zwierząt. Co do stężenia w powietrzu, to 1/20.000 wywołuje natychmiastowe zapalenie rogówki i spojówki. W zwykłych warunkach bojowych mamy tu dość długi okres wylęgania.
Według danych amerykańskich badaczy Yablick’a i Perrot’a liczby te są jeszcze mniejsze, mianowicie stężenie 0,0000005/m3 jest drażniące dla oczu, a 0,000001/m3 wywołuje już zmiany skórne.
Pierwszemi objawami uszkodzenia oka są przekrwienie i łzawienie, a następnie znaczny obrzęk spojówki (chemosis) i powiek. Rogówka, wskutek martwicy nabłonka, staje się nieprzezroczysta, a dalej w razie nacieczenia tkanki własnej — podobna do porcelany, skutkiem czego następuje zupełna ślepota. Spojówka ulega ropieniu, a w razie znaczniejszego zapalenia rogówki ropienie przenika do komory przedniej i powstaje tak zw. hypopyon. Dołączenie się następnego zakażenia drobnoustrojami prowadzi do ogólnego zapalenia gałki ocznej (Panophtalmitis) i zaniku oka. Zdarza się to jednak tylko w wyjątkowych wypadkach. Zwykle najgorszym wynikiem są blizny na rogówce i okaleczenie powiek. W nieznacznych stopniach zatrucia nawet zaczerwienienie spojówki nie rozpowszechnia się, a ogranicza się do wąskiej szpary na gałce ocznej, której nie ochraniają powieki przy otwartych oczach.
Objawy te znikają już w przeciągu kilku dni pod wpływem przemywania rozczynem dwuwęglanu sodowego. Zmiany powstające w narządach oddechowych są znacznie niebezpieczniejsze i powodują wogóle nieliczne śmiertelne wyniki zatrucia iperytem. Według amerykańskich danych statystycznych zatrucie iperytem daje nie więcej od 1% śmiertelnych wypadków. W zatruciu zwierząt mamy śmiertelne wyniki po użyciu 0,01 na kg podskórnie lub dożylnie, albo po wdychaniu trucizny znajdującej się w powietrzu.
Wskutek małej lotności iperytu stężenia ponad 0,5/M3 nawet w razie parowania nagrzanej trucizny są nieosiągalne. Ciśnienie pary iperytu pomiędzy 10° — 30° waha się od 0,04 — 0,09 mm Hg., tak, że zupełnie nasycone powietrze zawiera w tych temperaturach od 0,2/M3 do 0,5/M3, co oczywiście przedstawia najwyższe dosięgalne stężenia. Ale nawet w takich wyjątkowych warunkach ginie natychmiast tylko pewna część zatrutych zwierząt. W większej ilości wypadków śmierć następuje nie wcześniej niż po upływie kilku godzin. W zwykłych warunkach doświadczeń (w stężeniu 0,01/M3 — 0,03/M3) mamy pewien odsetek wyników śmiertelnych, następujących w przebiegu 2 — 11 dni po zatruciu prawie niezależnie od dawki, przeważnie wskutek zakaźnych powikłań w oskrzelach i płucach. Tylko w stężeniach najwyższych 0,1/M3 — 0,5/M3 pewne ciężkie objawy, wymioty, przyspieszony oddech, wolne tętno i wreszcie porażenie ośrodka oddechowego mogą być położone na karb bezpośredniego resorpcyjnego działania trucizny. Wszystkie zmiany noszą więc przedewszystkiem wyraźny miejscowy charakter.
Stosownie do właściwości iperytu, jako trucizny komórkowej, uszkodzenia obejmują przeważnie górne drogi oddechowe. Mamy tutaj głęboką martwicę błonki śluzowej, obfite powstawanie błon rzekomych i, jako zmiany następne, zniekształcające blizny w krtani i oskrzelach. W płucach powstaje wyraźna rozedma. Do tych zmian dołączają się podobne zmiany gardzieli, nadgłośni i jamy ustnej. Objawem tych anatomicznych uszkodzeń są ochrypłość aż do utraty głosu i natarczywy kaszel, często połączony z wymiotami. Następne powikłania, powstające wskutek zakażenia drobnoustrojami jamy ustnej, są też zwykłem zjawiskiem.
Treść działania trucizny i jej losy w ustroju nie są jeszcze dostatecznie wyjaśnione. Prawdopodobnie przetwarza się ona już w komórkach tkanki w znacznie mniej jadowity tlenek sulfinowy i sulfon chloroetylenu — (ClCH2)2SO i (ClCH2CH3)2SO2. (Sulfon na podstawie prac, zgłoszonych w Journ. of Am. Chem. Soc. jest jednak tak samo trujący jak iperyt).
Co się tyczy luizytu, a również innych pochodnych arsenowych, to trzeba zauważyć, iż po użyciu naskórnem trójchlorku arsenu AsCl3 (w nierozcieńczonym stanie), sulfocyanku kakodylu As(CH)2CNS (działanie zresztą dość słabe), dwuchlorku etyloarsiny, chlorku dwufenyloarsiny (działają nawet pary) i cyanku dwufenyloarsiny, mamy też wyraźne uszkodzenia skórne.
Najsilniejszą z tych trucizn skórnych jest jednak bezwątpienia luizyt, który dotychczas był uważany za ostatnie słowo toksykologji bojowej, chociaż co do właściwości trującej luizyt jak wogóle związki arsenowe, nie wyłączając nawet samego arseniaku AsH3, bynajmniej nie jest najmocniejszym środkiem trującym.
Brak nam jakichkolwiek danych co do działania luizytu na ludzi, ponieważ na wojnie nie był on jeszcze używany. Dlatego wszystko, co jest dotychczas wiadome, polega na doświadczeniach wykonanych na zwierzętach. Luizyt jest, również jak sternity, pochodnym chlorku arsenu. Przy działaniu na chlorek arsenu acetylenu powstają trzy związki: mianowicie jedno, dwu i trójchlorowinylochloroarsiny według następujących wzorów:
a) AsCl3 + C2H2 = AsCl2.CH:CHCl (luizyt) a luizyt,
b) AsCl3 + 2C2H2 = ASCl(CH:CHCl)2 b luizyt,
c) AsCl3 + 3C2H2 = As(CH:CH.Cl)3 c luizyt.
Zdolność mocnego działania na skórę posiada tylko pierwszy związek, drugi jest niezłym środkiem duszącym, a trzeci dość mocnym sternitem. Tych ostatnich właściwości nie jest pozbawiony i prawdziwy luizyt (pierwszy z tych trzech związków). Luizyt jest żółtawym płynem (bezbarwnym w czystym stanie), który zastyga w temperaturze 3 — 4°C w krystaliczną masę, mającym wysoki punkt wrzenia (93°C przy 26 mm Hg). W wodzie jest on nierozpuszczalny, lecz łatwo rozpuszcza się w tłuszczach i zwykłych rozczynnikach organicznych. Jest on dość lotną substancją i w temperaturze 20° może dosięgnąć stężenia aż 4/M3.
Związek jednochlorowinilo dwuchloroarsina zczasem rozkłada się w taki sposób, iż powstają mieszaniny chlorku arsenu i wszystkich trzech omówionych wyżej związków. Bezbarwny z początku płyn przybiera bronzowy kolor i staje się znacznie mniej jadowity. Wogóle w porównaniu z iperytem luizyt jest związkiem bardzo niestałym.
Działanie luizytu na małe laboratoryjne zwierzęta, np. szczury, jest rzeczywiście nadzwyczaj silne. Pod wpływem działania na skórę ogona szczura jednej kropelki tej substancji zwierzę ginie po 11/2 — 6 godzinach. Na większe zwierzęta luizyt działa znacznie łagodniej i nie powoduje śmierci nagłej. Śmiertelna dawka luizytu po zastrzyku podskórnym rozczynu w oleju oliwnym dosięga 0,01 na kg; dawka taka zabija w przeciągu 11/2 — 4 godzin. Najważniejszemi objawami zatrucia są: obfite ślinienie, szczególnie wyraźne u kotów, oraz znaczne podrażnienie oczu. Podobnie jak inne związki arsenowe luizyt posiada właściwości pneumotropizmu czyli powinowactwa do tkanki płucnej i wywołuje jej uszkodzenia nawet po dostarczeniu doskórnem. Przedewszystkiem mamy tu typowe objawy obrzęku płuc w pewnych wypadkach dość znacznego i miejscową rozedmę i niedodmę. Śmierć powstaje wskutek nagłego porażenia serca, którego mechanizm jest jeszcze zupełnie niewyjaśniony. Działanie na skórę zwierząt mało się różni od działania iperytu. Mamy takąż samą suchą zgorzelinę skóry i powoli gojące się wrzody. W pewnych wypadkach wskutek następnego zakażenia drobnoustrojami zgorzelina ta może przybrać charakter zgorzeliny szpitalnej i wywołać ogólne zakażenia krwi czyli posocznicę.
Po wdychaniu par luizytu mamy zwykłe uszkodzenia dróg oddechowych, zapalenie krtani, tchawicy i oskrzeli, połączone z martwicą śluzówki i następnem powstawaniem błon wrzekomych i ognisk zapalenia płuc typu zrazikowego. W razie następnego zakażenia powstają ropniki i zgorzelina płuc. Płyn obrzękowy zarówno po podskórnych zastrzykiwaniach, jak i po zatruciu przez powietrze ma zwykłe właściwości. W pewnych przypadkach nabiera on jednak właściwości podobnych do ustalonych dla zatruć fosgenem, t. j. wysięk ma ten sam skład co i plazma krwi. Jest to wskazówka znacznego uszkodzenia ścianek naczyń włoskowatych płuc. Takie zmiany w naczyniach włoskowatych zauważono również w innych narządach (jelita, nerki). Są one pospolite w zatruciach prawie wszystkiemi pochodnemi arsenowemi.
Działania luizytu na ustrój, o ile się nie bierze pod uwagę zatrucia arsenem wogóle, jest jeszcze zupełnie niewyjaśnione. U zwierząt, które wytrzymały pierwszy ostry okres zatrucia, nie zauważono dotychczas żadnych następnych zachorowań. Odwrotnie, udawało się nawet zaobserwować zwiększenie wagi ciała i liczby czerwonych krwinek, jak to bywa po używaniu terapeutycznem innych organicznych związków arsenu. Zmiany przemiany materji nie są jeszcze zbadane.
Co do losów luizytu w ustroju, to trzeba znowu podkreślić, że ścisłych danych brak. Z jego właściwości chemicznych wynika, że jest on, podobnie jak i chlorek arsenu, środkiem podlegającym dość łatwo hidrolizie. (Rurki, przez które pędzono mieszaninę pary luizytu z wilgotnem powietrzem, pokrywają się kwiatem kwasu arsenawego). Oprócz tego wiadomo, że luizyt w razie działania mocnego rozczynu KOH wytwarza acetylen.
Trucizny skórne, a przedewszystkiem takie, które w stanie pary albo pyłu zdolne są wywołać dość szybko następujące zmiany, mają bezwątpienia wielką przyszłość jako środki bojowe. Najskuteczniejsze będą prawdopodobnie trucizny wywołujące natychmiastowe podrażnienie czuciowych nerwów skóry, mianowicie środki typu kardolu i lakkolów, a również pewne syntetyczne związki, jak pochodne sulfo i izosulfocyanowe, oraz związki podobne do cedenitu. Są one bardzo mało zbadane.
Działanie ogólne, to jest zdolność przenikania do wewnętrznego środowiska organizmu i wywoływania zmian w odległych od miejsca dostarczenia częściach organizmu, stosownie do właściwości organotropicznych, stanowi cechę charakterystyczną prawie wszystkich trucizn, z wyjątkiem tych tylko żrących związków, które wytwarzają raczej uszkodzenia fizyczne niż zatrucia chemiczne. Pomimo tego podział trucizn na trucizny ogólne i miejscowe jest zupełnie usprawiedliwiony. Zasadnicza różnica pomiędzy temi dwiema grupami polega na tem, że prawdziwe trucizny ogólne są zupełnie pozbawione zdolności do działania miejscowego. W większości wypadków jednak i tutaj mamy do czynienia nie z bezwzględnemi, a ze względnemi właściwościami i stopień przewagi tych albo innych zmian jest przedewszystkiem zależny od stężenia i od dawki odpowiedniej trucizny.
Według działań trucizny typu ogólnego mogą być:
1. truciznami krwi;
2. truciznami organów i systemów organicznych — nerwowego, nerek, serca, naczyń krwionośnych i t. d. zależnie od charakteru organotropizmu;
3. truciznami przemiany materji.
Jako trucizny bojowe, których zadaniem jest wywoływanie natychmiastowych zmian, mogą być użyteczne trucizny krwi i trucizny posiadające wyraźny organotropizm do organów życiowych — serca i systemu nerwowego, a przedewszystkiem ośrodka oddechowego. Treść działania takich trucizn nie jest jeszcze znana. Prawdopodobnie mamy tu do czynienia albo z niszczeniem wewnątrzkomórkowych fermentów, albo z głębokiemi zmianami chemicznemi ośrodka micelli.
Z tego punktu widzenia trucizny używane do celów bojowych dla ich właściwości trujących, ale niezdolne do wywoływania miejscowych podrażnień, można rozdzielić na następujące grupy, do których trzeba będzie dodać jeszcze kilka środków dotychczas nieużywanych, ale mogących znaleźć zastosowanie w charakterze trucizn bojowych w przyszłości.
Wogóle wszystkie te trucizny należą już mniej więcej do archiwum toksykologji bojowej i używano ich tylko w okresach pierwszych prób poszukiwania odpowiednich środków. Wskutek delikatności swego działania i łatwości, z jaką daje się zapobiec zatruciu, jak i wskutek całego szeregu innych cech ujemnych, przeważna ich część nawet nie była ani razu użyta na polu bitwy.
wbrew Wyjątek stanowi tylko jeden kwas pruski w dość znacznych ilościach używany w wojsku rosyjskiem i francuskiem, ale podobno z dość małemi skutkami.
Trucizny proponowane oraz używane jako środki bojowe, należą do następujących grup chemicznych.
A. Trucizny krwi:
1. grupa czadu; sam czad CO, karbonyle niklu i żelaza;
2. grupa arseniaku.
B. Trucizny systemu nerwowego:
3. grupa siarkowodoru.
4. grupa kwasu pruskiego; nitryle i izonitryle.
Trucizny dotychczas nie używane do celów bojowych:
5. siarczek węgla,
6. środki narkotyczne;
7. lotne trucizny pochodzenia roślinnego.
Najważniejszą z tych grup jest bezwątpienia grupa czadu. Czad, czyli tlenek węgla CO mało nadaje się do użycia zarówno w postaci fal gazowych, jak też i do napełniania pocisków, jednakże żołnierz w czasie bitwy, a zwłaszcza artylerzysta i marynarz znajdują się w atmosferze zawierającej duże domieszki tego gazu.
Czad jest typowem jadem krwi, zupełnie pozbawionym jakiegokolwiek działania miejscowego.
Prócz działania na krew posiada on wyraźny neutropizm niedostatecznie jeszcze zbadany.
Pod względem fizyko-chemicznym tlenek węgla CO jest gazem bezbarwnym nie posiadającym ani smaku, ani zapachu, lżejszym od powietrza (c. g. 0,9674). Skrapla on się w krytycznej temperaturze 135,9°C pod ciśnieniem 36 atmosfer. Płynny czad wre przy 190°C, wobec tego napełnianie pocisków zgęszczonym czadem jest czynnością bardzo trudną i niebezpieczną, a skutki wybuchu takiego pocisku są nikłe z powodu lotności czadu i jego palności, dzięki której z tlenem powietrza wytwarza on mieszaninę wybuchową. W stanie czystym pali się on w powietrzu niebieskim płomieniem, tworząc kwas węglowy. W wodzie jest prawie nierozpuszczalny, (w temperaturze 100,0 wody pochłania 0,0328), lecz łatwo łączy się z rozczynem Cu2 Cl2 w kwasie solnym lub amoniaku, tworząc związek krystaliczny. Najlepszym środkiem unieszkodliwiającym czad jest tak zw. hopekalite mieszanina tlenków manganu, miedzi, kobaltu i srebra (MnO2 50%; CuO 30%; CoO 15% i Ag2O 5%). Mieszanina ta służy jako katalizator, przyśpieszający samorzutne spalanie się czadu w tlenie powietrza. Alkohol etylowy stosunkowo łatwo pochłania czad (7 razy lepiej niż woda).
Tlenek węgla jest dość mocnym środkiem odtleniającym (redukuje sole srebra mniej więcej tak samo jak aldehyd mrówczany albo kwas mrówczany). Z pewnemi metalami tworzy związki zwane karbonylami, jak np. karbonyle żelaza Fe(CO)4, Fe(CO)5, Fe2(CO)9, karbonyle niklu Ni(CO)4 i kobaltu Co(CO)3 i Co(CO)4. Są to przeważnie ciała stałe, z wyjątkiem płynnych Ni(CO)4 i Fe(CO)5. Z potasem daje potasowy związek heksaoksybenzolu K6C6O6, czyli pochodną aromatyczną. Karbonyle ciężkich metali, przeważnie niklu, mają też wyraźne właściwości trujące, lecz nieco odmienne od właściwości trujących samego czadu.
Najczulszym odczynnikiem na CO, oprócz hemoglobiny jest chlorek palladu PdCl2, który w obecności najmniejszych ilości CO barwi się na czarno, wskutek redukcji i powstawania koloidalnego palladu metalicznego.
Tlenek węgla jest przykładem związku dwuwartościowego węgla. C=O. O ile wiadomo, wszystkie połączenia węgla dwuwartościowego są mocnemi truciznami, jak to już mówiono z powodu chloropikryny.
Tlenek węgla łatwo powstaje w czystym stanie przez działanie kwasu siarczanego na szczawiany i mrówczany albo na odpowiednie kwasy według wzoru:
(COONa)2 + H2SO4 = CO + CO2 + H2O + Na2SO4
Do celów technicznych, np. do wyrabiania fosgenu, CO otrzymywano albo jako produkt poboczny przy wyrobie fosforu z fosforanów wapna, piasku i węgla w piecach elektrycznych (Ameryka), albo przez spalanie węgla (koksu) w specjalnych piecach w strumieniu czystego tlenu (przez redukcję zapomocą rozżarzonego węgla powstałego pierwotnie CO2, według wzoru CO2 + C = 2CO). Podobny odczyn, charakteryzujący niezupełne utlenienie węgla, powstaje w każdym piecu w razie niedostatecznego dopływu powietrza. Dlatego źle funkcjonujące piece są najpospolitszem źródłem zatruć czadem, zwłaszcza piece żelazne i żelazne rury dymowe, ponieważ przez rozgrzane do czerwoności żelazo czad przechodzi z łatwością.
Drugiem, niemniej zwykłem źródłem zaczadzeń w dużych miastach, jest gaz świetlny. Zwykły gaz węglowy zawiera 6 — 10% CO; gaz wodny aż do 41%; gaz generatorowy 34%, gaz dawsonowski 25%.
Wojna ostatnia dowiodła, że czad odgrywa również poważną rolę w powstawaniu zatruć podczas spalania materjałów wybuchowych. Takie wypadki tworzą specjalny rodzaj zatruć bojowych, zwany zatruciem gazami wybuchowemi. Oprócz tlenku węgla odgrywają tutaj poważną rolę również tlenki azotu. Powstałe przy spalaniu środków wybuchowych gazy mają następujący skład:
| %% | CO | CO2 | H2 | CH2 | N | H2S | NO2 |
| proch myśliwski | 3,6 — 9,3; | 27,5 — 61,24 | — | — | 11,42; | 1 — 2,3; | |
| pyroksylina | 46,8; | 16,8; | 20,4; | 1,3; | ? | — | do (9) |
| dynamit | 34; | 32,6; | 10; | 0,75; | ? | — | (48,2) |
| kwas pikrynowy | 61,05; | 3,46; | 13,18; | 1.02; | ? | — | ? |
| trotyl | 57,01; | 1,93; | 20,45; | — | ? | — | (30) |
Używany do zapalników piorunian rtęci rozkłada się również podczas wybuchu z powstaniem CO a mianowicie:
Dlatego zarówno działa własne, jak i pociski wroga są obfitem źródłem czadu. Zatrucia na polach walki w odpowiednich warunkach mogą powstawać nieświadomie bez używania jakichkolwiek trucizn specjalnych. Najniebezpieczniejszem miejscem pobytu z tego punktu widzenia są pewne części statków bojowych. Dlatego, żeby zapobiec takim zatruciom, proponowano dla marynarzy użycie masek z hopkalitem, których jedyną wadą jest ich kosztowność.
Losy CO w ustroju zwierzęcym nie są jeszcze dostatecznie zbadane. Ustalono, że większa jego część wydziela się zpowrotem przez płuca i że w ustroju nie powstają z niego znaczniejsze ilości CO2, ale na czem polegają odczyny pomiędzy składnikami układu nerwowego i czadu i jakie są stosunki ilościowe pomiędzy pochłoniętym a wydzielonym czadem jest jeszcze zagadnieniem nierozwiązanem. W każdym razie, poczynając od pewnego bardzo nieznacznego stężenia w powietrzu, mamy ściśle określone stosunki pomiędzy stężeniem a czasem powstawania pierwszych objawów zatrucia. Powstaje więc wyraźne nagromadzenie trucizny w organizmie. Pierwotnem miejscem nagromadzenia jest bezwątpienia hemoglobina krwi, z którą CO wstępuje w połączenie chemiczne, podobnie jak tlen i niektóre inne gazy. Przy analizie krwi trupów zmarłych wskutek zatrucia CO znaleziono 57 — 83% absolutnego nasycenia, co odpowiada około 0,02 trucizny na kg.
Ponieważ po znacznych utratach krwi, a również w pewnych chorobach połączonych z niedokrwistością, zawartość hemoglobiny we krwi może się zmniejszać do 20% normalnej zawartości (przeciętnie do 0,7% wagi ciała), nie wywołując jednak natychmiastowej śmierci, już z tych danych wynika, że zmiany krwi, mianowicie brak oksyhemoglobiny, nie są jedyną przyczyną trujących właściwości czadu.
Wrażliwość rozmaitych gatunków zwierząt na czad jest wogóle zależna od wytrzymałości tkanki względem braku tlenu. Zwierzęta pozbawione hemoglobiny we krwi, jak owady, raki, robaki, ślimaki, mogą żyć całe dnie w sztucznej atmosferze z 79% CO i 21% O2, przyczem są one również bardzo odporne na brak tlenu w powietrzu. Ryby, płazy i gady, dzięki zdolności chwilowego zawieszania przemiany materji i odpowiedniej niewrażliwości komórek na brak tlenu, są wogóle tysiąc razy odporniejsze od ssaków, wśród których znów najmniej wrażliwemi są te, które mogą zapadać w sen zimowy (np. jeże, świstaki i t. p.). Najczulszemi z kręgowców są ptaki, szczególnie drobne, jak np. wróble. Giną one w ciągu 3 kwadransów w obecności w powietrzu 0,12% CO, a w 4 — 5% umierają natychmiast. Dlatego mogą one służyć jako bardzo czuły odczynnik na obecność CO w powietrzu (mieszkaniach i zakładach).
Człowiek należy, prawdopodobnie wskutek wysoce rozwiniętego układu nerwowego, do zwierząt bardzo wrażliwych na czad. Próg działania według danych rozmaitych autorów waha się od 0,06% (w wyjątkowych wypadkach aż do 0,2%). Za niebezpieczne stężenie uznano 0,2 — 0,3%. Wyniki zatrucia zależą oczywiście, jak w działaniu trucizn nagromadzających się w ustroju wogóle, od czasu działania, więc od iloczynu ct.
Najważniejszym skutkiem obecności CO w powietrzu jest powstanie we krwi zamiast oksyhemoglobiny 200 razy stalszego związku karboksyhemoglobiny. Pod względem działania na krew tlenek węgla niewiele różni się od tlenu. Podobnie jak tlen nie niszczy on krwinek czerwonych i łączy się łatwiej z hemoglobiną zawartą we krwinkach niż z rozpuszczoną w osoczu i także dość łatwo usuwa się z niej przez rozszczepienie karboksyhemoglobiny w razie nieobecności CO w otaczającem powietrzu t. j. w próżni albo podczas przedmuchiwania biernych gazów, jak azot lub wodór. Dlatego w zatruciach tlenkiem węgla oddychanie czystem powietrzem prędko usuwa CO ze krwi, wskutek czego zawartość karboksyhemoglobiny stopniowo się obniża. U osób zatrutych czadem obecność CO we krwi można było ustalić zwykle w ciągu nie więcej niż 5 godzin po usunięciu z zatrutego środowiska. W pewnych wypadkach (prawdopodobnie w razie wewnętrznych krwotoków następujących zwykle w ciężkich zatruciach CO) obecność śladów CO można było jednak ustalić nawet po upływie 48 godzin po zatruciu. W doświadczeniach na zwierzętach ustalono, że ogólna masa CO usuwa się ze krwi bardzo szybko.
Tak np. u psa, u którego w czasie zatrucia zawartość CO była 7,8 cm3 na 100 cm3 krwi po upływie godziny pozostało tylko 2,3 cm3.
U kotów i królików po upływie 40 sekund po zatruciu krew nie zawierała już żadnych śladów CO. To samo zauważono w mniej ciężkich wypadkach zatrucia u ludzi.
Karboksyhemoglobina ma typowe widmo z dwiema smugami absorpcyjnemi, podobnemi do smug oksyhemoglobiny, ale leżącemi bliżej do siebie i nieco dalej od czerwonego końca widma. Najważniejszym objawem jest brak redukcji. Gdy z dwóch smug absorpcyjnych oksyhemoglobiny po dodaniu żółtego siarczku amonu do rozczynu krwi tworzy się wskutek redukcji jedna, szersza smuga redukowanej hemoglobiny, widmo karboksyhemoglobiny pozostaje niezmienione.
Reakcja ta umożliwia ustalenie jakościowe najmniejszych ilości CO we krwi i służy za podstawę do ilościowych badań spektrofotometrycznych. Dzięki takim badaniom ilościowym udało się ustalić bardzo ścisłe dane co do pochłaniania CO z powietrza w razie określonej jego w niem zawartości.
Z badań tych wiemy, że już w obecności 0,2% CO w powietrzu więcej niż 50% (59,5%) hemoglobiny łączy się z czadem, co jest już niebezpiecznem dla życia, a w stężeniu 2% nawet 93,7% obecnej ilości hemoglobiny znajduje się w stanie tego połączenia. Stosunek pomiędzy oksy- a karboksyhemoglobiną we krwi można obliczyć według wzoru 0,005 = vHV.h, gdzie 0,005 (1/200) jest stosunkiem pomiędzy zdolnością hemoglobiny do łączenia się z tlenem i z czadem, v zawartość czadu w powietrzu, V odpowiednia zawartość tlenu (w zwykłych warunkach 21% ciśnienia), H zawartość we krwi oksy i h karboksyhemoglobiny.
Na tem usunięciu tlenu, czyli obniżeniu zawartości we krwi oksyhemoglobiny i powstawaniu stopniowo wzrastających ilości karboksyhemoglobiny, opiera się klasyczna teorja działania czadu na ustrój.
Teorja ta została ustalona przez Lotara Mayer’a jeszcze w roku 1859 i jest uznana po dziś dzień przez większość toksykologów. Według tej teorji wszelkie objawy zatrucia CO są uzależnione od anoksemji — braku tlenu we krwi; rola CO polega na tymczasowem mniej albo więcej wyraźnem usunięciu hemoglobiny od udziału w procesie oddechu. Zgodnie z takim poglądem CO jest substancją niezdolną do jakiegokolwiek odczynu chemicznego w ustroju i wydziela się w tych samych ilościach, w których była ona pochłonięta. Taki sposób tłumaczenia jest oparty na całym szeregu prac doświadczalnych, których najważniejszym wynikiem jest ustalenie faktu, że ilość CO, zawartego w wydychanem powietrzu, mniej więcej odpowiada ilości pochłoniętego gazu. Jednak w najdoskonalszych doświadczeniach brakowało nie mniej niż 18% CO, które były zatrzymane albo zniszczone w ustroju.
Objawy zatrucia ostrego i bardzo wyraźne następne objawy chroniczne pozwalają jednak wątpić czy pogląd ten jest zupełnie słuszny. Przedewszystkiem zwraca na siebie uwagę fakt, że zawiesina z tkanki mózgu, pozbawiona krwi, pochłania CO z przedmuchiwanego przez nią powietrza, chociaż rozumie się w znacznie mniejszym stopniu niż krew. Drugim podobnym faktem jest zdolność do pochłaniania z powietrza wielkich ilości tego gazu, stwierdzona u pewnych owadów, mianowicie poczwarek chrabąszcza mącznego (Tenebrio molitor), dla których CO jest zupełnie obojętną substancją. 1000,0 takich robaków wywołuje po 24 godzinach zanik od 0.72 do 1,92 gr. CO, co odpowiada 0,749 — 2 litrów CO. Losy pochłoniętego CO są jeszcze zupełnie niezbadane.
Wśród objawów zatrucia czadem mamy objawy spowodowane jednorazowem zatruciem znacznemi (większemi od 0,1%) stężeniami CO — zatrucia ostre i szereg innych objawów w zatruciach chronicznych, wskutek działania nieznacznych ilości (0,20 — 0,05%) tej trucizny w ciągu długiego czasu.
Objawy ostrego zatrucia czadem są tak rozmaite i złożone, że o jakiejkolwiek dokładniejszej analizie ich, a nawet o szczegółowem wyliczeniu, niema mowy. Wogóle przebieg tych zatruć może być typowy i nietypowy. Nietypowe objawy mogą być poronnemi, recydującemi (ponownemi) i następnemi.
Typowy przebieg zatrucia przedstawia się w sposób następujący.
Pierwszemi skutkami lekkiego zatrucia, które mogą pozostać jedynemi objawami choroby, są: uczucie palenia w twarzy, ból głowy i w dołku — duszność, nudności i wymioty. Przytomność zostaje zachowana, ale wskutek dołączającego się zwykle objawu następnego okresu zatrucia — nagłego paraliżu mięśni, zatruci nie mogą w większości wypadków usunąć się sami z niebezpiecznego miejsca. Słabość mięśni wzrasta do zupełnego bezwładu (ataxia), skóra na twarzy przybiera jaskrawo czerwone zabarwienie z purpurowym odcieniem. Zabarwienie to jest skutkiem paraliżu naczyń.
Jest ono bardzo trwałe i może w wypadku uratowania pozostać na całe tygodnie. Utrata przytomności następuje w pewnych przypadkach nie wcześniej jak w godzinę od początku zatrucia śmiertelnego. Pierwszy okres jest bardzo podobny do ostrego zatrucia alkoholem. Następnym objawem bardzo ciężkiego zatrucia są silne ataki kurczowe, podobne do kurczów epileptycznych albo wywołanych zatruciem strychniną z tą jednak różnicą, że ataki takie są długotrwałe i przebiegają bez dłuższych przerw. Zależą one od podrażnienia kory mózgu spowodowanego brakiem tlenu, podobnie jak przy zaduszeniu.
Do tych objawów dołączają się dalej objawy asfiktyczne. Oddech staje się nieregularny, po kilku szybkich wdechach następuje kurczowy wydech, w płucach powstaje wyraźny obrzęk i zatruty zaczyna wydzielać z ust śluz i pianę. Zabarwienia twarzy staje się cyanotyczne, źrenice rozszerzają się, skóra staje się nieczuła, piana wyciekająca z ust staje się krwawa i zatruty kona wskutek paraliżu ośrodka oddechowego przy czynnem jeszcze sercu.
Jeżeli uda się uratować zatrutego, co jest możliwe nawet w ostatnim okresie zaduszenia (asphyxia), pozostaje w ciągu kilku dni znaczna słabość i gorączka. Gorączka ta nie jest koniecznym objawem, i więcej niż w połowie przypadków nie powstaje wcale. Powstawanie jej jest zupełnie zagadkowe.
Z nietypowych postaci zatruć najważniejszemi są najcięższe zatrucia, podobne do ataku apopleksji, z natychmiastową utratą przytomności i poronne postacie, kiedy, nawet w razie utraty przytomności w ciągu 30 — 40 sekund, wszystkie objawy zatrucia znikają po kilku godzinach działania świeżego powietrza. W zatruciu czadem na szczególną uwagę zasługują nawroty. W takich przypadkach po upływie kilku dni i nawet tygodni, w stanie pozornego wyzdrowienia, występują niebezpieczne objawy, których skutkiem może być śmierć. Zwykle są to ataki kurczowe, albo nagle występujące objawy porażenia ośrodków rdzenia przedłużonego.
Następnemi objawami ostrego zatrucia, jak również zatruć chronicznych są: wyraźna ogólna słabość, niedokrwistość i bardzo rozmaite, niepoddające się ścisłemu określeniu choroby układu nerwowego. W większości wypadków są to różne postacie porażenia i choroby umysłowe. Nawet w dość lekkich przypadkach może pozostać na długi czas osłabienie pamięci i plątanie słów.
Stąd wynika, że czad jest trucizną niebezpieczną i w pewnych warunkach, nie będąc prawdziwą trucizną bojową, może jednak odgrywać poważną rolę w działaniach wojennych.
Płynne karbonyle niklu i żelaza są jeszcze mało zbadane z punktu widzenia toksykologicznego, chociaż były już niejeden raz proponowane do celów bojowych. Związki te powstają dość łatwo przez przepuszczanie CO przez nagrzane proszki tych metali. Najlepiej znany jest karbonyl niklowy Ni(CO)4. Powstaje on już w temperaturze 30 — 50°C, a w 70° rozkłada się znowu, wybuchając dość silnie.
W ustroju rozkład odbywa się bardzo powoli. Jadowitość tego związku nie może być tłumaczona jako zatrucie tworzącym się stopniowo w ustroju CO, chociaż obecność tlenku węgla we krwi była z pewnością ustalona.
Objawy zatrucia są zupełnie inne i rozwijają się bardzo powoli: są to postępowe porażenia ośrodkowe, znaczne obniżenie ciepłoty ciała, wskutek obniżenia wytwarzania ciepła w ustroju obniżenie przemiany materji i znaczny stopień cukromoczu (glikozurji). Jadowitość karbonylu niklu jest dość znaczna. Obecność 0,5% jego par w powietrzu wywołuje już poważne zatrucie. Po wprowadzeniu dożylnem zabija on króliki w dawce 0,1 na kg w ciągu 1/2 — 1 godziny; psy w dawce 0.03 na kg w ciągu godziny. Dotychczas brak wiadomości o śmiertelnych zatruciach ludzi: lekkie postacie zatrucia są podobne do działania czadu.
Drugą grupę trucizn pozbawionych działania miejscowego tworzą arseniak i arsiny. Wręcz przeciwnie do mocno drażniących i żrących pochodnych chlorowcowych (sternitów) arseniak i jego pochodne, zawierające zamiast wodoru rodniki alkylowe, więc mające wzory: AsH2R), AsH.R2 i AsR3, są gazami, mającemi wstrętny i przenikliwy zapach podobny do zapachu czosnku, lecz wogóle nie wywołującemi takich zmian komórkowych jak zwyrodnienia i martwice. Arseniak jest trucizną krwi i ogólnej przemiany materji. Związki z rodnikami alkylowemi (arsiny) działają, o ile wiadomo w takiż sam sposób jak AsH3. Są one wogóle jeszcze mało zbadane. Ciekawem jest, że pewny związek aromatyczny, trójfenyloarsina (C6H5)3As jest zupełnie obojętną substancją, niezdolną do rozkładu w ustroju zwierzęcym (Kobert).
Pod względem fizyko-chemicznym arseniak jest bezbarwnym, ciężkim (c.g. 2,72) gazem, który w temperaturze 55° i ciśnieniu 1 atm. staje się płynnym a w temperaturze 119°C stałym ciałem. Jest on łatwopalny; pali się błękitnym płomieniem, tworząc As2O3. Podczas przepuszczania prądu powietrza zawierającego AsH3 przez rozczyny soli rtęci, miedzi albo srebra, powstaje czarny osad arsenidów tych metali — 3HgCl2 + 2AsH = As2Hg3 + 6HCl. Przy nagrzewaniu rozkłada się on, tworząc na zimnych powierzchniach osad (lustro) metalowego As. (Sposób Marsza dla ustalenia obecności As). W małych ilościach powstaje on podczas otrzymywania wodoru z kwasów albo metali (Zn, Fe), zawierających arsen jako zanieczyszczenie. Dzięki temu śmiertelne zatrucia powstawały w pewnych wypadkach podczas napełniania wodorem balonów napowietrznych. Ponieważ takie balony odgrywają teraz poważną rolę w działaniach wojennych, trzeba pamiętać o możności tych zatruć w wojsku.
Drugiem źródłem zatrucia były farby używane do tapet w mieszkaniach, zawierające arsen. W razie dostatecznej wilgoci na tapetach rozwija się pewien rodzaj pleśni (Penicillium brevicaule), która rozkłada arszenik i sole arsenowe z powstaniem jadowitego, cuchnącego czosnkiem gazu. Teraz jest już ustalone, że gaz ten nie jest arseniakiem, lecz jego pochodnym, mianowicie etyloarsiną C2H5AsH2. W zupełnie czystym stanie arsenowodór może być otrzymany z arsenidów, połączeń As z metalami. Takie związki powstają bądźto przez bezpośrednie stapianie metalicznego arsenu z odpowiedniemi metalami, bądź przez odtlenienie soli kwasu arsenowego węglem, w wysokiej temperaturze, jak np. Ca3(AsO4)2 + 8C = Ca3As2 + 8CO.
Przez działanie kwasów na arsenidy powstaje dość czysty arsenowodór Ca3As2 + 6HCl = 3CaCl2 + 2AsH3.
Arsenid wapnia rozkłada się powoli nawet pod działaniem wody, według wzoru Ca3As2 + 6H2O = 2AsH3 + 3Ca(OH)2. Arsenid wapnia był proponowany w czasie wojny jako środek bojowy. Otrzymywano go albo przez odtlenienie arsenianu wapna Ca3(AsO4)2 albo przez działanie arsenu na węglik wapnia CaC2, albo też przez nagrzewanie mieszaniny arszeniku, węgla i wapna. Dwa ostatnie sposoby wymagają temperatury pieca elektrycznego.
Jak to można wnioskować z działania na ustrój, arseniak, pomimo swej nadzwyczajnej jadowitości, mało nadaje się do użycia jako środek bojowy w zwykłem znaczeniu tego wyrazu.
Trujące właściwości arseniaku są znaczne. Według Lehmana, który dobrze zbadał ten związek z punktu widzenia higjeny fabrycznej, mamy takie dane.
Arseniak zabija koty po działaniu 1 — 11/2 godziny w stężeniu 0,2/M3, albo w przeciągu 3 godzin w stężeniu 0,1/M3. 0,07/M3 wywołuje ciężką chorobę. Francuscy autorowie zaliczają jednak arseniak do słabszych trucizn, znacznie mniej zabójczych niż fosgen, pality i kwas pruski.
Co do działania na ludzi — to istnieje przykład niezwykłej napastliwości tej trucizny. Chemik Gehlen, wynalazca tego związku, zmarł po dziewięciu dniach ciężkiej choroby wskutek zatrucia kilkoma miligramami AsH3.
Zatrucie arseniakiem występuje zwykle w sposób następujący.
Po upływie znacznego okresu czasu, nie mniej niż kilka godzin po zatruciu następują ogólne uczucie słabości, nudności, wymioty, dreszcze i ból głowy. W najlżejszych przypadkach wszystko może się na tem tylko skończyć i po kilku dniach następuje całkowite wyzdrowienie, jednak w cięższych przypadkach po upływie kilku godzin mocz staje się krwawym, słabość szybko wzrasta, dreszcze przybierają charakter wstrząsających, chory traci przytomność, wymioty nie ustają, wyrzucone masy zawierają prócz pokarmu żółć, a czasem nawet krew, a odżywianie staje się niemożliwe z powodu tych wymiotów. Liczba krwinek czerwonych i zawartość hemoglobiny spada aż do 1/6 normy. Powstają bóle w nerkach i żołądku, oraz w wątrobie i śledzionie, które są znacznie powiększone. Od drugiego dnia daje się zauważyć wzrastająca stopniowo żółtaczka. Barwniki żółciowe zabarwiają wszystkie tkanki i pojawiają się razem z białkiem w dużej ilości w moczu, którego ilość jest znacznie zmniejszona. Pomimo braku sił, chory jest bardzo niespokojny i podniecony, wszystkie te objawy po pewnym czasie w przypadkach, które się kończą wyzdrowieniem, stopniowo stają się mniej wyraźne i w ciągu kilku tygodni znikają zupełnie. Najdłużej trwa białkomocz.
W śmiertelnych przypadkach do powyższych objawów dołącza się odurzenie, bredzenie, ogólny obrzęk, skurcze. Ilość moczu szybko się zmniejsza aż do bezmoczu, czynność serca i płuc staje się niewystarczająca i około 9 dnia po zatruciu chory kona, prawdopodobnie wskutek powstania mocznicy.
W znaczniejszych stężeniach od 0,5/M3 arseniak działa natychmiast, zabijając małe zwierzęta prawie momentalnie. Ponieważ takie zabójcze działanie zauważono zarówno w stosunku do posiadających krwinki kręgowców, jak i do zwierząt pozbawionych hemoglobiny, jak owady, to musimy wnioskować, że arseniak posiada właściwości podobne do kwasu pruskiego t. j. że stanowi on truciznę zaczynów albo wogóle truciznę zarodzi.
W mniejszych stężeniach działanie trucizny polega na powstaniu wyraźnej hemolizy. Czy mamy tu skutki działania AsH3 na lipoidy krwinek, czy ta hemoliza ma inne źródło, tego jeszcze ściśle nie ustalono. Wiadomo jest tylko, że hemoliza przy działaniu AsH jest połączona z powstaniem wewnątrz krwinek methemoglobiny, oraz, że w ustroju tworzy się z AsH3 kwas arsenawy As2O3. Na tej podstawie polega teorja Meissnera-Makenzego, według której mamy istotnie do czynienia z hemolizą wywołaną przez kwasy. Jednak ani sam kwas arsenawy, ani jego sole, bardziej wybitnej właściwości hemolitycznej nie posiadają.
Działanie AsH3, jako środka wywołującego hemolizę, jest bardzo wyraźne. W zatruciach liczba krwinek szybko spada aż do 11/2 — 2 miljonów. Taka niedokrwistość już sama przez się może stać się niebezpieczną. Hemoliza jest przyczyną wszystkich dalszych zmian mianowicie uszkodzenia nerek, żółtaczki i następnej pigmentacji narządów hemosideryną, barwnikiem powstałym z rozkładu hemoglobiny, i zawierającym żelazo; pigmentacja ta może stać się bardzo wyraźna. Dlatego większa ilość badaczy tłumaczy śmiertelne działanie AsH3 wyłącznie jako skutek tej hemolizy, co prawdopodobnie nie jest zupełnie słuszne, gdy się przyjmie pod uwagę natychmiastowe działanie arseniaku, który może zabić wcześniej niż powstanie jakakolwiek hemoliza. Ciekawy jest również brak znaczniejszych uszkodzeń anatomicznych nerki pomimo powstawania śmiertelnej mocznicy. Zmiany nabłonka nerki nie różnią się od znalezionych w zatruciu innemi truciznami hemolitycznemi.
Do toksykologicznej grupy arseniaku należą też jeszcze dwa gazy SbH3 i PH3 — antymonowodór i fosforowodór, które jednak nie były używane w czasie wojny światowej. Mają one jednak wyraźne właściwości trujące. Antymonowodór jest ze wszystkich względów bardzo podobny do arseniaku, lecz jest znacznie mniej czynny, natomiast działanie fosforowodoru różni się zasadniczo, ponieważ nie wywołuje on żadnej hemolizy.
Fosforowodór jest zwykłem cuchnącem zanieczyszczeniem acetylenu, powstałego z węglika wapna (karbidu). Ponieważ acetylen jest używany jako świetlny gaz do samochodów, a często i wagonów, należy przeto zwrócić uwagę na dość znaczną jadowitość tej domieszki. Pobyt w ciągu 21/2 godzin w powietrzu obciążonem 20/M3 PH3 napewno zabija zwierzę (kota).
Dla człowieka stężenie 10/M3 jest już niebezpieczne. Objawy zatrucia są mało charakterystyczne i wogóle podobne do początkowych objawów zatrucia arseniakiem — słabość, szum w uszach, ból w dołku, dreszcze. Na sekcjach nie zauważono żadnych typowych zmian. Fosforowodór jest jak i sam fosfór typową trucizną przemiany materji, którą znacznie obniża, wywołując równocześnie toksyczny rozkład białka.
Najważniejszą cechą trucizn tej grupy jest ich działanie na krew, które nie było stwierdzone, o ile można sądzić według dotychczasowych obserwacyj, tylko dla fosforowodoru; zresztą fosforowodoru nie zaliczamy do środków bojowych. Dla grupy czadu podstawą działania na krew jest zdolność do łączenia się z hemoglobiną, dla arseniaku — jego właściwości hemolityczne. Zmiany we krwi powstają stopniowo i powoli, a objawy zatrucia stają się dostatecznie wyraźne nie wcześniej, jak po upływie kilkugodzinnego okresu wylęgania. Działanie natychmiastowe obserwowano tylko w stężeniach znacznych, trudno dosięgalnych w praktyce. Są to trucizny ze zdradzieckiem, tajemniczem działaniem. Zatruty zwykle nie jest w stanie zauważyć niebezpieczeństwa, które mu grozi.
Wskutek tego arseniak, jakkolwiek mógłby być bardzo użyteczny do niszczenia wroga, jednak w zwykłem znaczeniu tego słowa środkiem bojowym być prawdopodobnie nie może, ponieważ, po pierwsze nie posiada zupełnie natychmiastowego napastliwego działania, a po drugie jako stały gaz o niskiej temperaturze wrzenia (-51°C) jest tak samo niewygodny do napełniania pocisków, jak i czad. Do tego trzeba dodać, że arseniak łatwo się spala podczas wybuchu pocisków, tworząc zwykły arszenik (As2O3) i że otrzymanie zarówno samego arseniaku w czystym stanie jak i arsenidów jest bardzo niebezpiecznem zadaniem dla robotników.
Trzecią grupą środków o działaniu ogólnem jest grupa siarkowodoru. Należą do niej z punktu widzenia toksykologicznego prócz siarkowodoru także pewne związki organiczne, jego pochodne, jak np. merkaptany RHS i tioetery R2S, a również selenowodór SeH2 i tellurodowór TeH2.
Z trucizn tych najmocniejszy jest prawdopodobnie selenowodór, nadzwyczaj cuchnący, ciężki gaz, który niewiele ustępuje w jadowitości arseniakowi. Organiczne pochodne siarkowodoru, mające znaczniejsze od niego właściwości drażniące, szczególnie zaś tioetery, są mniej czynnemi truciznami układu nerwowego. Pewne praktyczne znaczenie jako środek bojowy posiada pomiędzy niemi tylko jeden siarkowodór, który był dość dokładnie zbadany w tym kierunku w pierwszych okresach wojny gazowej, zarówno we Francji jak i w Anglji.
Jadowitość jego, chociaż dość znaczna w zamkniętej przestrzeni, okazała się niewystarczająca w warunkach bojowych, zarówno w formie fal gazowych jak przy napełnianiu pocisków stężonym, płynnym H2S. Siarkowodór łatwo się pali i wytwarza z powietrzem mieszaniny wybuchowe. Podczas spalania powstaje mało czynny SO2. W warunkach życia codziennego, zarówno w czasie pokoju jak i na wojnie, jest on mniej trujący niż czad.
Siarkowodór powstaje w znacznych ilościach przy gniciu materjałów zawierających białko i jest dlatego stałym składnikiem gazów, nagromadzających się w ustępach i rurach kanalizacyjnych (innemi składnikami tych gazów są H2, CO2, CH4, NH2 i PH3). Podczas prac asenizacyjnych wypadki niebiezpiecznych zatruć H2S zdarzają się dość często, lecz nagła utrata przytomności, spostrzegana w tych warunkach, jest raczej skutkiem działania CO2. Ponieważ H2S jest zwykłem odczynnikiem w pracach analitycznych możliwe są też zatrucia laboratoryjne. Ciekawem jest, że po pewnym okresie stosunkowej niewrażliwości na działanie H2S, stopniowo powstaje coś w rodzaju objawów anafilaktycznych. Tacy ludzie chorują bardzo ciężko nawet po działaniu stężeń przeciętnie zupełnie obojętnych.
Stopień jadowitości H2S w warunkach bojowych okazał się nieznaczny. Podczas, gdy fosgen i kwas pruski są bezwzględnie zabójczemi środkami nawet w stężeniach 0,1 lub 0,2 na M3, dla H2S, według wskazówek Lehmana, trzeba nie mniej od 1 — 1,8 na M3, a według danych innych autorów trująca właściwość tego środka jest jeszcze mniejsza, a mianowicie występuje dopiero w stężeniach ponad 2/M3, zaś natychmiastową śmierć wywołuje on tylko w stężeniu 3,5/M3. Podczas długotrwającego działania zauważono u ludzi zatrucia w stężeniach wyższych od 0,05 V % = 0,8/M3. Trzeba zwrócić uwagę, że dla H2S typowe jest nagłe przejście od stężenia nie wywołującego poważnych objawów do tych, które zabijają natychmiast wskutek paraliżu ośrodka oddechowego, co przypomina poniekąd kwas pruski. Granica ta waha się około 2/M3.
Co do właściwości fizyko-chemicznych to siarkowodór jest gazem bezbarwnym, mającym słaby, ale bardzo nieprzyjemny smak i wstrętny zapach, podobny do zapachu zgniłych jaj (jeszcze gorzej cuchną selenowodór i telurowodór). Jest on nieco cięższy od powietrza (c. g. 1,18), skrapla się pod ciśnieniem 1 atmosfery w temperaturze -61,6°C, a przy -86° zestala się. Dość łatwo rozpuszcza się w wodzie (1 obj. H2O pochłania w temperaturze 15° 3,50 obj. H2S).
Kwasy mineralne w większości wypadków rozkładają siarkowodór z wydzielaniem siarki. Z zasadami tworzy on siarczki, a przy nadmiernej ilości H2S, — wielosiarczki. Wielosiarczki stanowią oleiste płyny o wzorach H2S2, H2S3, które pod działaniem zasad rozkładają się nadzwyczaj łatwo z wydzielaniem siarki i H2S. Wielosiarczki były też proponowane do celów bojowych. W stężeniach czynnych H2S ma wyraźne właściwości drażniące i wywołuje nieżyt gardzieli i zapalenia spojówki, a długotrwałe działanie powoduje zapalenie oskrzeli i płuc. Objawów ze strony układu nerwowego w takich stężeniach nie zauważono. Charakterystycznem jest, że siarkowodór zupełnie nie posiada właściwości gazu niewdychalnego, pomimo tak wyraźnego działania na drogi oddechowe. Merkaptany, a przedewszystkiem tioetery posiadają wyraźniejsze właściwości drażniące, a tioetery nienasyconych rodników są jednemi z najczynniejszych lakrymatorów.
Objawy zatrucia ogólnego mogą powstać nagle niemal bezpośrednio po działaniu odpowiedniego stężenia siarkowodoru. Dlatego więc siarkowodór zalicza się do gazów o działaniu ogólnem. Symptomy zatrucia — zawrót głowy, nudności, wymioty, nagła utrata przytomności, skurcze i śmierć.
Tylko w największych stężeniach, o wiele znaczniejszych niż te, które są niezbędne do wywoływania porażenia ośrodka oddechowego, mamy też odpowiednie zmiany składu krwi — tworzenie się tak zwanej sulfhemoglobiny. Dlatego w warunkach zatrucia ustroju żywego związek ten nigdy nie powstaje i otrzymano go tylko przez działanie H2S na rozczyn krwi in vitro.
Ze względu na omówione właściwości działania, H2S stanowi swego rodzaju przejście od trucizn krwi do trucizn układu nerwowego. Drażniące właściwości jego mają drugorzędne znaczenie.
Ostatnią grupą wśród trucizn o działaniu ogólnem jest grupa związków cyanowych i izocyanowych. Z całego szeregu, należących do tej grupy ciał jeden tylko cyanowodór czyli kwas pruski posiada znaczenie środka bojowego.
Używany przez Niemców w pociskach (Nr. 12) chlorek feniloizokarbilaminy wykazał wyraźnie właściwości drażniące; porażenia charakteru ogólnego w takim sposobie użycia nie były wyraźne. Prawdopodobnie nie różnią się one od działania ogólnego innych karbilaminów.
Z punktu widzenia chemicznego są to związki rodnika C ⋮ N albo N ⁞ C t. j. trój albo pięciowartościowego azotu, względnie dwu lub cztero wartościowego węgla połączonego z azotem. Związki pierwszego rodzaju (nitryle albo cyanki) są wogóle czynniejszemi truciznami niż drugiego (izocjanki, izonitryle albo karbilaminy). Rodnik CN łatwo się polimeryzuje, tworząc gaz cyan i jego polimery CN−CN, a z rodnikami alkoholowemi tworzy on nitryle. Nitryle można też rozpatrywać jako organiczne kwasy, w których grupa karboksylowa jest zastąpiona przez rodnik CN. Według tego kwas pruski HCN jest formonitrylem (nitrylem kwasu mrówczanego), CH3 CN albo cyanek metylu jest acetonitrylem, C6H5CN czyli cyanek fenilu jest benzonitrylem i t. d. Nitryle są wogóle tem skuteczniejszemi truciznami, im mniejszą jest grupa połączona z CN. Dlatego najjadowitszym z nitrylów jest bezwątpienia kwas pruski.
Rodnik CN wstępuje również w ścisłe połączenia z siarką tworząc rodnik rodanowy i z metalami grupy żelaza — żelazem, kobaltem i niklem, tworząc dwa szeregi rodników zespolonych typu ’’’’ Fe Cy6 lub ’’’ Fe Cy6. Najlepiej są znane związki z żelazem — żelazo i żelazocyanki. (Zdolność do tworzenia jonów zespolonych z kobaltem i niklem wyzyskiwano do pewnego rodzaju masek ochronnych przeciw HCN). Rodanki są mało czynnemi truciznami, a żelazo i żelazocjanki są trującemi tylko po wprowadzeniu drogą pokarmową; w tych warunkach rozkładają się one z powstawaniem kwasu pruskiego pod wpływem HCl soku żołądkowego. Wstrzykiwanie tych związków dożylnie jest zupełnie obojętne.
Tylko właściwości jednego z tych związków, a mianowicie kwasu pruskiego omówimy szczegółowo, ponieważ w początku wojny światowej odgrywał on dość znaczną rolę we Francji (pod nazwą „forestite“) jak również w Rosji i w Austrji.
W czystym stanie kwas pruski HCN jest bezbarwnym płynem bardzo niestałym, łatwo ulegającym działaniu różnych odczynników, a ponadto skłonnym do polimeryzacji, wrzącym przy 26,1° a więc bardzo lotnym. Jest on łatwo rozpuszczalny w wodzie i łatwo daje się zobojętnić amoniakiem i zasadami. W stanie stężonym zmieszany z powietrzem łatwo się spala. Para HNC szybko dyfunduje i rozprasza się, oraz stopniowo zobojętnia w otoczeniu. Typowy zapach gorzkich migdałów jest właściwością tylko rozcieńczonych par kwasu pruskiego. W znaczniejszych, chociaż jeszcze nie zabójczych stężeniach ma on nieprzyjemny zapach podobny do zapachu pluskiew.
Kwas pruski bardzo łatwo ulega różnym przemianom chemicznym, wytwarzając cały szereg jeszcze nie dość zbadanych, przeważnie obojętnych z punktu widzenia toksykologicznego, substancyj. Dlatego do HCN, jako środka bojowego, dodawano zwykle ochronne, zapobiegające rozkładowi, domieszki: chlorek arsenu, chloroform, chlorek cyny. Taką złożoną mieszaniną jest np. używany przez Francuzów „vincennite”. Chociaż we Francji, jak również w Rosji, używano dość znacznych ilości tego środka, jednak skutki działania, według oceny Niemców, nie były zadowalające.
Jadowitość kwasu pruskiego jest większa niż wszystkich znanych trucizn bojowych. Podlega on wszechstronnemu wchłanianiu, w pewnym stopniu nawet przez nieuszkodzoną skórę. Według istniejących danych próg bezwzględnego śmiertelnego stężenia dla psów i królików w warunkach doświadczeń w komorze gazowej (oddychanie) leży poniżej 0,1/M3. Już 0,05/M3 wywołuje niebezpieczne objawy po działaniu w ciągu 4 — 5 godzin.
W razie wprowadzenia do krwioobiegu, podskórnie albo w jakikolwiek inny sposób, dawka śmiertelna dla ludzi jest 0,06 (0,001 na kg). Zwierzęta są nieco odporniejsze. Pies, kot, królik potrzebują prawie takiej samej dawki 0,001 — 0,005 na kg. Pewne gatunki zwierząt są wyjątkowo oporne, mianowicie jeże i muły.
HCN zabija wszystkie zwierzęta i działa nawet na rośliny, wstrzymując kiełkowanie nasion. Działanie jego jest dość powikłane i składa się z następujących odczynów.
Jako typowy jad zaczynów kwas pruski działa zabójczo na żywą zarodź w większych dawkach zabijając ją, w mniejszych zatrzymując przemianę materji, a przedewszystkiem proces utleniania i rozkładu nadtlenków (zaczyn katalizy). Dlatego w układzie nerwowym z początku następuje krótkotrwałe podrażnienie, a następnie porażenie. Jednocześnie brak redukcji hemoglobiny powoduje, że krew żylna przybiera barwę krwi tętnicznej, a z moczem wydzielają się duże ilości kwasów organicznych (wskazujące na znaczną acidozę) i cukru gronowego.
Mięśnie, łącznie z mięśniem serca, są znacznie odporniejsze.
Dlatego śmierć następuje podczas napadów kurczowych, a serce jest jeszcze przez pewien czas czynne, wówczas gdy nastąpiło już zupełne porażenie ośrodka oddechowego.
Przez działanie HCN na hemoglobinę wytwarza się w odpowiednich warunkach połączenie, zwane cyanohemoglobiną, posiadające charakterystyczną smugę absorpcyjną w zielonej części widma. W żywym ustroju powstania tego związku nie zauważono.
W zatruciach środkami tej grupy mamy, zależnie od sposobu używania trucizny i wielkości dawki względnie stężenia, następujące postacie działania.
1. Osobliwą zmianę wrażliwości skóry (tak zw. anaesthesia dolorosa), ból w miejscu powstania działania trucizny i niewrażliwość tego miejsca na inne podrażnienia. Zjawisko to jest wyraźniejsze po działaniu cyanu niż kwasu pruskiego i nitrylów.
2. Kurcze, które są skutkiem podrażnienia kory mózgowej.
Potem następuje ogólne porażenie, które dotyczy kolejno kory mózgu, ośrodka nerwu błędnego, ośrodka regulacji ciepła, ośrodka naczynio-ruchowego i wkońcu ośrodka oddechowego. Pod wpływem znacznych dawek porażenie ośrodka oddechowego powstaje prawie natychmiast.
3. W bardzo małych stężeniach (00,6/M3 — 00,8/M3) zauważono wyraźne przyspieszenie oddechu i ogólną słabość, jeżeli działanie trucizny było dość długotrwałe. U ludzi, którzy podlegali zawodowemu zatruciu kwasem pruskim zauważano prócz tego ból głowy i zanik wrażliwości odruchowej.
W przyszłości grupa ta będzie prawdopodobnie ważnem źródłem nowych trucizn, przedewszystkiem w warunkach zastępowania (przeważnie częściowo) chlorowców przez CN; teraz wskutek omówionych już wad i łatwości rozkładu mają te trucizny raczej historyczne znaczenie.
Mniej więcej można to samo powiedzieć o pewnych truciznach, których pomimo ich wyraźnej napastliwości nie używano do celów bojowych.
Najważniejszą z nich jest grupa siarczku węgla CS2, do którego dołączyć należy również COS czyli tleno-siarczek węgla.
Siarczek węgla z powodu swych właściwości trujących zbliża się do trucizn nasennych, wywołuje jednak trwalsze zmiany układu nerwowego i pewnych narządów a mianowicie: zapalenie obwodowych nerwów i następny zanik mięśni, zwyrodnienie tłuszczowe nerek i wątroby, a również zmiany budowy komórek nerwowych i zwiększony rozkład krwinek czerwonych, co jest przyczyną wyraźnego zabarwienia tkanek hemosideryną.
Siarczek węgla jest jedną z najważniejszych trucizn przemysłowych. Używano go też od dawnych czasów do niszczenia rozmaitych szkodników: susłów, chomików, moli i innych owadów (w zbiorach naukowych), a przedewszystkiem jako środek przeciwko filokserze. Jest on niezbędnym odczynnikiem w całym szeregu czynności przemysłowo-chemicznych i dlatego otrzymywano go w sposób fabryczny w dużych ilościach; w czasie przedwojennym był on bardzo tanim materjałem.
Właściwości fizyko-chemiczne siarczku węgla są następujące: jest on w czystym stanie bezbarwnym, silnie załamującym światło płynem, o zapachu podobnym do chloroformu, zwykle jednak wskutek rozkładu albo obecności domieszek barwi się na żółto i posiada nieprzyjemny zapach zgniłej kapusty albo rzodkwi. Punkt wrzenia jest bardzo niski 46°C i dlatego jest on ciałem lotnem, które parując wywołuje znaczne oziębienie. Pary jego są 21/2 raza cięższe od powietrza i tworzą z nim wybuchającą mieszaninę. Przy spalaniu CS2 powstają CO2 i SO2 i dlatego spalanie mieszaniny jego z alkoholem stosują do celów dezynfekcji. Czysty CS2 podczas spalania łatwo powoduje wybuchy. Wskutek łatwopalności jest on niewygodny do napełniania pocisków artyleryjskich i mógłby być użyty tylko do napełniania naczyń wyrzucanych z samolotów. Łatwopalność siarczku węgla ograniczyła w znacznym stopniu zastosowanie go jako środka bojowego.
Jego właściwości trujące są bardzo wyraźne. Stężenie powyżej 2/M3 wywołuje utratę przytomności, nieprawidłowość oddechu i stopniowe porażenie ośrodka oddechowego. Mieszanina zawierająca 5% par CS2 zabija natychmiast. W stężeniach niższych mamy jak podczas działania kwasu pruskiego skurcze z następnym paraliżem, jeszcze niższe powodują ogólną słabość. Wyraźne objawy zatrucia dają się zauważyć już w stężeniu 0,2 — 1,5/M3. Dla ludzi niebezpieczeństwo zatruć chronicznych istnieje w takich samych mniej więcej stężeniach (wyżej od 1/M3). U ludzi w zatruciu chronicznem najwięcej zwracają na siebie uwagę objawy chorób umysłowych — z początku stan obłędu, a później przygnębienia. Ciekawy jest również przebieg zmian funkcji płciowej, z początku podniesienie jej a w dalszym ciągu zupełny zanik.
Sposób działania siarczku węgla i jego losy w ustroju ludzkim są jeszcze zupełnie nieznane. O stopniu jego jadowitości można sądzić z tego, że 97 — 98% pochłanianego CS2 wydziela się zpowrotem przez płuca, więc czynne są tylko 2 — 3% odpowiedniej dawki.
Tlenosiarczek węgla COS, który można rozpatrywać jak siarczek węgla, w którym jeden atom siarki zastępuje tlen, jest ciężkim (c. g. 2.07) bezbarwnym gazem, zupełnie pozbawionym zapachu (w stanie suchym). Pod działaniem wody COS rozkłada się łatwo na H2S i CO2 według wzoru COS + H2O = CO2 + H2S. Otrzymuje się go przez działanie kwasu siarkowego (dołączenie wody) na rodanek amonowy w temperaturze pokojowej:
NH4CNS + H2O = 2NH3 + COS.
Właściwości trujące są podobne do CS2 i częściowo do H2S, łatwo z niego powstającego. We krwi zwierząt pod wpływem COS powstaje smuga sulfohemoglobiny. Jadowitość jego w porównaniu z CS2 jest mniejsza. Stężenie śmiertelne (dla królików) wynosi około 6/M3. Praktycznie gaz ten jest nieużyteczny.
Na uwagę zasługuje też tiowęglan sodu, który jest przetworem zamiany w węglanie sodu tlenu na siarkę. Wzór jego jest Na2CS3. Woda rozkłada go na siarkowodór, siarczek węgla i wodorotlenek sodu, który w dalszym ciągu wytwarza z CO2 powietrza węglan sodowy:
Na2CS3 + H2O + CO2 = CS2 + H2S + Na2CO3.
Środki narkotyczne powszechnie znane, do których można w pewnym stopniu zaliczyć też CS2 i COS są marzeniem stronników humanitarnej walki chemicznej.
Wszystkie związki organiczne, których rozpuszczalność w tłuszczach jest większa niż rozpuszczalność ich w wodzie, są obdarzone zdolnością wywoływania narkozy (teorja narkozy Owerton-Mayer’a), chwilowej nieczynności ośrodków nerwowych, rozpoczynając od kory mózgu (utrata przytomności i osłabienie mięśni), a następnie innych ośrodków, kończąc na ośrodku oddechowym i ośrodkach serca. Są to węglowodory, alkohole, etery i estry, a przedewszystkiem przetwory otrzymane przez zastępowanie w rodnikach alkoholowych wodorów chlorowcami. Przykładem mogą służyć chloroform i eter CHCl3 i (C2H5)2O. Żaden z nich jednak nie posiada tak wybitnej jadowitości, by mógł być zastosowany jako środek bojowy.
Lotne składniki pewnych roślin, lub czynne substancje otrzymane z tych roślin, dają przy spalaniu narkotyzujące albo trujące dymy.
Powszechnie znanym jest przedewszystkiem tytoń, zawierający lotny alkaloid, nikotynę. Nikotyna łatwo poddaje się destylacji i dlatego jest stałym składnikiem dymu tytoniowego. Jadowitość nikotyny jest bardzo znaczna. Dla człowieka śmiertelną dawką jest mniej więcej jedna kropla płynnej nikotyny. W dymie pozostaje nierozłożone około 75% nikotyny. Prócz tego dym ten zawiera pyridynę, czad i kwas pruski, które też nie są obojętne. Zawartość nikotyny w zwykłych gatunkach tytoniu waha się w granicach od 1 — 4%.
Objawy ostrego zatrucia nikotyną, po użyciu śmiertelnych dawek, polegają na atakach kurczów, osłupieniu, bredzeniu, następnie porażeniu serca i śmierci, zwykle w ciągu 10 — 30 sekund po zatruciu. Małe dawki powodują nudności, wymioty i biegunkę, bicie serca, zawrót głowy i wybitną słabość mięśni, wskutek której zatruci ledwie że mogą się poruszać.
Opjum jest drugą trucizną nałogową. Zawiera ono jedną z najmocniejszych trucizn nerwowych — morfinę, która w warunkach spalania albo suchej destylacji zostaje prawie całkowicie zniszczona, natomiast powstają inne związki, należące raczej do grupy nikotyny. Dla masowych zatruć trucizna ta nie może mieć wielkiego znaczenia.
Należy tu wspomnieć też o możności zatrucia dymami pewnych roślin, zawierających atropinę i dość pospolitych we wszystkich prawie krajach. Są to wilcza jagoda (Atropa belladona), bieluń i dziędzierżawa (Hyoscyamus niger i Datura stramonium), mandragora (Atropa mandragora), lulecznica (Scopolia atropoides) i inne podobne rośliny. W dawnych czasach środki te były stosowane przez czarownice do wyrobu specjalnych kadzideł, których dym doprowadzał do stanu obłędu z fantastycznemi halucynacjami. Dłuższe działanie może rzeczywiście wywołać cięższe objawy zatrucia i nawet śmierć, ponieważ atropina, czynny składnik tych roślin, jest jedną z najsilniejszych trucizn. Jeszcze niebezpieczniejszym jest dym otrzymywany przez spalanie mało znanej rośliny Excoecaria agallocha.
Do zatrucia napojów i środków żywności były używane w starożytności też rośliny, zawierające atropinę. Tak np. mamy historyczne wzmianki, że król szkocki Duncan uwolnił się od najazdu Duńczyków przez dostarczenie im piwa zatrutego rośliną Scopolia atropoides (lulecznica). W czasie walki Cezara z Pompejuszem całe wojsko Skrybonjusza Kurjona zostało zatrute przez Numidyjczyków zapomocą dodania do wody pewnej rzeczułki wielkiej ilości rośliny „sakaran”(rodzaj bielunu — Hyoscyamus muticus). W odpowiednich warunkach do zatrucia przez drogę pokarmową używano też innych roślin. Są poszlaki, że używano w tym celu tojadu (Aconitum) i ciemiernika (Helleborus), zawierających jeszcze mocniejsze od atropiny trucizny — akonitynę i weratrynę.
W rozdziałach powyższych zostało szczegółowo omówione działanie trucizn używanych jako środki bojowe, lub nawet towarzyszących niektórym zjawiskom życia pokojowego. Widzieliśmy, że najsłabsze z tych środków wystarczają, aby zabić każdy żywy ustrój, o ile nie będzie on w stanie w ten czy inny sposób uniknąć tego zatrucia. Dlatego skutki pierwszych zatruć bojowych były przerażające. Przytoczę tu kilka przykładów.
Podczas pierwszego napadu gazowego dokonanego przez Niemców 22 kwietnia 1915 r. około miejscowości Ypres zapomocą fali chlorowej z 12.000 Kanadyjczyków po pięciu dniach pozostało przy życiu tylko 2.000. Według niemieckich danych napad ten spowodował 15.000 zatruć, z których 5.000 było śmiertelnych. Takiż napad niedaleko Sochaczewa na Bzurze 31. IV. 1915 r.
w wyniku dał 6.000 zmarłych natychmiast i 3.100 ciężko zatrutych strzelców syberyjskich. Użyto wtedy 12.000 butli chloru na przestrzeni 12 km. 17 października 1916 r. po użyciu 3.000 butli na froncie 11/2 km znaleziono 4.000 śmiertelnie zatrutych kozaków razem z ich końmi. 31. I. 1917 r. około Reims we Francji po użyciu na przestrzeni 9 km 18.000 butli mieszaniny chloru z fosgenem znaleziono 2.500 trupów.
Wyniki działania chemicznych pocisków są mniej zastraszające, lecz duże miny gazowe są nawet groźniejsze od fal gazowych. Tak np. udało się Niemcom zatruć w omówiony sposób 24. X. 1917 r. 600 żołnierzy włoskich przez 894 min gazowych na 1 km frontu.
Ogólna liczba zatrutych środkami bojowemi przez czas wojny światowej według Mills’a (Anglicy, Niemcy, Francuzi i Amerykanie) wynosi 506,729. Amerykanie liczą, iż 28% strat ogólnych pochodzi od zatruć.
Jednak w końcu wojny wyniki napadów gazowych stały się słabsze. Tak z ogłoszonych danych amerykańskich wynika, że z ogólnej liczby zatrutych gazami bojowemi w ostatnich czasach wojny zmarło tylko 2,5%.
Taka zmiana powstała wskutek tego, że równoległe do działań zapomocą coraz większej ilości coraz mocniejszych trucizn wzrastała też i skuteczność środków obrony i polepszały się sposoby leczenia zatrutych.
Cały przebieg rozwoju walki chemicznej może być scharakteryzowany jako stałe współzawodnictwo pomiędzy środkami niszczącemi i zabiegami ochronnemi. Każdy nowy rodzaj trucizn, zastosowany do celów bojowych, wywoływał natychmiastowe powstanie zabiegów unieszkodliwiających jego działanie. Każdy postęp w rozwoju środków ochronnych miał tylko krótkotrwałe powodzenie, ponieważ wkrótce stawał się niewystarczającym wobec nowych środków napadu. Skutkiem tego było z jednej strony powstanie prawie niezliczonej ilości proponowanych środków bojowych, a z drugiej udoskonalenie teraźniejszych środków ochronnych, przedewszystkiem masek przeciwgazowych.
Wogóle przebieg tego współzawodnictwa pomiędzy środkami walki chemicznej a obroną przeciwchemiczną można podzielić na następujące pięć okresów.
1. Okres początkowy od lipca 1914 do kwietnia 1915 r. W ciągu tego pierwszego okresu wojny walki chemicznej jeszcze całkiem nie rozpoczęto, jeżeli nie będzie się liczyło niemieckich „Ni” pocisków, które zawierały chlorek dianisidiny, wywołujący kichanie i łzawienie i francuskich granatów ręcznych, zawierających bromooctan etylu i chloroaceton, a zatem środki drażniące. Przeciwko tym środkom bojowym nie używano żadnych specjalnych zabiegów ochronnych.
2. Drugi okres, który rozpoczyna się właśnie znakomitym niemieckim napadem pod Ypres 22. IV. 1915 r., można oznaczyć jako okres fal gazowych. Jako materjał do takich fal służył z początku czysty chlor. W dalszym ciągu tak Niemcy jak Francuzi i Anglicy dodawali do chloru znacznie czynniejszy fosgen, następnie siarkowodór i chloropikrynę. W dalszym ciągu rozwoju techniki walki gazowej uznano ten sposób za niewygodny. Ostatni raz użyli go Niemcy na francuskim froncie w styczniu 1918 r. Skuteczność tego rodzaju napadów stała się stopniowo bardzo nieznaczna, wskutek udoskonalenia chemicznych pochłaniaczy, całkowicie wystarczających do zwalczania zatruć chlorem i fosgenem, lecz mniej czynnych wobec chloropikryny i wielu innych, przeważnie drażniących, środków. Skutkiem wprowadzenia takich domieszek było wynalezienie uniwersalnego pochłaniacza dla par i gazów, z węglem aktywowanym.
3. Trzeci okres jest okresem pocisków gazowych. Zamiast mało czynnych pocisków ze środkami drażniącemi początkowego okresu, zaczęło używać pocisków napełnionych niebezpiecznemi truciznami, a z drugiej strony i owe środki drażniące udoskonalono do takiego stopnia, iż stały się one już bardzo skuteczną bronią, jak to można wnioskować z danych o teraźnieszych środkach odruchowych omówionych w rozdziale XI. Pociski napełnione truciznami rzucano nietylko z dział lecz również ze specjalnych przyrządów — miotaczy (miotaczy bomb), a w dalszym ciągu wojny z samolotów, co spowodowało znaczne powiększenie skuteczności tego rodzaju walki chemicznej, który też zastąpił zupełnie używanie fal gazowych. Początkiem skutecznego używania pocisków gazowych, napełnionych mocnemi truciznami (fosgenem i palitem), były niemieckie pociski z palitem (VI. 1915) a później (I. 1916) francuskie pociski z akroleiną, fosgenem i vincennitem. Miotacze i duże bomby napełnione truciznami wprowadzili Anglicy w 1917 r.
W ciągu tego okresu spotykamy się, również jak w okresie fal gazowych, z dwoma podokresami. Z początku używano pewnego czynnego środka w czystym stanie, a następnie dodawano do niego cały szereg domieszek. Takie mniej więcej skomplikowane mieszaniny służą obecnie jako materjał do napełniania pocisków i min. Znaczenie tych domieszek nie zawsze jest jednakowe. W jednych wypadkach są one potrzebne, aby zapobiec rozkładowi zasadniczej trucizny przy przechowaniu, a w drugich, żeby zmienić warunki napastliwości, przedewszystkiem drogą przenikania tych drażniących domieszek przez pochłaniacze, w trzecich nareszcie takie mieszaniny okazują się mocniejszemi od zasadniczego składnika na podstawie jeszcze mało znanych praw synergizmu. Taki sam skutek jak przy użyciu skomplikowanych mieszanin osiągano przez jednoczesne używanie pocisków napełnionych rozmaitemi truciznami. Taki sposób strzelania Niemcy nazywali „Buntschiessen” z powodu oznaczania pocisków gazowych kolorowemi krzyżami.
Dlatego teraźniejsze zatrucia bojowe tylko w wyjątkowych wypadkach będą czystemi wypadkami działania tej lub innej trucizny. Zwykle będziemy mieli do czynienia ze skomplikowanemi skutkami zatruć nieznanemi mieszaninami, co w znacznym stopniu utrudnia leczenie oraz wynalezienie odpowiednich środków ochrony.
Obecność w składzie takich mieszanin mocnych środków drażniących miała za skutek dalsze skomplikowanie budowy maski przeciwgazowej, która musi teraz ochraniać również i oczy, a zdolność subtelnych drażniących proszków (sternitów) do przedostawania się przez pochłaniacze z węglem spowodowała dążenie do zastąpienia maski z pochłaniaczem przez ten lub inny aparat izolacyjny.
Co się tyczy środków duszących i drażniących omówiony okres trwał aż do końca wojny. W przyszłości można spodziewać się tylko zamiany stosunkowo niewielkich pocisków artyleryjskich na duże bomby rzucane z samolotów.
4. Czwarty okres jest okresem używania iperytu jako trucizny, przeciwko której są bezskuteczne wszystkie zwykłe środki ochronne, ponieważ działa ona na całą powierzchnię skóry, przy równoczesnem mocnem działaniu na oczy i narządy oddechowe. Iperyt jako materjał do napełniania pocisków był wprowadzony przez Niemców w r. 1917 (12.VII). W dalszym ciągu stał się on jedną z najważniejszych trucizn bojowych, „królem gazów”, dla wszystkich uczestników wojny światowej. W czasie ostatniej wojny nie został wynaleziony jeszcze żaden środek przeciwko powstaniu oparzeń iperytowych.
5. Powojenny okres może być nazwany okresem dymów bojowych. Trujące dymy bojowe będą prawdopodobnie najskuteczniejszą chemiczną bronią przyszłości. Toksykologiczne ich właściwości, jak również środki zapobiegawcze przeciwko zatruciom dymami, są jeszcze całkiem nieznane. Jedynym zabiegiem ochronnym było dodanie do zwykłego pochłaniacza warstwy komprymowanej bawełny, jako filtru posiadającego czysto mechaniczne znaczenie.
Ciekawe jest, że przez cały czas wojny, pomimo wytężonej pracy laboratorjów całego świata, nie znaleziono prawie żadnej nowej trucizny, jeżeli nie liczyć luizytu. Jest to z jednej strony dowodem wyczerpania prawie że w najwyższym stopniu pomysłów, powstających na tle rozwoju chemji syntetycznej a również i toksykologji, z drugiej zaś strony musi to być do pewnego stopnia dowodem, że pomimo całej nowości walki chemicznej nie należy oczekiwać zbyt łatwego wynalezienia jeszcze mocniejszych od istniejących trucizn. Postęp w tym kierunku zależy raczej od wykorzystania znanych właściwości już istniejących substancyj, t. j. od naukowego rozwoju chemji toksykologicznej.
Zabiegi stosowane do zwalczania zatruć środkami bojowemi można podzielić na zabiegi charakteru zbiorowego czyli masowego i na zabiegi indywidualne. Zabiegi pierwszego rodzaju nie miały wielkiego powodzenia z powodu małej skuteczności lub też z powodu nieużyteczności ich do celów wojennych. Do takich zbiorowych zabiegów ochronnych należą: zwalczanie fal gazowych przy pomocy zapalania szeregu stosów z łatwopalnego materjału, co stosowali Rosjanie z dość marnemi wynikami i specjalne schroniska dla rannych i zatrutych, zabezpieczone od zewnętrznego powietrza przez wilgotne korty, napojone płynem absorbującym jadowite pary i gazy, używane przez Amerykanów i Anglików, lub jeszcze skuteczniejsze francuskie schroniska z filtrami z dużej warstwy ziemi, a w niektórych wypadkach z prawdziwemi pochłaniaczami większych rozmiarów. W przyszłości takie masowe schroniska mogą stać się bardzo skuteczne do ochrony cywilnej ludności w razie napadu na miasta eskadr lotniczych.
Do celów wojennych okazały się użyteczne wyłącznie środki o charakterze obrony indywidualnej.
W tym celu używane były maski przeciwgazowe, aparaty izolacyjne i specjalne ubrania przeciwgazowe.
Najważniejszą rolę odgrywały maski przeciwgazowe, których stopniowe udoskonalenie stało się właśnie w ostatnich okresach wojny przyczyną znacznie mniejszej zabójczości chemicznych środków bojowych.
Pierwotną postacią masek przeciwgazowych był woreczek z kilku warstw merli, napojony alkalicznym rozczynem tiosiarczanu sodu. Takich masek używano już od czasu pierwszych fal chlorowych. Z początku taki woreczek zakrywał tylko usta i nos, następnie przyjął on postać dużego worka pokrywającego całą głowę, zrobionego z odpowiedniego materjału (flaneli napojonej tiosiarczanem). Dla oczu były zrobione odpowiednie okienka z szybkami ze szkła lub miki. Dalszy postęp polegał po pierwsze na udoskonaleniu postaci samej maski, a po drugie na użyciu coraz bardziej skomplikowanych mieszanin absorbujących, zależnie od zastępowania czystego chloru przez mieszaninę chloru z fosgenem i chloropikrynę, jak również od powstania trzeciego okresu walki bombardowania pociskami gazowemi, zawierającemi mocne środki drażniące.
Jako przykład takich stosunkowo prostych masek, które nie posiadały ani zaworów wydechowych ani specjalnych pochłaniaczy, mogą służyć angielski PH Helmet (1915) i francuska maska M 2. W PH Helmet flanela była napojona, oprócz zasadowego rozczynu tiosiarczanu z domieszką gliceryny, jeszcze fenolanem sodu i hexametylentetraminą (urotropina (CH2)6(NH2)4), żeby zapobiec zatruciom fosgenem.
Francuska maska M 2 składała się z 20 warstw gazy napojonej „gréasène” i 20 warstw napojonych „complexène”. Gréasène jest mieszaniną 50% oleju rycynowego, 42% spirytusu, 6% gliceryny i 2% sody żrącej. Complexène jest mieszaniną 33% urotropiny, 32% gliceryny, 30% siarczanu niklu i 5% sody rozpuszczonych w wodzie. Amerykanie, którzy w pierwszym okresie używali również masek M 2, zastąpili warstwy napojone „complexène” przez 10 warstw napojonych siarczanem niklu i węglanem sodu i 20 warstw napojonych urotropiną i zmniejszyli liczbę warstw z „gréasène” z 20 na 10.
W dalszym ciągu pod wpływem konstrukcji masek używanych przez Niemców powstały typy masek ze specjalnym pochłaniaczem, niezależnym od maski właściwej. Oprócz niemieckich masek, które od początku miały tę postać, oddzielne pochłaniacze posiadały angielski box respirator, francuska maska Tissot’a, nowa amerykańska maska i rosyjskie maski Kumanta-Zielińskiego i typu Instytutu Górniczego. Jest to prawdopodobnie typ, który pozostanie również zasadniczym typem na przyszłość.
W maskach tego typu maska właściwa jest zrobiona z nieprzenikalnego i jak najbardziej odpornego materjału — skóry, gumy, przepojonej gumą czy smołą tektury i szczelnie przylega do twarzy. Powietrze wdychane dostaje się przez specjalny przyrząd — pochłaniacz tego lub innego gatunku. Wydychane powietrze w maskach używanych przez Niemców wychodzi znowu przez ten sam pochłaniacz, w innych, więcej udoskonalonych, przez specjalny zawór wydechowy. W wielu wypadkach, np. w angielskim box respirator i w masce amerykańskiej oddech musi być wykonany wyłącznie przez usta, co z wielu punktów widzenia jest bardzo niewygodne. Tych wad pozbawiona jest francuska maska Tissot’a i maska A. R. S. Pochłaniacz zależnie od typu maski albo bywa bezpośrednio połączony z maską np. w maskach niemieckich albo też zapomocą rury gumowej.
Zasadniczą częścią teraźniejszych masek jest właśnie pochłaniacz — naczynie blaszane, zawierające tę lub inną masę absorbującą. Pod względem składu tej masy pochłaniacze podzielić można na dwa zasadnicze rodzaje: pochłaniacze ze środkami chemicznemi i pochłaniacze z węglem aktywowanym. Pierwszego rodzaju pochłaniacze są czynne tylko wobec odpowiedniego rodzaju trucizn, pochłaniacze zaś drugiego rodzaju są prawie uniwersalne. Dlatego pochłaniacze chemiczne mają teraz znaczenie tylko w wyjątkowych wypadkach, jak np. pochłaniacze z hopkalitem przeciwko zatruciom CO.
Do czasu wprowadzenia węglowych pochłaniaczy lub raczej do wynalezienia odpowiednich sposobów aktywacji węgla, używano wszędzie chemicznych pochłaniaczy, częściowo z domieszką nieaktywowanego węgla. Używanie węgla jako środka pochłaniającego rozpoczyna się od roku 1916 w postaci niemieckiego trójwarstwowego pochłaniacza, zawierającego oprócz węgla jeszcze chemiczne środki jak węglan potasu i urotropinę. Równocześnie prawie powstała rosyjska maska Kumanta-Zielińskiego z pochłaniaczem z czystego węgla. Aktywację węgla wprowadzili Niemcy w r. 1916.
Pochłaniacze chemiczne muszą zawierać dość złożone mieszaniny, żeby być w stanie przeciwdziałać nawet najpospolitszym środkom bojowym. Ponieważ pierwszym z tych środków był właśnie chlor, a w ciągu dalszego rozwoju walki chemicznej używano przeważnie kwaśnych substancyj lub takich, z których powstawały kwasy wskutek hidrolizy, zasadniczemi składnikami tych materjałów były po pierwsze tiosiarczan jako środek niszczący chlorowce, a po drugie zasady: wodorotlenek sodu, wapno sodowane, węglan sodu i węglan potasu. Tych środków używano w postaci domieszek do węgla drzewnego (w maskach niemieckich i rosyjskich) lub też drogą napojenia pumeksu i ziemi okrzemkowej (również w starych maskach niemieckich). Kiedy do chloru dołączył się fosgen, palit i superpalit, to pochłaniacze okazały się niewystarczające. Dlatego użyto nowych domieszek mianowicie sulfanilanu sodu, fenolanu sodu i przedewszystkiem urotropiny. Chloropikryna spowodowała dołączenie siarczynu sodu, mydła i oleju rycynowego. Kwas pruski był zwalczany przy pomocy soli niklu. Organiczne pochodne arsenu i arseniak próbowano zwalczać zapomocą nadmanganianu potasu.
Te rozmaite środki były albo podzielone pomiędzy kilku warstwami, z których składał się pochłaniacz, lub też tworzyły jednolite skomplikowane mieszaniny.
Mimo to, wobec wielkiej ilości środków bojowych i wyraźnej chemicznej bierności przeważnej części nowych środków drażniących, pochłaniacze chemiczne bardzo prędko stałyby się niewystarczające, gdyby nie były zastępowane przez znacznie wygodniejsze pochłaniacze z węgla aktywowanego lub skombinowane pochłaniacze.
Węgiel jako pierwiastek jest znany w trzech allotropnych postaciach: krystaliczna czyli djament, trwała, amorficzna — grafit i łatwo paląca się, amorficzna postać — zwykły węgiel, który powstaje w razie niezupełnego spalania organicznych substancyj. Ostatnia postać węgla, przedewszystkiem węgla otrzymanego przez spalanie krwi, kości i w nieco mniejszym stopniu materjałów roślinnych, posiada wyraźne właściwości mocnego środka absorbującego. Stosownie do tego używano oddawna węgla w technice (w cukrowniach, gorzelniach) do odbarwiania i pozbawiania zapachu rozmaitych płynów. Okazuje się, że w nie mniejszym stopniu węgiel jest zdolny do absorpcji z przedmuchiwanego przezeń powietrza całego szeregu domieszek, znajdujących się w stanie gazu lub par. W odpowiednich warunkach absorbuje on nawet wszystkie gazy, zatrzymując je tak mocno, iż taka absorpcja okazała się najskuteczniejszym zabiegiem celem otrzymania najdoskonalszej próżni w rurach roentgenowskich lub naczyniach Dewara.
Trzeba jednak zauważyć, że takie właściwości posiada nie każdy węgiel i że zwykły węgiel kowalski, a w większym jeszcze stopniu węgiel kamienny, są prawie zupełnie pozbawione tych cech. Dlatego do pochłaniania używano specjalnych gatunków węgla, przeważnie węgla pochodzenia zwierzęcego, oczyszczonego kwasami i powtórnie ogrzewanego. W ciągu ostatnich lat wojny (1917 — 1918 r.) jak również po wojnie wyjaśniło się jednak, że absorbujące właściwości węgla są zależne od całego szeregu specjalnych warunków. Najważniejszym z tych warunków jest temperatura, w której rozkłada się ogrzewana organiczna substancja. Jeżeli ten rozkład wykonano poniżej 600°C, powstały węgiel przybiera właściwości węgla aktywnego, wyżej od 600°C przybiera on cechy węgla inaktywnego, podobnego do grafitu.
Aktywny węgiel posiada wyraźną zdolność do absorbowania gazów i łatwo się utlenia. Dlatego jako materjał do pochłaniaczy węgiel będzie tem lepszy, im mniejsza jego część będzie w stanie inaktywnym.
Po drugie węgiel musi być czysty, t. j. nie zawierać żadnych domieszek, które obniżają jego właściwości absorbujące. Pierwotny węgiel, tak powstały przez spalanie materjałów organicznych, jak również węgiel kamienny, zawsze zawiera oprócz pewnej ilości składników mineralnych (popiołu), znaczną domieszkę organicznych związków, przeważnie rozmaitych węglowodorów. Przy spalaniu tych węglowodorów w temperaturze wyżej 600° powstają duże ilości inaktywnego węgla. Taki skład posiada zwykły koks. Domieszka węglowodorów w znacznym stopniu obniża absorbujące właściwości węgla, który w razie znacznej ich zawartości może stać się zupełnie nieczynny. Takim właśnie nieczynnym pierwotnym węglem jest węgiel kamienny i zwykły węgiel kowalski, otrzymany przez spalanie drzewa przy niewystarczającym dopływie powietrza. Celem otrzymania z pierwotnego węgla dobrego węgla absorbującego trzeba go aktywować, do czego istnieje cały szereg zabiegów. Zabiegi te polegają na usunięciu tych szkodliwych domieszek lub na spalaniu ich w taki sposób, żeby nie powstał bardzo niepożądany inaktywny węgiel. Równocześnie z aktywacją osiągano odpowiednie fizyczne właściwości węgla, który, żeby służyć do napełniania pochłaniaczy, musi być dość twardy i nie dawać znacznych ilości pyłu, oraz niezależnie od tego musi posiadać o ile możności jak największą powierzchnię czynną, co zależy od budowy wyjściowego materjału. Co do tego materjału to Niemcy używali wyłącznie węgla z drzewa gatunków iglastych (sosny i świerka), a Rosjanie przeważnie z brzozy. Amerykanie dążyli do otrzymania możliwie najtwardszych tkanek roślinnych i używali prawie wyłącznie węgla z łupin orzechów kokosowych, odrzuciwszy bardzo prędko drzewo czerwonej limby (Juniperus virginiana, zwykły materjał służący do wyrobu ołówków). Aktywację wykonywano wogóle trzema zasadniczemi sposobami: 1) przez ogrzewanie pierwotnego węgla w prądzie powietrza do 350° — 450°, 2) przez ogrzewanie go w strumieniu pary wodnej w temperaturze 800° — 1000°, 3) przez ogrzewanie w strumieniu CO2. Niemcy, a następnie i inne państwa stosowali też napajanie drzewa przed zwęgleniem rozczynem chlorku cynku, który następnie usuwano kwasem solnym. Po aktywacji, nawet z tak marnego materjału jak drzewo gatunków iglastych, otrzymano bardzo dobry produkt.
Żeby zilustrować właściwości teraźniejszych gatunków węgla aktywowanego przytaczamy odpowiednią tabliczkę.
W warunkach przepuszczania strumienia powietrza zawierającego 0,1% odpowiedniego środka bojowego z szybkością 500 cm3 na 1′, przez warstwę węgla grubości 10 cm i w temperaturze 10°, obserwowano zupełne zatrzymanie trucizny przez pochłaniacz w ciągu następującego czasu.
Właściwości absorbujące rozmaitych gatunków węgla aktywowanego (według Fries i West’a)
|
Węgiel z łupin orzechów kokosowych
|
Impregnowany (ZnCl2) węgiel z łupin orzechów kokosowych
|
Angielski węgiel drzewny
|
Niemiecki węgiel drzewny z (ZnCl2)
|
| Chloropikryna | 620′ | 400′ | 70′ | 90′ |
| Fosgen | 310′ | 700′ | 90′ | 320′ |
| Kwas pruski | 27′ | 70′ | 18′ | 16′ |
| Arseniak | 30′ | 400′ | 4′ | 1′ |
| Chlorek cyjanu | 75′ | 70′ | 5′ | 110′ |
| Superpalit | 70′ | 190′ | 30′ | 120′ |
| Chlor | 420′ | 510′ | — | — |
Stąd możemy wnioskować, iż aktywowany węgiel daje dobrą ochronę właśnie przeciwko takim środkom jak chloropikryna, dla których użyteczność pochłaniaczy chemicznych jest bardzo wątpliwa.
Działanie węgla aktywowanego nie jest jednak nieograniczone. Odpowiednio do każdego stężenia pewnej domieszki do powietrza ustala się określona równowaga i po pochłonięciu pewnej ilości tej domieszki pochłaniacz przestaje być czynnym.
Ilość pochłanianej substancji, jak również czas, w ciągu którego pochłaniacz pozostaje czynny, są zależne od stężenia domieszki, właściwości danego węgla, temperatury powietrza, zawartości pary wodnej w powietrzu i przedewszystkiem od właściwości danego środka bojowego, czy też innej pochłanianej substancji. Węgiel, nasycony w mocnem stężeniu pewnej substancji, w warunkach mniejszego jej stężenia lub zupełnego jej braku w powietrzu może stać się nawet źródłem jej parowania. Wskutek tego węgiel nasycony pewnym środkiem może być w znacznym stopniu oczyszczony przez długotrwałe przedmuchiwanie czystego powietrza.
Ze względu na takie wady pochłaniaczy węglowych, materjał używany do napełniania niemieckich, angielskich, amerykańskich i częściowo rosyjskich pochłaniaczy (maska Instytutu Górniczego) składał się oprócz węgla jeszcze z innych substancyj. Celem dodawania tych substancyj było niszczenie lub neutralizowanie pochłanianych przez węgiel środków bojowych. Niemcy używali w tym celu pochłaniaczy złożonych z trzech warstw: pierwsza ze specjalnego gatunku pumeksu (diatomit) napojonego węglanem potasu, druga z aktywowanego węgla i trzecia z pumeksu napojonego urotropiną. W angielskich i amerykańskich pochłaniaczach ostatniego typu aktywowany węgiel był zmieszany z ziarnkami specjalnego gatunku wapna sodowanego, zabarwionego na czerwono-bronzowo wskutek domieszki nadmanganianu. Amerykańska mieszanina tego rodzaju składa się z 45% wapna (Ca (OH)2), 14% cementu, 6% ziemi okrzemkowej, 1% wodorotlenku sodu i 34% wody. Po wysuszeniu ziarnek otrzymanych z tej mieszaniny uwilgotniano je 15% rozczynem nadmanganianu sodu. Rosyjskie pochłaniacze zawierały zwykle wapno sodowane w stosunku 3 — 4 części na 1 część węgla. Treścią działania tych domieszek było utlenianie trucizn bojowych przez nadmanganian i neutralizacja kwasów przez wapno lub węglan potasu.
Pomimo swego znaczenia jako najlepszy środek zapobiegawczy przeciw zatruciom bojowym, maski przeciwgazowe nie mogą jednak być uważane za rzecz zupełnie obojętną dla czynności ustroju ludzkiego. Każdy pochłaniacz, jako aparat filtracyjny, przedstawia pewien opór dla przedmuchiwania przez niego powietrza. Ten opór waha się od 4,5 aż do 22 mm Hg. (najmniejszy w niemieckich „Leichtatmer“ i największy w rosyjskim pochłaniaczu Instytutu Górniczego). Wskutek tego praca mięśni oddechowych podnosi się w znacznym stopniu w chwili wdechu, jeżeli wydychane powietrze jest skierowane przez samodzielny przewód wydechowy, lub również w czasie wydechu, jak to było w maskach starego typu, pozbawionych samodzielnego pochłaniacza i jak to pozostało w niemieckich maskach. Zawór wydechowy masek nowego typu potrzebuje również pewnej przewagi ciśnienia dla swojej czynności i dlatego zamiast bezwzględnie biernego normalnego wydechu mamy zawsze nienormalny czynny wydech. Dlatego każdy człowiek po pewnym czasie używania maski zawsze odczuwa zmęczenie mięśni oddechowych, przeważnie przepony (tępy ból w dołku), jeżeli nie będzie specjalnie wytrenowany w noszeniu maski. Te niewygody jeszcze powiększają się w tych wypadkach, gdzie oddech odbywa się wyłącznie przez usta i do tego jeszcze przez specjalny przyrząd, który trzeba trzymać wargami (jak np. w angielskim box respirator i podobnym do niego rodzaju amerykańskiej maski). Taki przyrząd zwany ustnikiem, jak również sciskacz nosa z nim połączony, są niestety wadami trudnemi do uniknięcia we wszystkich wypadkach, gdzie maska nie jest bezwzględnie szczelna i gdzie pochłaniacz przedstawia znaczniejszy opór. Inaczej w chwili wdechu zewnętrzne zatrute powietrze dostawałoby się do dróg oddechowych prędzej przez szparę pomiędzy brzegiem maski a twarzą niż przez warstwy absorbujące pochłaniacza. Obecność tego ustnika powoduje ślinienie i czyni rozmowę niemożliwą. Zatkanie nosa jest też bardzo nieprzyjemne, ponieważ w normalnych warunkach oddech wykonywa się właśnie przez przewody nosowe. Prócz tego pozbawia ono powonienia, które może w pewnych wypadkach ostrzec o uszkodzeniu maski. Utrudnienie warunków oddechu jest jeszcze większe w tych wypadkach, gdzie budowa maski powoduje wzrost tak zw. szkodliwej przestrzeni. Szkodliwą przestrzenią nazywano wogóle objętość dróg oddechowych — skomplikowanej postaci kanału znajdującego się pomiędzy pęcherzykami płucnemi a atmosferą zewnętrzną. W chwili wydechu przestrzeń ta zostaje napełniona wydychanem powietrzem, zawierającem mniej tlenu a znacznie więcej kwasu węglowego niż wdychane atmosferyczne powietrze. W normie szkodliwa przestrzeń tworzy nie więcej od 30% ilości powietrza wdychanego w razie spokojnego oddechu (powietrza oddechowego = 500 cm3, więc = mniej więcej 150 cm3) i tylko 4% pojemności życiowej płuc — ilości powietrza, które może być nabrane do płuc w razie mocniejszego wdechu i wypędzone z nich przez najmocniejszy wydech. W maskach omówionego typu do tej normalnej szkodliwej przestrzeni dołącza się cała objętość maski i pochłaniacza, co niechybnie spowoduje podniesienie zawartości CO2 we wdychanem powietrzu, a przez to podniesienie ilości powietrza wdychanego w ciągu jednej minuty. W normie człowiek wykonywa w ciągu 1′ od 18 do 20 ruchów oddechowych i wdycha razem około 500 cm3 powietrza, więc około 10 litrów na 1′. W razie znacznie wzmożonego oddechu ilość potrzebnego powietrza podnosi się aż do 60 i nawet 100 litrów na minutę. Przyczyną tego wzmożenia oddechu jest przedewszystkiem nagromadzenie kwasu węglowego we krwi, które wzrasta równolegle do pracy mięśni. Każda inna przyczyna, która wywołuje takie podniesienie zawartości CO2, będzie sprowadzała takie same wzmożenie oddechu. Dlatego nieprawidłowo zbudowana maska nawet w czasie spokoju będzie potrzebowała wzmożonego oddechu, a w razie najmniejszej pracy fizycznej bezwzględnie spowoduje wyraźną duszność i zmęczenie mięśni oddechowych.
Dlatego nic dziwnego, że obok masek z pochłaniaczami filtrującemi od początku wojny gazowej marzono o innym sposobie rozwiązania tego zadania, mianowicie o aparatach izolujących.
Zasadę aparatów izolujących t. j. długotrwały oddech tą samą ilością powietrza już omówiono w rozdziale VIII (str. 153).
Główne składowe części takich aparatów są: źródło tlenu, przyrząd do usuwania kwasu węglowego i przyrządy mechaniczne do podtrzymywania stałego obiegu powietrza i ustalania odpowiednich warunków ciśnienia. Źródło tlenu stanowi w przeważnej większości przyrządów stalowe naczynie zawierające skomprymowany do 150 — 200 atmosfer tlen (w niektórych starych przyrządach powietrze). Tylko w stosunkowo nielicznych aparatach jako źródło tlenu służy oksylit (Na2O2), czyli nadtlenek sodu i w takim razie uzupełnianie użytej ilości tlenu i usunięcie powstałego CO2 odbywa się zapomocą tegoż samego przyrządu. Naczynie ze skomprymowanym tlenem musi być zaopatrzone w tak zw. redukcyjny wentyl — przyrząd obniżający ciśnienie tlenu wychodzącego z naczynia do 4 — 6 atmosfer. Naczynie musi być połączone również z manometrem, wskazującym stopień ciśnienia w naczyniu, względnie obecny zapas tlenu. Do pochłaniania CO2 służą specjalne pochłaniacze potasowe, o dość złożonej budowie, przez które przepływa stały strumień zawartego powietrza. Takie pochłaniacze przedstawiają wogóle dość znaczny opór nie mniejszy niż pochłaniacze masek przeciwgazowych. Do zwalczania tego oporu w aparatach pierwotnego typu służył czynny wydech noszącego przyrząd. W nowszych konstrukcjach zastosowano t. zw. inżektor, przyrząd, który działa dzięki ciśnieniu tlenu w omówionem wyżej naczyniu, względnie wentylu redukcyjnym. Stosownie do tego, takie przyrządy izolacyjne są połączone albo z szczelnie zamkniętym hełmem, podobnym do używanego w aparatach dla nurków, albo z ustnikami podobnemi do omówionych wyżej przy opisie budowy masek. Do regulacji ciśnienia, jak również celem podtrzymania stałości składu wdychanego powietrza służą worki z nieprzenikalnego dla powietrza materjału, zwykle dwa: jeden dla oczyszczonego wdychanego, drugi dla zawierającego nadmiar CO2 wydychanego powietrza. Rozdzielenie tych dwóch gatunków powietrza osiągnięto przez system zaworów.
Z bardzo licznej ilości przyrządów tego rodzaju używano do celów wojennych stosunkowo niewielu, mianowicie w Niemczech aparatów Draeger-Tübena (bez hełmu) i Draegera HSS (Heeres Sauerstoff Schutzgerät); we Francji aparatu Tissot’a; w Anglji aparatu Proto (Fleuss-Davis); w Stanach Zjednoczonych samoczynnego aparatu „Paul”. Powojenne konstrukcje, używane w górnictwie, podległy całemu szeregowi udoskonaleń i są wogóle użyteczniejsze od starych typów.
Z punktu widzenia toksykologicznego, jak również fizjologicznego, aparaty izolacyjne posiadają bezwątpienia przewagę w porównaniu z najlepszemi maskami przeciwgazowemi, ponieważ czynność ich jest zupełnie niezależna od składu otaczającego powietrza. Na specjalną uwagą zasługują najnowsze samoczynne przyrządy, w których czynność aparatu jest niezależna od ruchów oddechowych i w razie użycia hełmu oddech odbywa się w zupełnie normalnych warunkach. Jednak i te aparaty posiadają swoje wady, z których najważniejszą jest trudność dostatecznej wentylacji hełmu, w którym łatwo gromadzi się nadmiar CO2, jak również trudność uszczelnienia przyrządu. Dlatego nawet tego rodzaju przyrządy są dalekie od doskonałości.
Oprócz tego są to bardzo kosztowne, ciężkie, skomplikowane aparaty, które obniżają zdolność do walki żołnierzy w znacznie większym stopniu niż maski przeciwgazowe. Z tego powodu trudno przypuścić, żeby kiedyś znalazły one szersze rozpowszechnienie i zastąpiły teraźniejsze maski.
Patologia i terapja zatruć bojowych jest olbrzymim, samodzielnym działem, który nie może być rozpatrywany w tym podręczniku. Musimy dlatego poprzestać tylko na pewnych zasadniczych wskazówkach.
Tak w zatruciach wogóle jak również w zatruciach bojowych działanie trucizn na ustrój powstaje z taką szybkością, iż wszelkie zabiegi skierowane do zobojętnienia lub zniszczenia odpowiedniej trucizny w sposób chemiczny nie osiągają zwykle celu. I tak zawiodły całkiem próby zapobiegania oparzeniom iperytowym zapomocą środków dość szybko utleniających iperyt w probówce. Z tego powodu leczenie już powstałych zatruć pozostaje czysto symptomatycznem.
Takie symptomatyczne leczenie w razie najniebezpieczniejszych zatruć środkami duszącemi, lub temi z ogólnie trujących, które wywołują paraliż ośrodka oddechowego, musi być przedewszystkiem skierowane na podtrzymanie oddechu. Jako wskaźnik niedostateczności oddechu służy sinica i ataki duszności. Jako prawie uniwersalny środek w takich wypadkach uważają obecnie terapię tlenową.
Równocześnie wielkiem niebezpieczeństwem grozi porażenie serca i zmiana składu krwi, które zwalczano oprócz zwykłych zabiegów, przez obfite puszczanie krwi i dostarczanie wielkich ilości wody w postaci napojów. Dożylne wlewania są wątpliwym i w pewnych wypadkach nawet szkodliwym zabiegiem. Wobec zwykle obniżonej wrażliwości ośrodka oddechowego, środków narkotycznych, przede wszystkiem morfiny, lepiej jest, o ile można, unikać.
Zatrucia mocnemi stężeniami środków drażniących pod względem porażeń dróg oddechowych nie bardzo się różnią od zatruć środkami duszącemi typu chloru. Dlatego ogólny charakter zabiegów jest ten sam. Do zwalczania bólu i podniesionej wrażliwości powierzchni alarmowej najużyteczniejsze jest zastosowanie kokainy, stowainy i t. p. środków w połączeniu z następnem zwykłem leczeniem ostrych nieżytów zapomocą inhalacji rozpylanych zasadowych rozczynów. Podrażnienia i nieżyt spojówki oka wymagają zwykle tylko przemywania 2% rozczynem dwuwęglanu sodu lub boraksu i pary kropli 3% rozczynu kokainy. W razie stalszych uszkodzeń wskazane jest użycie kropli cynkowych (1/500 ZnSO4 w rozczynie kwasu bornego lub wodzie).
Najtrudniejszem zadaniem, nawet przy nieznacznych stopniach zatrucia, jest zwalczanie oparzeń iperytowych. Przedewszystkiem z początku należy unikać jakichkolwiek maści zawierających tłuszcz lub waselinę, które zwykle powodują tylko rozszerzenie się oparzonej przestrzeni na całą wysmarowaną powierzchnię. Najlepszym zabiegiem jest natychmiastowe usuwanie płynu z bąbli, który zawsze zawiera ślady iperytu i pudrowanie oparzonej skóry jakimś antyseptycznym proszkiem. Niezłym środkiem jest też płyn Dakina, przedewszystkiem w pierwszych chwilach po oparzeniu. Płyn ten jest mieszaniną równych części nasyconych rozczynów podchloranu sodu i kwasu bornego.
W razie zatruć kwasem pruskim i zaczadzenia jedynym racjonalnym zabiegiem jest oddech tlenem, a w wypadkach osłabienia lub zaniku ruchów oddechowych sztuczny oddech.
Nadzieje skutecznego zwalczania zatruć bojowych zapomocą specjalnych zabiegów, jak np. dożylne wstrzykiwanie mocnych rozczynów cukru gronowego celem zwalczania toksycznego obrzęku płuc, używanie w tymże celu wlewań rozczynu chlorku wapnia lub rozczynu dwuwęglanu sodu, zawiodły zupełnie. Z drugiej zaś strony nie podlega wątpliwości skuteczność puszczania krwi w razie powstania wyraźnej sinicy. Jest to jeden z najważniejszych zabiegów ratowniczych.
Ponieważ skutki zatruć zwierząt chemicznemi środkami bojowemi bardzo mało się różnią od objawów obserwowanych u ludzi, przeto w czasie pokoju możemy nawet spodziewać się dodatnich wyników badań w zakresie terapji doświadczalnej, które niestety obecnie są prawie że ledwie rozpoczęte.
ANATOMJI PATOLOGICZNEJ ZATRUĆ BOJOWYCH.
Zmiany anatomiczne, wywołane przez zatrucia środkami bojowemi są zależne tak od stężenia trucizny w powietrzu, jak również od trwałości wywołanej przez to zatrucie choroby. Z tego punktu widzenia rozróżniano wypadki natychmiastowej śmierci, która następuje w ciągu pierwszych 3 dni i śmierci odległej, która następuje później i jest zwykle zależna od pewnych powikłań, przeważnie charakteru zakaźnego.
W razie użycia nie absolutnie zabójczych, czyli tak zwanych względnie zabójczych, stężeń trucizny obserwujemy nagły zgon tylko najczulszych jednostek. Wśród pozostałych pewna część
będzie ofiarą powikłań i umrze w ciągu następnych dni, u jednostek zaś pozostałych przy życiu spotkamy szereg patologicznych zmian, które po upływie pierwszego okresu zatrucia przybierają charakter reparacyjnych. Takie zmiany można zauważyć w narządach wyzdrowiałych jednostek, specjalnie zabitych po upływie odpowiedniego terminu po zatruciu
Zależność przebiegu zatrucia od stężenia trucizny występuje wyraźnie w graficznych zestawieniach (diagramach) licznych doświadczeń Underhilla poczynionych przy zatruciu psów chlorem (172 psy), fosgenem (327 psów) i chloropikryną (219 psów). W tych diagramach wysokość pasków (rzędnych) oznacza stosunek pomiędzy nagłemi zgonami (czarna część), odległemi zgonami (część kreskowana) i wypadkami wyzdrowienia (część biała). Odległość paska w kierunku wagowym od punktu O (odcięte) oznacza wzrastający stopień stężenia (w gramach na M³).
Wszystkie doświadczenia trwały 30′ i były wykonane razem na znacznej ilości psów w dużej komorze gazowej.



Ognisko martwicy tkanki płucnej powstałe jako skutek zatrucia chlorem o dużem stężeniu. Płuca zdechłego psa w trzy godziny po doświadczeniu. Wśród mniej więcej normalnej tkanki płucnej, naokoło zupełnie zniszczonego oskrzelika, z którego pozostały same resztki w postaci kawałeczka śluzówki u brzegu byłego światła, ścianki pęcherzyków płucnych są zgrubiałe, pozbawione jądr komórkowych i zabarwione mocniej niż nieuszkodzona tkanka. Światła pęcherzyków w miejscu uszkodzenia jak również obok niego są napełnione masami strąconego białka.

Martwica śluzówki małej oskrzeli przy zatruciu chloropikryną. Płuca zdechłego psa na drugi dzień po zatruciu. Tkanka płuc mocno przekrwiona. W świetle pęcherzyków obfity osad włóknika w postaci nici. W oskrzeli śluzówka jest całkiem zniszczona i z jej ścianki pozostała sama tkanka łączna, zawierająca dużą ilość białych komórek krwi. W świetle oskrzelika jest obecny osad białka w postaci ziarnek i włókien.

Toksyczna rozedma i niedodma płuc u kota zatrutego fosgenem. Pęcherzyki płucne najbliższe do opłucnej są w znacznym stopniu rozdęte, granice ich są nieregularne wskutek pęknięcia ścianek, powodującego powstanie dużych jam przez zlanie się kilku pęcherzyków razem. Pośrodku ognisko zupełnej niedodmy naokoło dużych naczyń krwionośnych. Zmniejszone pęcherzyki są napełnione ziarnistą masą powstałą z płynu obrzękowego.

Zakorkowanie oskrzeli przez kawałki oddzielonej śluzówki górnych części dróg oddechowych, przy zatruciu chlorem. Płuca psa zdechłego na drugi dzień po zatruciu. W świetle małej oskrzeli, której śluzówka też jest prawie całkiem usunięta, znajduje się kłębek z resztek błonki śluzowej, zawierający jeszcze niezmienione jądra. Tkanka płucna w otoczeniu jest mało dotknięta i znajduje się w stanie obrzęku.

Blizna tkanki płucnej w miejscu byłego stałego zatknięcia oskrzeli. Tkanka łączna z grubemi włókienkami w sąsiedztwie z rozszerzoną oskrzelą, której światło napełniono masą składającą się ze zmienionej ropy. Płuca psa zabitego po upływie dwóch miesięcy po zatruciu chlorem.

a) Toksyczne zapalenie płuc typu zrazowego po zatruciu chlorem. Płuca psa zabitego po upływie 6 godzin po zatruciu. Ścianki pęcherzyków są zgrubiałe wskutek obrzęku i mocno przekrwione. W świetle pęcherzyków jak również w ich ściankach obfita ilość nici włóknika.
b) Toksyczne zapalenie płuc typu zrazikowego po zatruciu chlorem. Płuca psa zdechłego po upływie czterech godzin po zatruciu. Nagromadzenie białych komórek w świetle i ściankach oskrzelika. Nieznaczna ilość włóknika w świetle pęcherzyków.

Rażenie surowiczne (Apoplexia serosa) jako skutek zatrucia fosgenem. Płuco psa zdechłego po upływie 3 godzin po zatruciu. Prawie wszystkie pęcherzyki są napełnione szklistą masą strąconego białka osocza krwi. Tylko w niektórych częściowo znajduje się zwyczajny ziarnisty osad. Ścianki pęcherzyków są nieco zgrubiałe wskutek obrzęku.

Schemat uszkodzeń śluzówki tchawicy jako podstawa pośmiertnej diagnozy zatruć bojowych.
a. Zatrucie chloropikryną. Zniszczenie górnej warstwy komórek nabłonkowych. Śluzówka pozostaje w łączności z podśluzówką.
b. Zatrucie fosgenem. Śluzówka pozostaje całkiem niezmieniona; nawet pozostają niuszkodzone rzęski migawkowe.
c. Zatrucie chlorem. Martwica śluzówki i oddzielenie się jej od podśluzówki.

Klatka piersiowa kota zatrutego dużą dawką chloropikryny. Śmierć natychmiastowa. Górny i dolny zraz lewego płuca zabarwione na bronzowo wskutek tworzenia się methemoglobiny. Ogólne przekrwienie płuc.

Skutki zatrucia arsenjakiem.
a. Kanaliki moczowe z substancji rdzeniowej nerki psa, przed dwiema dobami zatrutego arsenjakiem. W świetle kanalików ziarnista masa methemoglobiny.
b. Komórki Kupfera przeładowane hemosideryną z wątroby psa zdechłego wskutek zatrucia arsenjakiem.

Oparzenie skóry iperytem. Skutki działania 0,001 iperytu na skórę ludzką: a) biała plamka otoczona czerwono-sinawym paskiem powstała po upływie 4—6 godzin po oparzeniu, b) powstanie naokoło tej białej plamki wieńca z pęcherzyków; c) duży pęcherz powstały przez połączenie tych pęcherzyków na całej przestrzeni oparzenia; d) wrzód powstały po pęknięciu pęcherza.

Oparzenie luizytem skóry psa. a) Martwica naskórka w postaci białej plamy otoczonej czerwonym paskiem, natychmiast po oparzeniu (działanie kropelki luizytu trwało 30′); b) zmiany na 2 do 4 dni — wysychanie ośrodka zmartwiałej powierzchni naskórka; c) zmiany na 5 do 10 dni — oddzielenie zmartwiałej części skóry, tworzenie się suchego puklerzyka, d) zmiany na 10 do 20 dni — oddzielenie się puklerzyka od spodu wrzodu przez tworzenie się tkanki ziarninowej; e) wrzód powstały na miejscu odpadłego puklerzyka; f) gojenie się wrzodu. Sierść na miejscu oparzenia została zabarwiona na biało, wskutek zaniku komórek barwnikowych.

Skorowidz zawiera nazwy chemicznych środków bojowych razem ze wzorami chemicznemi, wszystkiemi synonimami i oznaczeniami maskującemi (kamuflażowemi), które przytoczono też oddzielnie z podaniem zwykłych oznaczeń danego środka. W wypadku gdy dany środek omówiono w tekście, w skorowidzu podano odpowiednie strony książki. Kursywą oznaczono tę stronę, gdzie dany środek rozpatrzono dokładniej. Ponadto uwzględniono oznaczenia właściwości fizykochemicznych, cechy fizjologiczne i określenia co do sposobu użycia w celach bojowych. Wreszcie podano wskazówki tyczące się czasu i miejsca zastosowania poszczególnych środków.
O środkach nie omówionych zupełnie lub omówionych nie dość dokładnie, zasadnicze dane uwzględniono tylko w skorowidzu.
Na oznaczenia właściwości poszczególnych środków użyto następujących skrótów:
p. w. — temperatura wrzenia przy ciśnieniu 760 mm Hg (w razie specjalnych warunków — obniżonego ciśnienia — stopień jego podano w nawiasach);
d — ciężar gatunkowy (w stosunku do wody);
p. t. — punkt czyli temperatura topliwości;
d/p — ciężar gatunkowy w stosunku do powietrza.
Właściwości toksykologiczne oznaczono w następujący sposób:
D — oznacza środek używany jako duszący czyli wywołujący anatomiczne zmiany narządów oddechowych. (D) — środek uszkodzający płuca, lecz do tego celu nie używany.
Dr — oznacza środek drażniący czyli odruchowy. Rodzaj odruchu oznaczono — Dr. d. g. — drażniący górne drogi oddechowe; Dr. d. d. — drażniący dolne drogi i płuca; Dr. St. — sternit czyli środek wywołujący kichanie; Dr. L. — lakrymator czyli środek łzawiący; Dr. V. — womitator czyli środek powodujący wymioty.
T. s. — oznacza truciznę skórną. Podana liczba oznacza największe rozcieńczenie (w alkoholu etylowem), które jest jeszcze czynne w stosunku do człowieka (c) lub konia (k).
T. o. — oznacza truciznę o działaniu ogólnem.
G. w. — oznacza próg wrażliwości — najmniejsze stężenie czynne dla człowieka. G. n. — próg napastliwości — stężenie powodujące wyraźne objawy zatrucia, względnie odpowiedni odruch, zależny od właściwości trucizny. Gn. d. g. — granica napastliwości dla górnych dróg oddechowych. Gn. d. d. — granica napastliwości dla dolnych dróg oddechowych.
St. w. ś. — stężenie względnie śmiertelne, oznacza stężenie w gramach na sześcienny metr powodujące śmierć pewnej ilości zatrutych istot, niezależne od czasu ubiegłego od chwili zatrucia.
St. a. ś. — stężenie absolutnie śmiertelne oznacza takie stężenie, które wywołuje śmierć w ciągu pierwszych 24 godzin po zatruciu; d. let. (dosis letalis) — śmiertelna dawka.
Czas wprowadzenia danego środka dla celów bojowych oznaczono przez arabskie cyfry na oznaczenie roku i rzymskie podające miesiące.
Wszystkie środki wprowadzono pomiędzy 1914 i 1918 rokiem, dlatego na oznaczenie roku podano tylko dwie ostatnie cyfry. Państwa które używały danego środka oznaczono w następujący sposób:
N — Niemcy,
F — Francuzi,
A — Anglicy,
Am — Amerykanie,
W — Włosi,
R — Rosjanie.
Środki istotnie używane w większych ilościach podczas wojny światowej wyróżniono przez wydrukowanie nazwy tłustym drukiem. Przy nazwie podano oznaczenie sposobu zastosowania: F — fala gazowa lub P — (bomba).
Środki nie mające praktycznego znaczenia oznaczono przez druk petitem.
Co do nazw maskujących trzeba podkreślić, iż po pierwsze te nazwy oznaczają zwykle nie czyste substancje a produkty techniczne lub mieszaniny, których zasadniczym składnikiem jest dany związek, a po drugie, iż niemieckie nazwy oznaczają nietylko sam środek bojowy lecz również i cel zastosowania.
Służą one jako oznaczenia odpowiednich gatunków pocisków, których zawartość zmieniała się nawet stopniowo z biegiem wojny.
I tak przez zielony krzyż oznaczano pociski zawierające środki duszące (przeważnie Perstoff czyli superpalit); przez błękitny krzyż pociski ze środkami drażniącemi (przedewszystkiem sternitami); przez żółty krzyż ze środkami posiadającemi właściwości długotrwałego działania, więc zwykle napełnione iperytem z temi lub innemi domieszkami.
Chemiczne środki bojowe powstałe już po skończeniu wojny, ale posiadające takie właściwości, które tworzą z nich prawdopodobny oręż przyszłości, wyróżniono gwiazdką * umieszczoną przed nazwą.
Acetonitril CN3 CN. 257
Bezbarwny płyn z eterycznym zapachem, p. w. 81, 4°; p. t. — 41° St. w. ś. 6/M3
Aconitum 263. Tojad. Cały szereg gatunków tojadu, z których najlepiej znany jest błękitny tojad Aconitum Napellus. Spotyka się w górach środkowej Europy. Wszystkie te rośliny zawierają alkaloidy podobne do akonityny (Z Ac. Napellus) C34H47NO11, jednej z trucizn najmocniejszych ze znanych wogóle. Dawka bezwzględnie śmiertelna dla człowieka od 0,003, dla konia 0,004.
* Adamsyt P. francuska nazwa maskująca = chlorek fenilarsazyny = dwufenyloamino chloroarsyna Dr. St. 211, 220, 223.
Akonityna 263. Szereg bardzo do siebie podobnych alkaloidów z rozmaitych gatunków Aconitum, mianowicie: A. Napellus, A. Lycoctonum, A. ferox, A. chasmanthum, A. spicatum i A Fischeri. Są wszystkie one połączeniami zasadniczego ugrupowania C21H29NO5 lub C21H27NO4, z kilku ugrupowaniami metoksylowemi O, CH i organicznemi kwasami. Najczynniejszą trucizną jest pseudakonityna z Aconitum ferox (Azja środkowa).
Akroleina P. CH2:CH. COH.
93, 94. 125, 176, 178, 182, 198, 207, 209, 210. Aldehyd akrylowy. Papite (francuska nazwa maskująca).
P. w. 52°,4; d. 1,3; d/p 1,9. Rozpuszcza się w wodzie w stosunku 1:2. D.; Dr. d. g.; Dr. d. d.; Dr. L.; T. o.; G. w. 0,001/M3, G. n. 0,025/M3; St. w. ś. 0,25/M3 (królik). St. a. ś. 0,5/M3 (pies, królik, świnka morska) F. 16.X.
Aldehyd akrylowy p. Akroleina.
Aldehyd krotonowy CH3.CH: CH.COH 182, 198.
Płyn rozpuszczalny w wodzie o żrącym zapachu; p. w. 104°. Proponowany w r. 1916 we Francji.
Aldehyd mrówczany H.COH. 182, 198.
Formaldehyd. 40% rozczyn w wodzie nazywa się formolem czyli formaliną.
Gaz, p. w. -27°. Dr. d. g.; Dr. L. G. n. 0,025/M3. Do celów wojennych nie używany.
Amoniak NH 182, 184.
Bezbarwny gaz łatwo rozpuszczający się w wodzie w stosunku 1305: 1 (w t°0°); d/p (0°) 0,596 d. płynnego NH3. 0,639; p. w. -33,5; p. t. -77. St. w. ś. 200/M3; G. n. 0,5/M3. NB chloraminy.
Anczar — 20.
Drzewo z flory Indyj wschodnich, którego sok zawiera najmocniejszą z trucizn sercowych antiarinę. Soku tego używali Malajczycy do zatrucia strzał.
Aphonite francuska nazwa maskująca = bezwodnik kwasu siarkawego SO2.
Aquinite F.P. francuska nazwa maskująca = chloropikryna C(NO2)Cl3.
Arseniak = arsenowodor Ash3. 46, 94, 243, 251.
Bezbarwny gaz d/p 2, 8; p.w. -55; p.t. -113, 5. Wyraźnie pachnie czosnkiem w znikomych rozcieńczeniach. St. w. s. 0,07/M3. St. a. ś. 1,5/M3 (psy), 0,2/M3 (koty), 0,5/M3 (króliki), 0,1/M3 (świnka morska) T. o. Jako środek bojowy nie używany.
Arsyny pochodne arsenowodoru o wzorach: AsH2R; AsHR’2; As’R3. Związki metylowe i etylowe są gazami o właściwościach AsH3, lecz mniej trujące. 251.
Atropa belladona. Wilcza jagoda. Europejska roślina dość pospolita w lasach górskich. 263
Atropina C17H23NO3. 263. Czynny składnik całego szeregu jadowitych roślin z rodziny Solanaceae. Białe, przezroczyste kryształy; p. t. 115°. Jadowitość waha się znacznie, zależnie od gatunku użytych zwierząt. Dawka bezwzględnie śmiertelna dla człowieka 0,002 na kg.
B. Stoff. P. Niemieckie oznaczenie maskujące dla bromoacetonu CH2Br CO. CH3.
B. n. Stoff P. Niemieckie oznaczenie maskujące dla bromoetylometyloketonu CH2Br CH2CO.CH3.
Bertolite F francuska nazwa maskująca dla chloru Cl2.
Bezwodnik kwasu siarkawego F SO2. 188, 206. Aphonite (fran. nazwa maskująca).
Bezbarwny gaz, d/p 2.264; p. w. 8°; p. t. -72,1; d. płynnego SO2 1,46. St. w. ś. 2/M3. Składnik gazu Claytonowskiego D. N. 14.
Bezwodnik kwasu siarkowego. SO3 183, 185, 205. Krystaliczne ciało p. t. 14°,8; p. w. 46°; d (16°) 1,94; d (0°) 2,01; d/p. 2,77. Rozczyn w H2SO4 jest oleum. Amerykański dym bojowy.
Blaukreuz P (oznaczenie maskujące niemieckie). Mieszanina chloroarsynów z rozczynnikami i substancjami wybuchowemi (D) Dr. St.
Blaukreuz 1. P. Mieszanina dwufenylochloroarsyny z trotylem lub mieszaniną 55% dwufenylochloroarsyny z 45% etylokarbazolu. Blaukreuz 2 — sama dwufenylochloroarsyna.
Blotite nieużywana nazwa maskująca francuska dla bromoacetonu (martonite).
Bretonite francuska nazwa maskująca dla chlorojodoacetonu CH2 Cl CO CH2 I.
Brom Br2. Ciemnoczerwony płyn z żrącym zapachem, dający gęstą parę na powietrzu. p. w. 63°; p. t. -7°,3; d (0°) 3,18; d/p 5,5. St. a. ś. 10/M3 (pies). D. Dr. d. g. Zastosowany jako domieszka do chloru w falach gazowych 15 — 16 N.
Bromek benzylu P. C6 H5 CH2 Br 125, 176, 209, 212, 230.
Cyklite (oznaczenie maskujące francuskie). Benzylbromid, p. w. 198° — 201°; p. t. -3,9, d/p 6; d 1,43. D, Dr. L.; G. w. 0,0025/M3; G. n. 0.005/M3.
Typowy środek łzawiący, służący jako jednostka porównawcza. 15 III N.
Bromek cyjanu P CNBr 215.
Kampellite — maskujące oznaczenie austrjackie.
Krystaliczne bardzo lotne ciao, p. t. 52°; p. w. 61°,3; d. 2,01; St.a. ś. 1/M3 (królik, pies), 0,75/M3 (świnka morska); G. n. 0,075/M3. D. Dr T. o.; T. s. 17 XII. i 18 VI. Aus.
Bromek kakodylu — Dwumetylobromoarsyna 220.
Bromek ksylilu P. C6 H4 CH3 CH2B (orto)
102, 125, 209, 214.
Xylilbromid. T — Stoff (maskująca nazwa niemiecka), p. w. 215°; p. t. 21°. Krystaliczne ciało. Dr. L; G. w. 0,0018/M3; Gn. 0,1/M3. St. a. ś. 4/M3. 15 I N.
Bromoaceton P. CH3CO.CH2Br.
125, 176, 207, 209, 210.
B. Stoff (oznaczenie maskujące niemieckie) Blotite (oznaczenie maskujące francuskie) Martonite (oznaczenie maskujące francuskie dla mieszaniny 80% bromoacetonu i 20% chloroacetonu), p. w. 186,51,7 p. t. -54; d/p 4,7; G. w. 0,00061/M3; G. n. 0,04/M3; St. a. ś. 0,5/M3 (królik). D. Dr. d. g. D. L. 15 VII N. 16 F.
Bromocyjanek benzylu P. C6 H5 CHCNBr.
125, 209, 214.
Brombenzylcyjanid. Cyjanek bromobenzylu. Nitril kwasu fenylobromoctowego. Kamit (oznaczenie maskujące francuskie i amerykańskie). Płyn, w niskiej t° krystaliczne ciało. Posiada przyjemny zapach. Najmocniejszy z lakrymatorów. (D) Dr. L. p. w. 231°,7; p. t. 29°; d 1,54
G. w. 0,00035/M3; Gn. 0,007/M3; St.w. ś. > 2/M3 16. F 18 Am.
Bromoetylometyloketon P CH3. CO. CHBr CH3 176, 178.
Bn Stoff (niemieckie oznaczenie maskujące) Homomartonite (francuskie oznaczenie maskujące) D.; Dr. L.; p. w. 133; d/p 5,2. Płyn nierozpuszczalny w wodzie. G. n. 0,2/M3. St. w. ś. 0,25/M3 (pies, królik); St. a. ś. 1/M3 (pies, królik) 15.VIII N.
Bromofosgen COBr2 182.
D; Dr. d. g. Środek mniej czynny niż fosgen. W celach bojowych nie używany;
p. w. 64°; d. 2,45; G. w. 1,3M/3; G. n. 2/M3 (działa na dolne drogi oddechowe). St. a. ś.> 2/M3 (pies).
Bromooctan etylu CH2Br.COOC2H5 214. Mało napastliwy środek łzawiący. F. (policyjny).
Bromopikryna C (NO2) Br3. Trojbromonitrometan.
Stałe krystaliczne ciało z p. t. 10°,26, wyżej tej temperatury płyn z p. w. 127° (18 mm Hg) i d 2,8. Posiada wyraźny żrący zapach. D.; Dr. d. g; Dr. d. d; G. w. 0,03/M3; G. n. 1/M3. St. a. ś.
1/M3 (świnka morska), 4/M3 (królik). Wyraźny obrzęk płuc podobny do wywołanego fosgenem. Jako środek bojowy nieużywany.
Butylmerkaptan C4 H9 SH 215.
Bezbarwny płyn d. 0,858; p. w. 97°. Posiada okropny zapach i jest najmocniej pachnącą ze wszystkich znanych substancyj. Zapach ten daje się zauważyć w rozcieńczeniach 6.10-6. Jest czynnym składnikiem wydzielin gruczołów śmierdźla (Mephitis mefitica). Napastliwość jego jest bardzo nieznaczna.
Cantharite, maskujące oznaczenie francuskie surowego produktu powstającego przy działaniu chlorków siarki na etylen. Produkt ten składa się przeważnie z siarczka dwuchloroetylowego (iperytu). F 18.
Cedenite P. (maskujące oznaczenie francuskie) 125, 209, 230 = chlorek nitrobenzylu (orto z domieszką para) NO2 C6H4CH2Cl z domieszką 10 — 15%% chlorku dwunitro benzylu (NO2)2 C6H3CH2Cl. Fr 16 IX.
Chlor. F. g. Cl2. 79, 93, 94, 96, 102, 108, 116, 172, 176, 178, 182, 184, 200, 211. Bertolite — oznaczenie maskujące francuskie.
Zielonożółty gaz; d/p 2,45. Prężność pary 0° = 3,7 atmosfer; 22° = 7 atmosfer; 100° = 41,7 atmosfer; p. w. -33,5; p. t. -102°. Krytyczna temperatura 147°; d. płynnego chloru w t° 0° 1,46. G. w. 0,003/M3 G.n. 0,150/M3. St. w. ś. 2,5/M3. St. a. ś. 6 — 10/M3. 15 IV. N. Czysty chlor w postaci fal. W roku 1916 używano mieszanin chloru z bromem i fosgenem (N), chloropikryną (N, An), siarkowodorem (An) i superpalitem (N).
Chloroaminy. F.
NH2Cl; NHCl2; NCl3.
Połączenia chloru z suchym amoniakiem (w obecności wody powstaje chlorek amonu NH4Cl). Używane (F) celem podniesienia czynności fal chlorowych i do wytworzenia dymu z NH4Cl, powstającego w wilgotnem powietrzu.
Chlorek antymonu p. Trójchlorek antymonu SbCl3. 205.
Chlorek arsenu p. Trójchlorek arsenu AsCl3. 172, (205) 210.
Chlorek benzylu P C6H5CH2Cl. 209. 212.
Bezbarwny płyn o mocnym drażniącym zapachu. D.; Dr. d. g.; Dr. L.; p. w. 179°; p. t. -43°,2; d. 1,11 F 16. Używany jako lakrymator narówni z bromkiem benzylu.
Chlorek chromilu Cr O2Cl2. 182. 207.
Ciemnoczerwony płyn, łatwo podlegający hydrolizie. Niezły dym bojowy. D. Dr.; p. w. 117°; d. 1,9; G. n. 0,08 — 0,1/M3; St. w. ś. 4/M3. 16 V Fr.
Chlorek cyjanu. Chlorocyjan P CNCl. 215.
Mauginite — francuskie oznaczenie maskujące. Lotny bezbarwny płyn, p. w. 12°,7; p. t. -6°; d (0°) 1,22; d/p 2,19. Łatwo się polymeryzuje, dając krystaliczny (CNCl)3; G. n.> 0,05/M3; St. a. ś. 0,3/M3, 16 VII F. Aus.
Chlorek cyny = Czterochlorek cyny Sn Cl4. 182 204.
Opacite francuskie oznaczenie maskujące.
Bezbarwny, dymiący na powietrzu płyn. Jeden z najlepszych dymów bojowych. Mało napastliwy aż do stężenia 0,2/M3; p. w. 114°; p. t. -33; d. 2,23; d/p 9,2. 15 F. N. An. R.
Chlorek dwuanizydyny P Ni Stoff (CH3O) (NH2) C6H3. H3C6 (NH2) (CH3O). 2HCl. 207. 218.
Proszek o wyraźnych drażniących własnościach. Pierwszy z szeregu chemiczny środek bojowy D. Dr. St. 14 N. G. n. 2/M3.
Chlorek dwufenyloarsyny = dwufenylochloroarsyna.
Chlorek dwumetyloarsyny = dwumetylochloroarsyna = chlorek kakodylu.
Chlorek fenyloarsazyny = dwufenyloaminochloroarsyna = adamsyt. NH (C6H4)2 As Cl.
Chlorek fenylokarbyloaminy P C6H5NCCl2 feniloimidofosgen.
Żółty płyn z zapachem cebuli, p. w. 210°; d 1,30. G. n. 0,2/M3; St. w. ś. 0,5/M3; St. a. ś. 6/M3. Wywołuje poważne anatomiczne uszkodzenia płuc. 18 N.; Dr. d. g.; T. s.; Dr. L.
Chlorek kakodylu = dwumetylochloroarsyna 219.
Chlorek krzemu = czterochlorek krzemu SiCl4 182. 205.
Chlorek pyrosulfurylu S2O5Cl2. 183.
Bezbarwny płyn, p. w. 151°; d. 1,844. D.
Chlorek siarki S2Cl2 182, 183.
Ciemnożółty oleisty płyn nieco dymiący na powietrzu i drażniący oczy, p. w. 138°; p. t. -80; d. 1,71. Przy dalszem chlorowaniu powstaje w temperaturze 0° : SCl2 i w temperaturze -25° -30° : SCl4, ciemno czerwonobronzowe płyny, przy podniesieniu temperatury rozkładające się na S2Cl2 i chlor. Mieszaniny chlorków siarki używano we Francji pod nazwą maskującą Vulkanite. Działanie jej nie różni się od działania chloru. Jako środek bojowy mało skuteczny.
Chlorek sulfurylu SO2Cl2 182, 206.
Bezbarwny płyn, p. w. 69°; d. 1,67; d/p 4,7 D. Dym bojowy, St. w. ś.> 2/M3 15. F.
Chlorek tytanu TiCl4 = czterochlorek tytanu 282, 285. Fumigerite (francuskie oznaczenie maskujące). Dym bojowy.
* Chloroacetofenon ClCH2CO.C6H5, 123, 209, 212, 217.
Grandite (francuskie oznaczenie maskujące). Krystaliczne ciało o drażniącym zapachu;
p. t. 59°; p. w. 245°. G. w. 0,00062/M3; G. n. 0,00124/M3. Mało trujący.
Chloroaceton P ClCH2CO.CH3. 21, 102, 125, 207, 209, 212, 216.
Tonite (francuskie oznaczenie maskujące);
p. w. 119°; d/p 3,7; d. 1,16; G. w. 0,02/M3. G. n. 0,4/M3;St w. ś. 4/M3; St. a. ś. 10/M3. D. Dr. L. 15 III N.
Chlorobezwodnik kwasu siarkowego SO2Cl2 = chlorek sulfurylu. 182, 206.
Chlorojodoaceton CH2I CO. CH2Cl. Bretonnite (francuskie oznaczenie maskujące) Dr. L.
Chloromrówczan chlorometylu P ClCO2CH2Cl. 11, 18, 93, 176, 178, 182, 190, 191, 196, 207, 210, 211. Palite (oznaczenie francuskie) K Stoff. C Stoff (oznaczenie niemieckie). Bezbarwny płyn o mocnym zapachu, innym niż fosgen, d. 1,236; p. w. 71,4; d/p 4,5. G. n. 0,06/M3. St. a. ś. 1/M3 (pies) D. Dr. g. d. 15 VIII N.
Chloromrówczan metylu Cl CO2CH3. 210. G. n. 0,005/M3 Dr. d. g. St. w. ś.> 4/M3.
Chloromrówczan trójchlorometylu P Cl.CO2CCl3 94. 102, 182, 210.
Difosgen. Dwufosgen. Superpalit. Surpalite (maskujące oznaczenie francuskie). Perstoff, Grünkreuzstoff (maskujące oznaczenie niemieckie).
Bezbarwny płyn, p. w. 128; d/p 6,9. G. n. 0,25/M3; St. w. ś. 0,5/M3; St. a. ś. 4/M3 (pies, królik) 16 V N.
Chloronitrobenzyl P NO2C6H4CH2Cl. Dr. L. T. s. 125. 209. Cedenite (francuskie oznaczenie maskujące).
Krystaliczne ciało z p. t. 49°; Dr. T. s. G. w. 0,0018/M3 Gn. 0,0036/M3 Wywołuje natychmiast oparzenie skóry. F. 16.
Chloropikryna F. P. C (NO2)Cl3
11, 93, 94, 96, 109, 115, 125, 136, 171, 172, 182, 196, 199, 207.
Nitrochloroform, nitrotrójchlorometan. Aquinite (maskujące oznaczenie francuskie). Vomiting gaz (oznaczenie angielskie). Klop (oznaczenie niemieckie) Grünkreuz (oznaczenie niemieckie pocisków).
Bezbarwny lotny płyn o mocnym drażniącym zapachu; p. w. 113°; p. t. -69°; d 1,692; d/p 5,7. G. w. 0,019/M3; G. n. 0,06/M3. St. w. ś. 0,25/M3; St. a. ś. 0,5/M3 (pies) D. Dr. L. Dr. V. 16 XII. W, 17. F, A, Am, N.
Chlorosiarczan chlorometylu ClSO2.OCH2Cl. Survaillantite (oznaczenie francuskie). Środek duszący, mniej czynny niż chlorosiarczan metylu.
Chlorosiarczan etylu P ClSO2OC2H3 176, 178, 182.
Sulvinite (oznaczenie maskujące francuskie).
Dymiący w powietrzu ciężki płyn; p. w. 154°; d. 1,263. St. w. ś. 6/M3 (królik); D. Dr. L. F. 15.
Chlorosiarczan metylu P Cl.SO2.OCH3 94, 96, 182.
Vaillantite (maskujące oznaczenie francuskie). Bezbarwny płyn o ostrym zapachu, p. w. 132°; d/p 4,5; G. n. 0,04/M3; St. w. ś. 2/M3 St. a. ś. 4/M3 (królik) 15 VII N.
Chlorosiarczan trójchlorometylu Cl. SO2 OCCl3.
Stałe ciało z p. t. 135°, którego napastliwość jest bardzo znaczna stosownie do wielkiej lotności. Jest związkiem bardzo trwałym w obecności pary wodnej.
Chlorosiarczek węgla CSCl2 = tiofosgen.
Chlorowinylodwuchloroarsyna 234 C2H2Cl As Cl2 = luizyt.
Clairsite P. (francuskie oznaczenie maskujące). Produkt chlorowania 1 części CS2 1,5 częściami chloru, zawierający mieszaninę tiofosgenu CSCl2, trójchlorometylomerkaptanu CCl SH, perchlorometylomerkaptanu CCl3SCl, czterochlorku węgla CCl4, chlorków siarki i innych domieszek. 15. F.
Clark — niemieckie oznaczenie maskujące dla dwufenylochloroarsyny (C6H5)2 Cl. As.
Clark I niemiecka nazwa maskująca dla mieszaniny dwufenylo chloroarsyny i dwuchlorofenyloarsyny.
Clastite — francuskie oznaczenie maskujące dla N2O5, bezwodnika kwasu azotowego (środek wybuchowy), który przy rozkładzie staje się źródłem tlenków azotu.
Collongite — francuskie oznaczenie maskujące dla fosgenu COCl2
Curcasoil — olej kurkasowy. Tłuszcz z nasion amerykańskiej rośliny Jatropha Curcas, posiadający mocno drażniące właściwości, podobne do oleju krotonowego. 229.
Cyjanek dwufenyloarsyny = dwufenylocyanoarsyna. (C6H5)2CNAs 220.
Cyjanek kakodylu = dwumetylocyjanoarsina. As (CH3)2. CN 210, 219, 220.
Stałe krystaliczne ciało, p. t. 33°; p. w. 140°.
Cyklite francuskie oznaczenie maskujące dla bromku benzylu C6H5CH2Br.
Czemeryca 217. Proszek z suszonego korzenia rośliny Helleborus niger. Starożytny środek do wywoływania kichania.
Czterochlorek krzemu SiCl4. (dym bojowy) 182 (205). Bezbarwny płyn, p. w. 59°,3; p. t. -89; d 1,52. Dość słaby obojętny dym maskujący. Używano go jako domieszki do lakrymatorów w granatach ręcznych. Posiada swoisty drażniący zapach.
Czterochlorek siarczku węgla P. CSCl4=CCl3.SCl. Perchlorometylomerkaptan. Tetrachlorkohlenstoff; p. w. 149°, d/p 6,5. Ciemnobronzowy płyn. D. Dr. d. g. 15. R. F. Mało skuteczny środek.
Czterochlorek tytanu TiCl4 (dym bojowy) 182, 205. Fumigerite (francuska nazwa maskująca). Bezbarwny płyn, mocno załamujący światło, dymiący na powietrzu; p. w. 136,4. Jest dość obojętny. Mniej dodatni jako dym w porównaniu do SnCl4 i SiCl4 (Fries) Am. F.
Czterochlorek węgla CCl4. Bezbarwny ciężki płyn o woni podobnej do chloroformu; p. w. 76,5; d 1,631.; p. t. -24. Używany jako rozczynnik dla pewnych środków bojowych (iperytu).
Datura Stramonium. Dziedzierzawa. 263. Pospolity chwast o dużych białych kwiatach i iglastych owocach. Inne niemniej jadowite gatunki Datura są rozpowszechnionemi kwiatami ogrodowemi.
Deissite francuskie oznaczenie maskujące dla siarczku węgla CS2.
Duguesnite (francuska nazwa maskująca) mieszanina pięciochlorku fosforu PCl5, chlorotlenku fosforu POCl i czterochlorku cyny SnCl4. Napastliwy dym bojowy.
Dwuanizydyna p. chlorek dwuanizydyny.
Dwubromek benzylu 214.
Dwubromek ksylilu 214.
Dwubromoetyloarsyna P. C2H5As.Br2. 210 Grünkreuz B (w ostatnich czasach wojny Gelbkreuz 1) (oznaczenie niemieckie). Oleisty płyn;
p. w. 192°. Dr. St. N 18. Posiada mniej drażniące właściwości niż dwuchloroetyloarsyna i dlatego mało używana.
Dwuchlorek fenyloarsyny p. dwuchlorofenyloarsyna C6H5AsCl2 46. 219. 220.
Dwuchlorek siarki SCl2 p. Chlorek siarki.
Dwuchloroaceton (sym.) CH3Cl.COCH2Cl. 229 Płyn, p. w. 120 — 123° d 1,402 G. w. 0,08/M3 = 0,7 w porównaniu z bromkiem benzylu. T. s. Dr. L.
Dwuchloroetyloarsyna P. C2H5AsCl2 210, 219, 220.
Gelbkreuz 1, Grünkreuz 3 (oznaczenie maskujące niemieckie).
Płyn pachnący czosnkiem. Dr. St.; T. s.; p. w. 156°; d 1,68; G. w. 0,0015/M3; G. n. 0,07/M3; St. w. ś. 0,25/M3; St. a. ś. 1/M3. N IV 18.
Dwuchlorofenyloarsyna P. C6H5Cl2As 46, 219, 220 Sternite (francuskie) Clarke 1. Blaukreuz 1 (oznaczenie maskujące niemieckie). Bezbarwny płyn p. w. 252°, d 1,64, G. n. 0,01/M3; T. s. Używana jako rozczynnik dla stałych dwufenylochloroarsyny lub dwufenylocyjanoarsyny przy napełnianiu pocisków. N IX 17.
Dwuchlorometyloarsyna CH3AsCl2. Bezbarwny płyn; p. w. 134°. T. s.; Dr. St. 17 F.
Dwuchlorowinylochloroarsyna (ClCH2:CH2)2 AsCl = luizyt b 234.
*Dwufenyloaminochloroarsyna P.
| NH< | C6H4 C6H4 |
>AsCl. 220, 223. |
Adamsyt (francuska nazwa maskująca) = chlorek fenyloarsazyny. W czystym stanie bladożółte krystaliczne ciało z p. t. 194°. Preparat techniczny jest zielonawym proszkiem z p. t. 190 — 192° G. w. 0,0001/M3. G.n. 0,0004/M3 St. w. ś. 0,0004/M3. Dr. St.; Dr. d. g.; F. Am. 18.
Dwufenylochloroarsyna P. (C6H5)2 ClAs 211, 219, 220. Blaukreuzstoff. Clarke. Sternit (nazwy maskujące). Stałe krystaliczne ciało p. w. 333°; p. t. 38° — 44°; d 1,4; G. n. 0,0025/M3. Dr. St.; T. s. 18 VI N.
Dwufenylocyjanoarsyna P. (C6H5)2 CN As. 219. 220. Blaukreuz 1 (niemieckie oznaczenia maskujące). Sternite (oznaczenie francuskie). Stałe krystaliczne ciało p. w. 346°; p. t. 31°,45; p. w. 255°; d 1,45; G. w. 0,000001/M3 G. n. 0,00025/M3. Najmocniejszy z używanych w czasie wojny środków drażniących. N VI 18. Dr. St.; Dr. d. g.
Dwufosgen = superpalit, chloromrówczan trójchlorometylu.
Dwumetylochloroarsyna As(CH3)2Cl 219 chlorek dwumetyloarsyny. Chlorek kakodylu. Płyn z p. w. 133°. St. a. ś. 2/M3. G. n. 0,5/M3.
Dwumetylocyjanoarsyna As(CH3)2CN 220 cyjanek kakodylu. Stałe ciało; p. w. 140°. p. t. 33°. Łatwo się sublimuje. St. a. ś. 4/M3. Na oczy nie działa. T. s.
Dymy bojowe 182, 197, 204.
Efelite francuska nazwa maskująca dla trójfluorku arsenu AsF3. Bezbarwny dymiący na powietrzu płyn; p. w. 63°; p. t. -8,3; d 2,7; d/p 4,57; St. a. ś. 4/M3. Dym bojowy. Dr. L.; T. o. 16 F.
Eter dwubromometylowy sym. P. 224 (CH2Br)2 O; p. w. 154°. Lotny płyn drażniący oczy, o zapachu chloroformu, F. 18. N. 18.
Eter dwuchlorometylowy sym. P. (CH3Cl)2 O. 224. Tlenek dwuchlorometylu. p. w. 105°. St. w. ś.>1/M3 F III 18
Etylokarbazol
| C6H4 C6H4 |
>NC2H5 |
68, 69, 70, 224.
Stałe ciało p. t. 67 — 68° p. w. (15 mm Hg) 191°. G. n. 0,2/M3. St. w. ś. 2/M3; Dr. d. g. Dr. V. T. o. (dawka śmiertelna przy wstrzykiwaniu podskórnem 0,1 na kg (pies)). Jeden ze składników niemieckiej mieszaniny Blaukreuz N. 18 N.
Excoecaria Agallocha. 263. Bardzo mało znana afrykańska roślina. Według wskazówek Lewina daje przy spalaniu trujący narkotyczny dym.
Fenyloimidofosgen = chlorek fenilokarbylaminy C6H5N:CCl2.
Ferrokarbonil Fe (CO)5 = pięciokarbonilek żelazny. 243, 244, 250.
Fluorek arsenu AsFl3 p. Efelite.
Forestite oznaczenie maskujące francuskie dla kwasu pruskiego HCN.
Fosfor. P. Biały fosfor. State krystaliczne ciało, łatwo zapalające się na powietrzu. Dym bojowy, p. t. 44,2; p. w. 287,3; d. 1,83. T. o. Śmiertelna dawka 0,01 na kg.
Fosgen F (z Cl2). P. COCl2.
Chlorobezwodnik kwasu węglowego. Collongite francuska nazwa maskująca. Grünkreuz nazwa maskująca niemiecka.
11, 16, 18, 79, 94, 96, 102, 108, 178, 182, 191, 195, 207, 210, 211.
Gaz, d/p 3,4; p. w. 8°,2; p. t. -75° d (w stanie płynu w. t. 8°) 1,432. Woda go hydrolizuje. Rozpuszczalny w toluolu. Łatwo absorbowany przez węgiel i pumeks (1,0 pumeksu pochłania 1,3 COCl2) z których zatem powoli paruje. D. Dr. d. d. Dr. L. G. w. 0,0044/M3 G. n. 0,015/M3; St. w. ś. 0,05/M3; St. a. ś. 2,5/M3 16 II F 16 XI N.
Fraissite mieszanina 50% jodku benzylu, 12,5% chlorku benzylu i 37,5% alkoholu F.
Fumige ite francuskie oznaczenie maskujące dla czterochlorku tytanu Ti Cl4.
Gelbkreuzstoff P = iperyt.
Gelbkreuz a) 80 — 90% iperytu 20 — 10% czterochlorku węgla CCl4 lub chlorku benzolu C6H8Cl; b) 77,5 iperytu i 22,5 mieszaniny eteru dwuchlorometylowego i czterochlorku węgla.
Gelbkreuz I. Rozczyn 2 — 47% etylodwuchloroarsyny w eterze dwuchlorometylowym.
Grandite francuskie oznaczenie maskujące dla chloroacetofenonu C6 H5 CO CH2 Cl.
Grünkreuz P. W początku wojny a) Perstoff (superpalit) z bromoetylometyloketonem, b) czysty bromoetylometyloketon, c) chlorek fenylokarbiloaminy (fenyloimidofosgen). W końcu wojny etylo dwuchloroarsyna 37%, etylo dwubromoarsyna 45%, eter dwuchlorometylowy 18%.
Grünkreuz 1. Perstoff 30 — 70%, chloropikryna 30 — 70%.
Grünkreuz 2. Fosgen 60% Perstoff 28%, dwufenylochloroarsyna 12% razem z odpowiednim ładunkiem trotylu.
Grünkreuzstoff czyli Perstoff = superpalit = chloromrówczan trojchlorometylu.
Helleborus niger 263 patrz Weratryna.
Homomartonite oznaczenie francuskie maskujące dla technicznego bromowanego metyloetyloketonu, zawierającego domieszkę produktów chlorowania.
Hyoscyamus muticus. Bielun algierski. 263.
Hyoscyamus niger. Bielun, pospolity chwast 263.
Jod I2 182.
Krystaliczne ciało o metalicznym błysku. Pary fioletowe. Barwi skórę na bronzowo, p. t. 114,°2; p. w. 184,°4) d. 4,66.; d/p 8,72. Pary drażnią oczy i śluzówkę nosa.
Jodek benzylu P. C6H5CH2J.
Żółty płyn lub (w czystem stanie) stałe ciało; p. t. 24°. Dr. L. G. n. 0,0015/M3 15 F.
Jodek cyjanu, jodocyjan CNI. Ciało stałe, łatwo się sublimujące; p. t. 146°; St. a. ś. 2/M3 215.
Jodoaceton CH3COCH2I. Płyn o drażniącym zapachu p. w. (7 mm. Hg) 58 — 59°; d. 2,17; St.
a. ś. 0,5/M3 Dr. L. 15 F.
Jodooctan etylu C2H5CO2CH2.I G. n. 0,0095/M3.
Mało używany środek 15. F Dr. L. 214.
Imidodwufenylochloroarsyna = adamsyt.
Iperyt. P. S(CH2CH2Cl)2.
6, 18, 26, 96, 98, 172, 230, 231.
Siarczek dwuchlorodwuetylu. Tiodiglykolchlorid. Dichloretylsulfid. Yperite (francuska nazwa maskująca). Senfgas. Gelbkreuzstoff (oznaczenia niemieckie) Mustard gaz, Lost. (oznaczenia angielskie).
Bezbarwny oleisty płyn. W nieoczyszczonym stanie (produkt techniczny) gęsty żółty lub bronzowy olej o nieprzyjemnym zapachu podobnym do chrzanu; p. w. 215 — 217; p. t. 14°; d/p 5,5. Maksymalna zawartość w powietrzu (w temperaturze 15°) 0,655/M3; d. 1,27. G. w. 0,00005/M3 (skóra i oczy). G. n. d. g. 2/M3 G. n. d.d. 3/M3 St. w. ś. 1/M3; St. a. ś. 2/M3. (Stężenia wyżej od 0,655/M3 osiągano przy pomocy rozpylania rozczynów). T. s.; T. o. wywołuje anatomiczne uszkodzenia oczu, skóry, dostępnych sluzówek, jelit i oskrzeli. VII 17 N.; VI 18 F; IX 18 An.
Jumellite (CH2Cl (CH2)3 )2 S.
Środek mniej czynny niż iperyt.
Izosiarkocyjanki 230.
Izosiarkocyjanek allylu NCS. C3H5 230.
Zwykły olejek gorczyczny.
Płyn z p. w. 143°; d. 1,015. 11 F. (do ręcznych granatów policyjnych) Dr. L.
Kakodyl As (CH3)2’ — Dość trwałe ugrupowanie występujące jako część składowa wielu połączeń organicznych arsenu. Połączenie dwóch takich ugrupowań (As (CH3)2)2 nazywamy właśnie kakodylem. Jest to oleisty płyn, zapalający się na powietrzu; p. w. 170° p. t. -6°.
Kamite P francuskie oznaczenie maskujące dla bromocyjanku benzylu C6H5CH.CNBr. F. Am 16.
125, 209, 215, 216.
Kampelit P (Kampellite) — mieszanina 25% CNBr, 25% CH2Br CO.CH3 i 50% C6H6 (bromku cyjanu, bromoacetonu i benzolu) Aust 18. VII. 216.
Karbonilki kobaltu. Co(CO)3 i Co (CO)4. Stałe krystaliczne ciała pomarańczowego (Co(CO)4) lub czarnego koloru (Co(CO)3) p. t. (Co(CO)4) 51°. Toksykologicznie niezbadane.
Karbonilek niklu. Ni (CO)4 243, 249, 250. Bezbarwny mocno załamujący światło płyn; p. w. 43; p. t. -25; d. 1,32.
Karbonilki żelaza, 243, 249, 250. Fe(CO)4; Fe(CO)5; Fe2(CO)9. Fe(CO)5 jest to żółty płyn o p. w. 102°,7 i d. 1,49. Przy ogrzewaniu rozkłada się na Fe(CO)4 i CO. (140°), przy działaniu promieni słońca tworzą się czerwone kryształy Fe2(CO)9. H2SO4 rozkłada pięciukarbonilek żelaza według równania Fe(CO)5 + H2SO4 = FeSO4 + H2O + 5CO. Powstaniem karbonilków żelaza tłumaczono przepuszczalność nagrzanych części żelaznych pieców dla czadu. Działanie toksyczne jest mało zbadane.
Kantarydyna. C10H12O4. 20, 229.
Czynny składnik ciała pewnych chrabąszczów (Fam. Meloidae), używanych w stanie proszku jako pryszczydło. Najpospolitszym z nich jest majka Lytta vesikatoria. T. s. T. o (zapalenie nerek).
Kapsycyna. Czynny składnik pieprzu czerwonego T. s.; Dr. d. g. 229.
Karbiloaminy = izocyjanki.
Kardol. C21H30O2. Oleisty płyn o właściwościach żrących otrzymany z łupin nasion roślin Anacardium orientale i Semecarpus anacardium (Ameryka południowa, Afryka, Indje zachodnie). T. s. o właściwościach żrących i drażniących. 229.
Kurare. Skomplikowana mieszanina trucizn roślinnych (przeważnie z rozmaitych Strychnos) używana przez tubylców Ameryki podzwrotnikowej jako trucizna do strzał.
K Stoff = palit: chloromrówczan chlorometylu.
Kwas chlorosulfonowy HO.SO2Cl. 182. Bezbarwny płyn; p. w. 153°; d. 1,776; D. St. a. ś.>6/M3. Dym bojowy N. F. 16.
Kwas pruski HCN 24, 93, 94, 97, 102, 124, 176, 207, 243. Formonitryl. Forestite (francuska nazwa maskująca). Vincennite P (mieszanina HCN, AsCl3 XV i CHCl3 (chloroform). Bezbarwny płyn, w stężonym stanie posiada właściwości drażniące i pachnie pluskwami, w rozcieńczeniu posiada zapach gorzkich migdałów;
p. w. 26°; p. t. -15; d. 0,69; d/p 0,94; St. a. ś. 0,1/M3, 16. VII. F. 16. Aus. An. R.
Kwas siarkawy (siarczyny) SO2. 182, 183.
Aphonite (oznaczenie maskujące francuskie). Bezbarwny gaz, d/p 2,265; p. w. -10,1; d. (płyn. SO2 w temperaturze -8°) 1,76. p. t. -72,°01, kryt. temp. +157°. Rozpuszcza się w wodzie w stosunku 80.000:1. St. w. ś. 400/M3 (Kobert) St. a. ś. 800/M3 G. w. 0,02/M3 G. n. 0,06/M3 (Lehman). Jako gaz bojowy nieużyteczny.
Lakrymite francuskie oznaczenie maskujące dla tiofosgenu CSCl2.
Lakrymatory — środki łzawiące 213.
Loszczydło gargańskie 223 (Thapsia garganica). Roślina południowo-europejska o żrących właściwościach. F.
* Luizyt Cl.CHCH.AsCl2. 6, 26, 30, 219, 238, 239. Chlorowinylodwuchloroarsyna.
Bezbarwny lub żółtawy płyn o wysokim punkcie wrzenia; p. w. (przy 26 mm Hg.) 93°C. W temperaturze 3 — 4°C zastyga na masę krystaliczną. Maksymalne stężenie pary w temperaturze 15° = 4/M3. Techniczny produkt (bronzowy oleisty płyn) jest to mieszanina trzech chlorowinyloarsyn i chlorku arsenu. T. o.; T. s.; Dr. d. d. 1918. Am. W wojnie światowej nie był używany.
Mauginite P. — mieszanina 70% chlorocyjanu i 30% chlorku arsenu CNCl + AsCl3 F. 1918. 216.
Marsite francuskie oznaczenie maskujące dla chlorku arsenu AsCl3.
Martonite mieszanina chloroacetonu i bromoacetonu. Francuskie oznaczenie maskujące 173, 209, 212.
Metylodwuchloroarsyna = dwuchlorometyloarsyna AsCH3Cl2. 219.
Metylodwubromoarsyna AsCH3Br2 dwubromometyloarsyna 219.
Mieszanina Bergera do świec dymowych 182, 196.
Mydłoka. 218. Kora czylijskiego drzewa Quilaja saponaria, zawierająca obfitą ilość pewnej saponiny — kwasu kwilajowego; T. o.; T. s.
Nikelcarbonyl p. Karbonilek niklu.
Nikotyna, C10 H14 N2. 262. Bezbarwny płyn, który przybiera na powietrzu ciemne zabarwienie d15° 1,011; p. w. 242°. Czynny składnik tytoniu, który zawiera 0,5 — 2,8% nikotyny. Jadowitość: d. let. 0,01 na kg.
Nitrochloroform = chloropikryna.
Olej krotonowy. Olej tłuszczowy z nasion rośliny Croton tiglium. Jeden z najsilniejszych środków drażniących. T. o.; T. s. 229.
Olejki gorczyczne. 216, 229.
Oleum. 70% rozczyn bezwodnika kwasu siarczanego SO3 w kwasie siarczanym H2SO4. W temperaturze pokojowej stałe ciało, przy ogrzewaniu tworzy się oleisty płyn dymiący na powietrzu. Używany jako dym bojowy (Am).
Opacite francuskie oznaczenie maskujące dla czterochlorku cyny Sn Cl4.
Opjum — wysuszony sok z główek maku (Papaver somniferum). Ciemno bronzowa masa o charakterystycznem zapachu. Zawiera oprócz innych domieszek około 10 — 15% alkaloidów, z których najobfitszym jest morfina. C17H19NO3. + H2O. Najwięcej trujący z alkaloidów opjum jest tebaina (trucizna wywołująca skurcze podobne do skurczów spowodowanych przez użycie strychniny).
Palite francuskie oznaczenie maskujące dla chloromrówczanu chlorometylu. ClCO2CH2Cl.
Papite francuskie oznaczenie maskujące dla akroleiny CH2CH.COH.
Perchlorometylomerkaptan = czterochlorek siarczku węgla CSCl4.
Perstoff = superpalit: niemieckie oznaczenie maskujące dla chloromrówczanu trojchlorometylu Cl. CO2 C Cl3.
Pieprz czerwony. Owoce rośliny Capsicum annuum, zawierające bardzo drażniącą substancję kapsicynę. Dr. St. (przenika przez pochłaniacze masek) T. s. Am. 218.
Pieprz kajeński. Owoce rośliny Capsicum crassum, z Ameryki podzwrotnikowej. Jeszcze więcej drażniący niż europejski pieprz czerwony. 218.
Rationite francuskie oznaczenie maskujące dla siarczanu metylu (CH3)2 SO4.
Rodanki = siarkocyjanki.
Sabadilla. Nasiona rośliny Veratrum sabadilla, zawierające alkaloid weratrynę, środek o własnościach bardzo drażniących. 217.
Saponiny. Szereg trujących substancyj, pozbawionych azotu, zawartych w wielu roślinach. Wywołują one hemolizę i wyraźne miejscowe zapalenia. Odpowiednich roślin używano zamiast mydła. T. o. Dr. St. 18. 218.
Scopolia atropoides. Lulecznica 263. Roślina zachodnio europejska.
Siarczan etylu SO4 (C2H5)2 94, 96, 182, 184, p. w. 208°; p. t. -24; d. 1,84. Dr. d. g.; D.; T. s.
Siarczan metylu SO4 (CH3) 94, 96, 182, 184. Rationite francuskie oznaczenie maskujące, C — Stoff — oznaczenie niemieckie. p. w. 188°; p. t. -27°. d 1,33. St. w. ś. 0,5/M3 St. a. ś. 1/M3 (świnka morska) Dr. d. g.; T. s. Bezbarwny płyn pozbawiony zapachu.
Siarczek allylu. S. (CH2:CHCH2)2 216. Czynny składnik olejku eterycznego zwyczajnej cebuli (Alium cepa). Płyn o p. w. 138°; d. 0,888.
Siarczek allylo-propylu. (CH2:CH. CH2)S2CH2CH2CH2 216. Czynny składnik eterycznego olejku czosnku (Alium satiwum). Płyn p. w. 69°.
Siarczek winylu (CH2:CH)2 S. 216. Czynny składnik olejka eterycznego niedźwiedziej cebuli (Alium ursinum). Płyn p. w. 101°; d 0,912.
Śmierdzące płyny drażniące, wywołujące łzawienie; dla celów bojowych nieużyteczne.
Siarczek dwuchlorodwuetylu = iperyt 230.
Siarczek dwuchlorodwumetylu (ClCH2)2S. 231.
Siarczek węgla CS2. 172, 176, 207. 243. Deissite (nazwa maskująca francuska). Bezbarwny płyn; p. w. 46,2; p. t. -110; d. 1,262. G. n. 0,01/M3. T. o. Tworzy z powietrzem mieszaniny wybuchowe i łatwo pali się, dając CO2 i SO2. Używany jako rozczynnik dla innych środków bojowych, p. czterochlorek siarczku węgla i tiofosgen.
Siarkotlenek węgla COS. Bezbarwny gaz, d/p. 2,1; d (płynnego COS) 0,83 (stałego 1,2) p. w. -50°; p. t. -138°. T. o. St. w. ś. >4/M3. Drażniących właściwości nie posiada. Jako środek bojowy nieużywany.
Siarkoetery 216.
Siarkowodór F. H2S 11, 24, 94, 96, 172, 176, 207, 243.
Bezbarwny gaz cuchnący o p. w. 61,°7; p. t. 83° d/p. 1,19; d (-60°) -0,96 St. a. ś. 2/M3. T. o. 16 An. (fale razem z chlorem).
Sternite nazwa francuska mieszanina — As Cl3, C6H5AsCl2, (C6H5)2 As Cl i (C6H5)3 As. (trójchlorku arsenu, fenylodwuchloroarsyny, dwufenylochloroarsyny i trójfenyloarsyny). Później nazwy sternit używano jako ogólnego oznaczenia środków wywołujących kichanie. 172.
Strofant. Trucizna do strzał używana przez tubylców podzwrotnikowej Afryki, otrzymana z nasion Strophanthus Combe. Zawiera alkaloid strofantinę jedną z najmocniejszych trucizn sercowych. 20.
Sulvinite P. mieszanina chlorosiarczanu etylu, chlorku sulfurylu i chlorku pyrosulfurylu F 16. 18, 143, 183.
Superpalit (surpalite) nazwa francuska dla chloromrówczanu trójchlorometylu.
Survaillantite (francuskie oznaczenie maskujące) = chlorosulfonian chlorku metylu. ClSO2 OCH2Cl. Jest mniej napastliwy niż vaillantite ClSO2OCH3. Jako środek bojowy nie używany.
Tabaka. Proszek z liści tytoniu 217.
Tiofenol. C6H5SH. T. s. 230.
Tiofosgen P. CSCl2 176, 182, 207, 212, 215. Lakrimite oznaczenie maskujące francuskie (p.
Claircite) chlorosiarczek węgla.
Czerwony płyn dymiący na powietrzu o nieprzyjemnym drażniącym zapachu, p. w. 75°; d. 1,508. St. w. ś. 4/M3; St. a. ś. 6/M3 F 16.
Tiowęglan sodu. Siarkowęglan sodu Na2CS3. 261. Biały proszek o wstrętnym zapachu.
Tlenki azotowe NO; N2O3; NO2; N2O4 11, 14, 178, 182, 197, 202. Składniki gazów wybuchowych p. Clastite.
Tlenek dwubromometylu = eter dwubromometylowy.
Tlenek dwufenyloarsyny ((C6H5)2As)2O 210, 220. Krystaliczne ciało; p. t. 91 — 92°.
Tlenek etyloarsyny C2H5AsO 210, 220. Bezbarwny oleisty płyn; p. w. (10 mm Hg) 158°.
Tlenek fenyloarsyny C6H5As O. 220. Krystaliczne, przyjemnie pachnące ciało, p. t. 120°.
Tlenek metyloarsyny CH3AsO 210, 219. Bezbarwne krystaliczne ciało; p. t. 95°.
Tlenek kakodylu As(CH3)2O As (CH3)2 = tlenek dwumetyloarsyny 210, 219. Oleisty płyn o okropnym zapachu, p. w. 120°; p. t. -25° d15 1,462.
Tlenek węgla CO. Czad 11, 24, 25, 243. Bezbarwny gaz pozbawiony zupełnie zapachu, d/p 0,967; p. w. -190°. (kryt. temp -197°); p. t. -207. St. a. s. 2 — 3/M3 St. w. ś. 0,6/M3 (dla człowieka). Główny trujący składnik gazów wybuchowych.
Tonite francuskie oznaczenie maskujące dla chloroacetonu.
T. Stoff niemieckie oznaczenie maskujące dla bromku ksylylu.
Trojchlorek antymonu Sb Cl3, 205. Masło antymonowe. Butyrum antimonii. Krystaliczna biała masa; p. t. 73°2; p. w. 223°; d 3,064. Rozkłada się w wilgotnem powietrzu według wzoru Sb Cl2 + H2O = SbOCl + 2HCl i posiada żrące właściwości.
Trójchlorek arsenu AsCl3, 172, 205, 210. Marsite (francuskie oznaczenie maskujące). Bezbarwny płyn dymiący na powietrzu; p. w. 130°2; p. t. -18°; d (20°) 2,167; d/p 6,3; St. w. ś. 0,2/M3; St. a. ś. 6/M3; G. n. 0,1/M3. Używany jako dym bojowy, a przedewszystkiem jako domieszka do innych środków bojowych, zapobiegająca ich rozkładowi (patrz Vincennite).
Trójchlorek fosforu PCl3, 205.
Bezbarwny płyn dymiący na powietrzu o drażniącym, wywołującym łzawienie zapachu; p. w. 76°; p. t. -115°; d (20°) 1,577. Z wodą, względnie wilgocią powietrza, daje kwas fosforawy PH2O2. Dość słaby i mało używany dym bojowy.
Trójchlorhydryna CH2Cl.CHCl.CH2Cl 229.
Według Koberta posiada wyraźne żrące właściwości; według danych francuskich autorów jest ich zupełnie pozbawiona.
Trójchlorometylomerkaptan CCl3SH. Produkt chlorowania siarczku węgla.
Trójchlorowinyloarsyna (CHCl:CH)3 As = Luizytc. 234.
Trójfeniloarsyna (C6H5)3 As 46. Bezbarwne krystaliczne ciało; p. t. 58°; p. w. 360°.
Trużyn wymiotowy 217.
Korzeń amerykańskiej rośliny Cephaelis Ipecacuanha, zawierający alkaloid emetynę, który wywołuje oporne wymioty i drażni wszystkie slużówki.
Vaillantite P. francuskie oznaczenie maskujące dla chlorosiarczanu metylu ClSO2OCH3 16 F.
Vincennite P. francuskie oznaczenie maskujące — mieszanina 50% kwasu pruskiego, 30% chlorku arsenu AsCl3, 15% czterochlorku cyny SnCl4 i 5% chloroformu CHCl3. Anglicy używali mieszaniny 55% HCN, 20% AsCl3 i 25% CHCl3. Domieszki zapobiegają rozkładowi HCN. 16 F. A.
Vomiting gaz = chloropikryna C(NO2)Cl3 (oznaczenie angielskie).
Vulkanite = dwuchlorek siarki SCl2.
Węglany metylowe CO(OR)2 189.
Szereg pochodnych kwasu węglowego i chlorowanych rodników alkoholowych. Zwykła domieszka palitów i superpalitów.
Weratryna. C37H53NO11. 217. T. o.; T. s.
Alkaloid czemerycy i sabadylly. Wywołuje silne miejscowe podrażnienia i działa trująco w znikomych dawkach.
Womitatory = Womitory — środki wywołujące wymioty.
1914 r.
1. Trémoliers F. et Loew P. Effets des gaz irritants des projectiles de guerre. Bull. et mém. Soc. méd. et hop. de Paris. 1914. p. 597. (cit. w. Nr. 30).
1915 r.
2. Achard C. Sur l'asphyxie par les gaz toxiques des projectiles de guerre. Bull. de l'Acad. de Médicine. Paris. 1915.
3. Biełow. Otrawlenje uduszliwymi niemieckimi gazami. Russkij Wracz. 1915.
4. Campbell H. Poisonous gases. Brit. Med. Journ. 1915.
5. Freise. Ueber Vergiftung durch Pulvergase. Med. Klin. 1915. XI.
6. Hill L. Gas poisoning. Brit. Med. Journ. 1915.
7. Lévy F. Étude sur le syndrome respiratoire consecutif à l'absorption des gaz asphyxiants. Presse med. 1915. XXIII.
8. Lervin L. Ueber Vergiftung durch kohlenoxydhaltige Explosionsgaze aus Geschossen. Münch. med. Woch. 1915.
9. Parker B. Poisonous gases. Brit. Med. Journ. 1915.
10. Pożariskij. Patołogoanatomicznyja izmienienja w trupach umierszich od otrawlenja uduszliwymi gazami. Russkij Wracz. 1915.
11. Roberts A. A. The Poison War. London. 1915.
12. Schäfer E. On the immediate effects of the Inhalation of chlorine gas. Brit. Med. Journ. 1915.
13. Wainwright L. What is the gas? Lancet. 1915.
1916 r.
14. Czugunow S. A. Razstrojstwa nierwnoj sistemy pośle otrawlenja uduszliwymi gazami. Wojenno Med. Żurnał. Pietierburg. 1916.
15. Sisto. L’avellamento per gas asfissianti. Reforma med. 1916. XXXII.
1917 r.
16. Boldyrew W. Leczenje otrawlenych uduszliwymi gazami. Russkij Wracz, 1917.
17. Foy G. Poisonous gas. Med. Presse and Circular. 1917. CIII.
18. Knack. Kampfgasvergiftungen. Deut. Med. Woch. 1917.
19. Kramer. Ueber Chlorgasvergiftung. Vierteljahrsschrift ür gerichtliche Medicin. 1917. Hft 2.
20. Kruglewskij. Miechanizm wozniknowienja ostrago oteka pri otrawlenju uduszliwymi gazami. Russkij Wracz. 1917.
21. Magnus. Kampfgasvergiftungen. Deut. Med. Woch. 1917.
22. Miller I. and Rainy H. A Note on the blood changes in gas poisoning. Lancet. 1917.
23. Stempowski. Traitement de l’intoxication par l’oxychlorure de carbone. Presse med. 1917.
24. Tizenhauzen M. Patołogiczeskaja anatomja otrawlenych gazami. Russkij Wracz. 1917.
1918 r.
25. Pick F. Ueber Erkrankung durch Kampfgaze. Wien. Klin. Woch. 1918.
1919 r.
26. Ricker. Beitraege zur Kenntniss der toxischen Wirkung des Chlorkohlenorydgases (Phosgen). Volkmanns Klinische Vortrage N. F. Innere Medicin. Nr. 256/260. 1919.
27. Warthin P. and Weller C. W. The medical aspects of mustard gas poisoning. London. 1919. (Obfity wskaźnik wszechświatowej literatury zatruć gazowych, zawierający 214 wskazówek z ogólnej literatury zatruć bojowych i 49 wskazówek co do iperytu).
1920 r.
28. Kerschbaum. Die Gaskampfmittel in M. Schwarte. Die Technik im Weltkriege. Berlin. 1920.
29. Moureu C. La chimie et la guerre. Paris. 1820.
30. Töpfer. Pionierwesen im M. Schwartes. Die militärischen Lehren des grossen Krieges. 1920.
31. Winternitz M. C. U. S. A. Collected studies of the Pathology of War gas poisoning from the Department of Pathology and Bacteriology of. Med. Sec. Chem. Warfare Service. New Hawen. 1920.
32. Frank Underhill. The lethal War gases. Physiology and experimental therapeutics. An investigation on intermediary metabolizm by the section of the medical division of the Chemical Warfare Service at Jale Uniwersity. New Hawen. Jale Univ. Presse. 1920.
33. Reizenstein F. Die Entwickelung des Gaskampfes. Chemikerzeitung. 1920.
1921 r.
34. Fries A. and West C. Chemical Warfare. New-York. 1921.
35. Lefebure. The Riddle of the Rhine. London. 1921.
36. Ryba. Der Gaskampf und die Gasschutzgeräte im Weltkriege 1914 — 1918. Töpliz-Schönau. 1921.
37. Minkowski O. Die Erkrankungen durch Einwirkung giftiger Gaze. Handbuch der ärtztlichen Erfahrungen im Weltkriege 1914 — 1918. Bd. III. Inn. Med.
38. Flury F. Ueber Kampfgasvergiftungen I. Zeitschrift f. d. gesammte experimentelle Medicin Bd. XIII.
39. Rona P. Ueber Kampfgasvergiftungen II. (Ueber Zersetzung der Kampfstoffe durch Wasser). Zeitschrift f. d. gesammte experimentelle Medicin. Bd. XIII.
40. Laqueur E. und Magnus R. Ueber Kampfgasvergiftungen III. (Experimentelle Pathologie der Phosgenvergiftung). Zeitschrift f. d. gesammte experimentelle Medicin. Bd. XIII.
41. Heitzmann O. Ueber Kampfgasvergiftungen IV. (Ergänzende Befunde zur pathologischen Anatomie der Phosgenvergiftung). Zeitschrift für d. gesammte experimentelle Medicin. Bd. XIII.
42. Laqueur E. und Magnus R. Ueber Kampfgasvergiftungen V. (Experimentelle und theoretische Grundlagen zur Therapie der Phosgenerkrankung). Zeitschrift f. d. gesammte experimentelle Medicin. Bd. XIII.
43. Gildemeister M. und Heubner W. Ueber Kampfgasvergiftungen VI. (Die Chloropikrinvergiftung). Zeitschrift f. d. gesammte experimentelle Medicin. Bd. XIII.
44. Flury F. und Wieland H. Ueber Kampfgasvergiftungen VIII. (Die pharmakologische Wirkung des Dichloräthylsulfids). Zeitschrift f. d. gesammte experimentelle Medicin. Bd. XIII.
45. Heitzmann Otto. Ueber Kampfgasvergiftungen VIII. (Die pathologischanatomischen Veränderungen nach Vergiftung mit Dichloräthylsulfid unter Berücksichtung der Thierversuche). Zeitschrift f. d. gesammte experimentelle Medicin. Bd. XIII.
46. Flury F. Ueber Kampfgasvergiftungen. (Lokal reizende Arsenverbindungen). Zeitschrift f. d. gesammte experimentelle Medicin. Bd. XIII.
1922 r.
47. Clerc A. et Ramond L. Les intoxications par les gaz de guerre. Nouveau traité de medicine p. Roger, Widal et Teissier. Fasc. VI. Intoxications. Paris. (Masson). 1922.
48. Nordmann C. La guerre de gaz et l’avenir. Revue de deux Mondes. 1922.
49. Thorne. The Riddle of the Rhine. The New-York Times Book. 1922.
1923 r.
50. Schwarte M. Die Technik im Zukunftskriege. Charrottenburg. 1923.
1924 r.
51. Haber F. Die Chemie im Kriege.
52. „ „ Zur Geschichte des Gaskampfes. Berlin. 1924.
53. Fiszman I. Gazowaja wojna. Pietierburg. 1924.
54. Aksionow A. Bojewyje otrawlajuszczija weszczestwa. Moskwa. 1924.
1925 r.
55. Hanslian und Bergendorff. Der chemische Krieg. Berlin. 1925.
56. Vedder E. The medical aspects of chemical warfare with a chapter on the naval medical aspects of chemical warfare by D. Walton. Baltimore 1925.
Oprócz tych źródeł obfita ilość artykułów francuskich badaczy A. Mayera, Tissota, Guignarda, Acharda i innych znajduje się w Comptees-rendues de l’Academie des Sciences, jak również w rządowych wydaniach angielskich i amerykańskich. (Oficial History of the War. London. 1923. Chemical Warfare Medical Committees Reports, 1918. Journ. Royal Army Med. Corps. 1915 — 1919).
W literaturze polskiej jedynemi poważniejszemi pracami są p. płk. Z. Wojnicz-Sianożęckiego (Chemja materjałów bojowych) i płk. S. Marzeckiego (Ogólne zasady toksykologji oraz patologji i terapji zatruć gazami bojowemi). Są to litografowane wykłady opublikowane jako wydania służbowe w r. 1922.
Popularnemi wydawnictwami mającemi na celu szerzenie wiadomości o wojnie chemicznej wśród publiczności są:
Wojna chemiczna i obrona kraju. 1924. płk. Z. Wojnicz-Sianożęcki i mjr. F. Sarnek.
Wojna chemiczna (wyd. II). 1924. płk. Małyszko.
Walka chemiczna w przyrodzie. 1924. prof. W. Lindeman.
| Na stronie: | wiersz: | jest: | powinno być: | ||
| 6 | 12 od góry | zabarwiają się | bo zabarwiają się | ||
| 19 | 11 „ „ | chorobliwy | chorobowy | ||
| 31 | 13 z dołu | steryny; | steryny. | ||
| 51 | 20 od góry | soli | sola | ||
| 63 | 14 z dołu | (0,8.107/2 | ((0,8.107)2 | ||
| 66 | 9 od góry | węglodanów | węglowodanów | ||
| 66 | 22 „ „ | CO | CO2 | ||
| 71 | 10 z dołu | + H2O− | + H2O = | ||
| 72 | 1 od góry | hydralizuje | hydrolizuje | ||
| 81 | 8 „ „ | ich | jej | ||
| 81 | 16 „ „ | laenenkowska | laennekowska | ||
| 94 | 10 „ „ | 1,5 | 15′ | ||
| 117 | 7 „ „ | V% | V | ||
| 134 | 4 z dołu | arsenowy | arsenawy | ||
| 136 | 1 od góry | =C=C=C | =C=C= | ||
| 136 | 10 „ „ | tautometryczne | tautomeryczne | ||
| 137 | 4 z dołu | (CH3)2CO | (CH3)2CC | ||
| 141 | 9 od góry | węglowodany | węglowodory | ||
| 145 | 5 „ „ | flogogenne) | (flogogenne) | ||
| 149 | 21 „ „ | środka | stopnia | ||
| 156 | 1 z dołu | siarczan | siarczyn | ||
| 157 | 8 „ „ | . Mamy | , mamy | ||
| 181 | 9 „ „ | zarazikowego | zrazikowego | ||
| 183 | 10 „ „ | ClS2HO5 | Cl2S2O5 | ||
| 186 | 16 od góry | HCCO | H Cl O | ||
| 189 | w lewem szeregu 5 wzór z dołu |
CO< | CH3 CH3 |
CO< | OCH3 OCH3 |
| 197 | 2 od góry | Dwutlenków | Tlenków | ||
| 197 | 8 z dołu | arsenowy | arsenawy | ||
| 200 | 8 od góry | guaninidiny | guanidiny | ||
| 205 | 14 „ „ | Ti(OH4) | Ti(OH)4 | ||
| 209 | 7 z dołu | C6H4CH2B.CH3 | C6H4CH2Br.CH3 | ||
| 231 | 16 „ „ | 12 II 1917 | 12 VII 1917 | ||
- ↑ Przyczyną nagromadzenia komórek wędrujących w ognisku zapalnem jest chemotropizm.
- ↑ Według Abderbaldena z pierwiastków tych zawartość jodu waha się pomiędzy 0,00976 i 0,00032 na 1000,0 tarczycy, albo płuc, zawartość manganu dosięga (w wątrobie kury) aż do 0,000416%, dość znaczna stosunkowo jest zawartość krzemu, w suchych włosach aż do 0,5%, w pępowinie (suchej) 0,015%.
- ↑ W śmiertelnym zatruciu królika kwasem solnym znaleziono 1,2.10−6 = PH = 5,92
W razie śmiertelnej komy w cukrzycy obserwowano 1,5.10−7, skąd PH = 6,046, lub 6,824, czyli że odczyn był wyraźnie kwaśny. W śmiertelnych zatruciach gazowych mamy dla chloru PH 7,25—7,3; dla fosgenu 7,2—7,4; dla chloropikryny 7,5—7,7.











